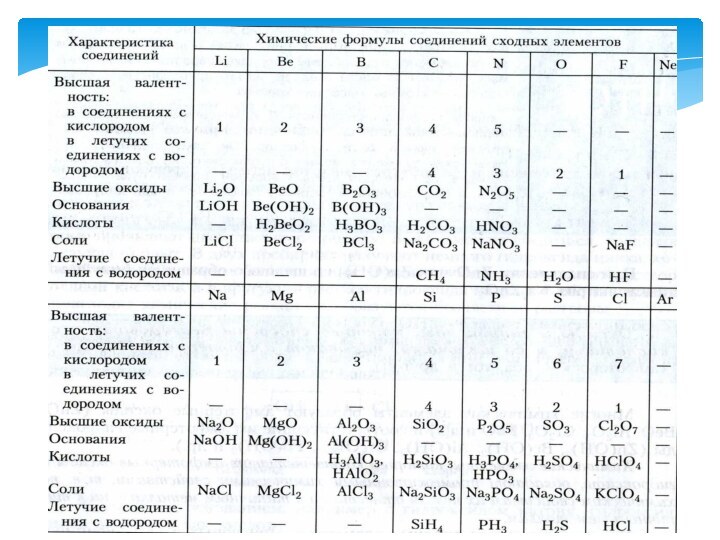
MgO, CaO, BaO, K2O.
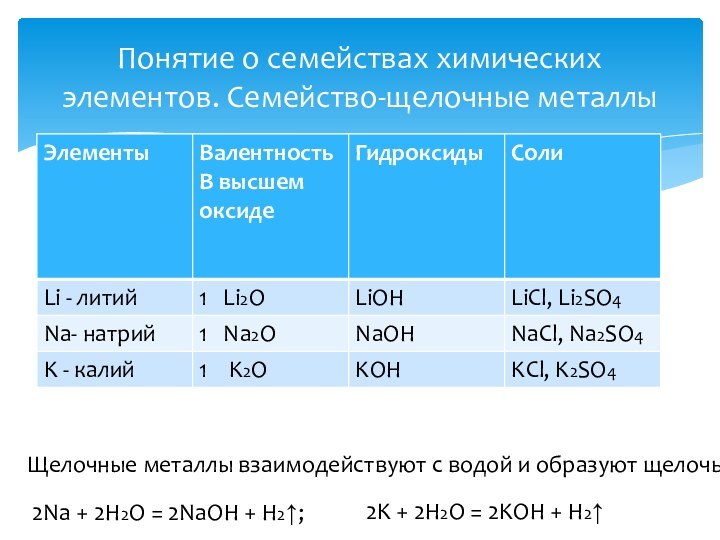
2Ca + O2 = 2CaO
оксид кальциякоторому соответствует основание
СaO + H2O = Ca(OH)2 гидроксид кальция
Основание реагирует с кислотой,
образуя соль и воду:
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
хлорид кальция
Металл вытесняет из кислот водород:
Mg + H2SO4 = MgSO4 + H2↑.
сульфат магния
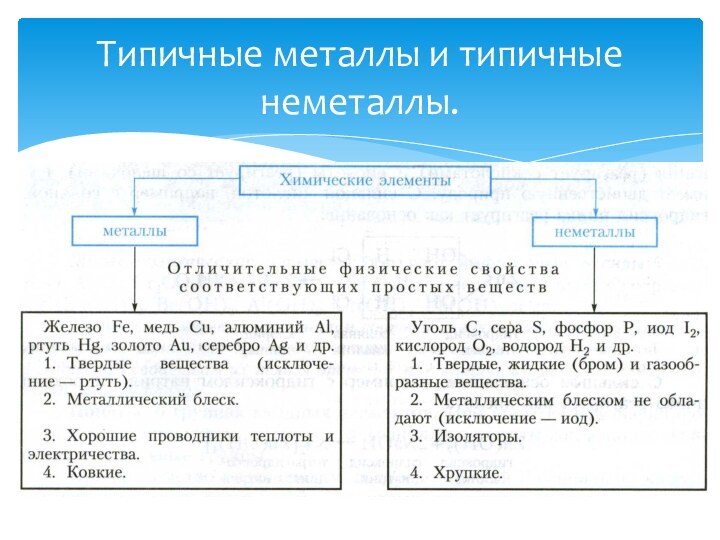
Типичный неметалл
взаимодействует с кислородом
и образует кислотный оксид:
CO2, SO2, P2O5, SiO2, SO3.
4P + 5O2 = 2P2O5
Которому соответствует кислота
P2O5 + 3H2O = 2H3PO4
Кислота реагирует с основанием,
Образуя соль и воду:
H3PO4 + 3NaOH = Na3PO4 + 3H2O
Неметалл с кислотой не реагирует.
Неметалл реагирует с водородом и образует летучее водородное соединение:
S + H2 = H2S.