- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Контроль знаний на уроках химии
Содержание
- 2. Элементы и атомы,
- 4. ТЕСТОВЫЙ КОНТРОЛЬ ЗНАНИЙ ПО ХИМИИТесты используются
- 5. Тест выборки представляет собой задания, включающие готовый
- 6. Тест дополнения представляет собой задание с пропуском
- 7. Тест группирования включает в себя перечень химических
- 8. Тест ранжирования представляет собой перечень (не более
- 9. Тест сличения превалирует в части В ЕГЭ
- 10. Тест напоминания требует от выполняющего ответа на
- 11. Альтернативные тестовые задания еще не включались в
- 12. Тема урока: «Физические и химические явления».Цель урока:
- 13. ЯвленияФизическиеХимическиеЯвление не сопровождается образованием новых веществ. Оно
- 14. Закрепление(устно) Тест напоминания.О каком явлении говорится
- 15. Признаки химических реакций:Изменение цвета;Изменение запаха;Выпадение (растворение) осадка;Выделение газа;Выделение (поглощение) теплоты.
- 16. Лабораторная работа.Цель: на практике изучить признаки
- 17. Правила техники безопасностиЧтобы не подвергать свою жизнь
- 18. Правила техники безопасностиВещества в лаборатории на вкус
- 19. Опыт 1. Горение лучины.
- 20. Опыт 2. Взаимодействие
- 21. Опыт 3. Взаимодействие щелочи
- 22. Опыт 4. Взаимодействие сульфата
- 23. Тест сличения.Установите признаки проделанных химических реакций:Взаимодействие сульфата
- 24. Тест группированияИз приведенного перечня явлений выберите те,
- 25. Скачать презентацию
- 26. Похожие презентации
Элементы и атомы, В менделеевский взятые круг Сделали химию самой богатой И самой творческой из наук. Г.Санников
























Слайд 2 Элементы и атомы, В менделеевский
взятые круг
Сделали химию самой богатой
И самой творческой из наук.
Г.СанниковСлайд 3
Kонтроль результатов обучения учащихся – неотъемлемая
часть учебного процесса. Это сложный и многогранный процесс, важный и для учителя, и для учащихся. Kонтроль знаний стимулирует систематическую работу над учебным материалом и над собой, позволяет увидеть просчеты и достижения в методике преподавания. Во время контроля особенно удобно осуществлять дифференцированное обучение и индивидуальный подход к учащимся. Таким образом благодаря контролю знаний и умений школьников реализуется обратная связь от учеников к учителю, позволяющая оперативно регулировать ход учебного процесса.
Слайд 4
ТЕСТОВЫЙ КОНТРОЛЬ
ЗНАНИЙ ПО ХИМИИ
Тесты используются в образовательном
процессе уже около ста лет. Они представляют собой краткие
стандартизированные задания, по результатам выполнения которых можно судить об определенных знаниях, умениях и навыках испытуемого. В школьном учебном процессе тесты создаются применительно к заданным уровням обучения и учебным предметам, время их выполнения ограничено. Обычно тесты рассчитаны на групповое проведение, но они могут использоваться и индивидуально.В последние годы в связи с проведением в стране эксперимента по внедрению единого государственного экзамена (ЕГЭ) тестовые задания все чаще применяются учителями для контроля знаний, умений и навыков учеников. В химическом образовании могут быть использованы тестовые задания разного типа.
Слайд 5 Тест выборки представляет собой задания, включающие готовый
ответ, который учащиеся должны выбрать из нескольких (обычно четырех)
предложенных вариантов. Задания этого типа являются содержанием первой части (часть А) ЕГЭ по химии.Приведем примеры заданий такого теста.
1. Самый распространенный химический элемент в земной коре:
а) кремний; б) водород;
в) кислород; г) алюминий.
(Ответ. в.)
2. Число электронов на последнем энергетическом уровне в атоме азота равно:
а) 7; б) 14; в) 3; г) 5.
(Ответ. г.)
Слайд 6 Тест дополнения представляет собой задание с пропуском знака,
слова, цифры или формулы, отмеченным чертой или точками. Ответ
на него должен быть однозначным и кратким. Рассмотрим примеры нескольких заданий теста дополнения.1. Молекула озона состоит из … атомов кислорода. (Ответ укажите цифрой.)
(Ответ. 3.)
2. Предельный одноатомный спирт, образующий с метанолом простой эфир состава С3Н8О, называется .................................... . (Запишите название спирта по систематической номенклатуре в соответствующем падеже.)
(Ответ. Этанолом.)
Слайд 7 Тест группирования включает в себя перечень химических терминов
или формул, которые следует распределить по заданным признакам. Например,
1. Из предложенного перечня выпишите формулы кислот:
СаО, Н2СО3, Сu(ОН)2, Н3РО4, NaHSO3,
H2O, HI, KNO3, Cl2O7, HNO3.
(Ответ. Н2СО3, Н3РО4, HI, HNO3.)
2. Выпишите в две колонки названия чистых веществ и смесей: морская вода, крахмал, сахар, молоко, серебро, уксусная кислота, туман, кислород.
Ответ.Чистые вещества:Kрахмал, сахар, серебро, уксусная кислота, кислород.
Смеси: Морская вода, молоко, туман.
Слайд 8 Тест ранжирования представляет собой перечень (не более десяти)
однопорядковых химических формул, физических или химических величин, химических явлений,
которые требуется расположить в заданном порядке. Приведем примеры заданий теста ранжирования.1. Расположите следующие химические элементы в порядке убывания радиусов их атомов:
K, Fr, Cs, Li, Na, Rb.
(Ответ. Fr, Cs, Rb, K, Na, Li.)
2. Расположите перечисленные вещества в ряд по мере усиления их кислотных свойств: фенол, этанол, 2,4,6-тринитрофенол.
(Ответ. Этанол, фенол, 2,4,6-тринитрофенол.)
Слайд 9 Тест сличения превалирует в части В ЕГЭ по
химии. Суть выполнения заданий такого теста сводится к нахождению
соответствия между представленными в разных столбцах данными (словами, предложениями, формулами). Столбцы необходимо расположить на одной странице. Для усложнения выбора правильного ответа в одном из них должно быть на 2–3 пункта больше. Приведем примеры различных заданий теста сличения.1. По названию вещества установите, к какому классу неорганических веществ оно принадлежит.
1. Веселящий газ.
2. Поташ.
3. Kальцинированная сода.
4. Негашеная известь.
5. Едкое кали А. Kислоты.
Б. Соли.
В. Водородные соединения.
Г. Основания.
Д. Оксиды.
Е. Простые вещества.
Ж. Нитриды
(Ответ. 1 – Д, 2 – Б, 3 – Б, 4 – Д, 5 – Г.)
Слайд 10 Тест напоминания требует от выполняющего ответа на поставленный
вопрос. В части В единого государственного экзамена по химии
ответы на задания теста напоминания должны быть краткими в форме цифры, формулы или слова (словосочетания), а в части С – развернутыми, т. е. содержать весь ход рассуждений, необходимых расчетов.Рассмотрим несколько примеров тестовых заданий этого типа.
1. Укажите число неспаренных электронов в возбужденном атоме углерода.
(Ответ. 4.)
2. Напишите формулу соли, образующейся при взаимодействии известковой воды с избытком углекислого газа.
(Ответ. Ca(HCO3)2.)
3. Kакова реакция среды раствора сульфата железа(III)?
(Ответ. Kислая.)
Слайд 11 Альтернативные тестовые задания еще не включались в тесты
ЕГЭ по химии, но давно применяются учителями как в
письменной, так и в устной формах контроля. Этот вид тестовых заданий состоит из утверждений, правильность или неправильность которых следует установить. Обычно содержание альтернативного тестового задания по химии касается характеристики одного вещества (класса веществ, элемента, реакции) или предполагает сравнение двух веществ (классов веществ и т.п.). Форма ответа на задания такого теста может быть словесной (с помощью слов «да» или «нет», «правильно» или «неправильно») или графической (с помощью знаков «+», «^», если «да», и знака «–», если «нет»).Альтернативные тестовые задания с формой ответа в виде символов могут использоваться на уроках в графических диктантах по вариантам.
Слайд 12
Тема урока: «Физические и химические явления».
Цель урока:
познакомить учащихся с физическими и химическими явлениями;
Научить отличать химические явления по признакам.
Слайд 13
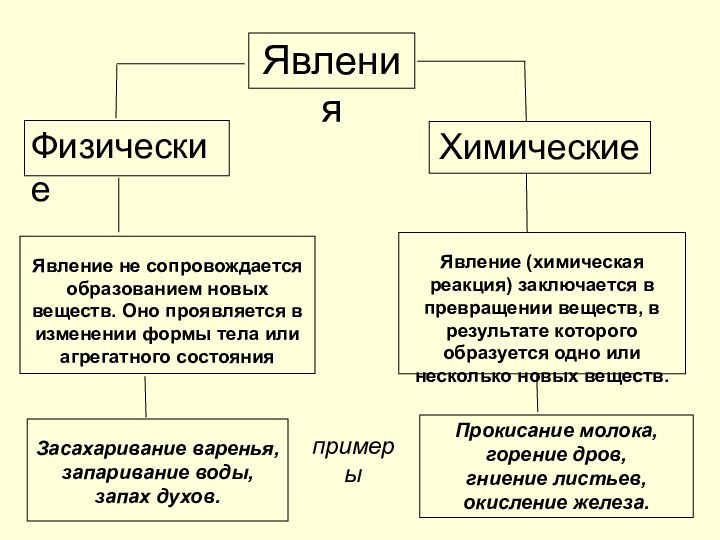
Явления
Физические
Химические
Явление не сопровождается образованием новых веществ. Оно проявляется
в изменении формы тела или агрегатного состояния
Явление (химическая реакция)
заключается в превращении веществ, в результате которого образуется одно или несколько новых веществ.
Засахаривание варенья, запаривание воды,
запах духов.
Прокисание молока,
горение дров,
гниение листьев,
окисление железа.
примеры
Слайд 14
Закрепление(устно)
Тест напоминания.
О каком явлении говорится в пословицах?
«Вода
камень точит» _____________
«Железо ржа поедает, а сердце печаль изнуряет»
____________«Дождик вымочит, а красное солнышко высушит» ______________________
«Изподволь и сырые дрова загораются» ______
«От одного порченого яблока целый воз загнивает» ______________________
Слайд 15
Признаки химических реакций:
Изменение цвета;
Изменение запаха;
Выпадение (растворение) осадка;
Выделение газа;
Выделение
(поглощение) теплоты.
Слайд 17
Правила техники безопасности
Чтобы не подвергать свою жизнь опасности,
Надо
знать технику безопасности:
Делаешь только то, что положено,
И при этом
очень осторожно.Сначала задачу реши теоретически,
Затем выполняй ее практически.
В химической лаборатории нельзя никогда
Голыми руками брать вещества.
Насыпаешь (наливаешь) вещества аккуратно,
Не высыпаешь (не выливаешь) вещества обратно.
С химическими веществами будь скупым -
Их количеством пользуйся небольшим.
Опыты делаешь тщательно
Над столом (лотком) обязательно.
Нельзя вдыхать пары и газы,
Если ты без противогаза.
Слайд 18
Правила техники безопасности
Вещества в лаборатории на вкус не
изучаются –
Это строго-настрого запрещается.
Нельзя смешивать или сливать
Все химические вещества
подряд.С едкими веществами (кислоты, щелочи) работать можно,
Но крайне осторожно.
Если кислоты или щелочи на тебя попадают,
Их большим количеством воды немедленно смывают.
Кислоту в воду добавляют –
Только так кислоту разбавляют.
Если жидкость воспламеняется легко,
Работаешь с ней от огня далеко.
С приборами нагревательными
Работай очень внимательно.
На рабочем месте – порядок и чистота,
Правило это выполняешь всегда.
Слайд 19
Опыт 1. Горение лучины.
Зажгите
спиртовку.внесите лучину в ее пламя.Через некоторое время выньте лучину
из пламени. Что наблюдаете? Образовалось ли новое вещество? Какой признак химической реакции вы наблюдали?
Слайд 20
Опыт 2. Взаимодействие
мрамора с кислотой.
Положите в пробирку 1-2 кусочка
мрамора. Прилейте столько соляной кислоты, чтобы ею покрылись кусочки. Что наблюдаете? Образовалось ли новое вещество? Какой признак химической реакции вы наблюдали?
Слайд 21
Опыт 3. Взаимодействие щелочи
с индикатором.
В пробирку налейте 2
мл щелочи NaOH, добавьте несколько капель фенолфталеина. Что наблюдаете? О чем говорит изменение окраски?Прилейте в эту пробирку осторожно немного раствора кислоты HCl. Что наблюдаете? Что наблюдаете? Какими внешними признаками сопровождались эти реакции?
Слайд 22
Опыт 4. Взаимодействие сульфата
меди(II) со щелочью.
В пробирку налейте
2 мл раствора сульфатамеди(II) CuSO4 и добавьте 1 мл щелочи NaOH. Что наблюдаете? К полученному осадку приливайте по каплям раствор кислоты HCl, пробирку осторожно встряхивайте.
Слайд 23
Тест сличения.
Установите признаки проделанных химических реакций:
Взаимодействие сульфата меди(II)
со щелочью.
Взаимодействие мрамора с кислотой.
Взаимодействие щелочи с индикатором.
Горение лучины.
А.
Выпадение (растворение) осадка;Б. Изменение цвета;
В. Выделение газа;
Г. Выделение теплоты.
Слайд 24
Тест группирования
Из приведенного перечня явлений выберите те, которые
относятся к физическим:
а) при нагревании вода превращается в пар;
б)
при пропускании через воду электрического тока образуются два газа – водород и кислород;в) при работе автомобильного двигателя бензин испаряется;
г) гашение соды раствором лимонной кислоты;
д) таяние льда.