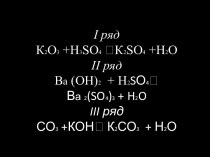Слайд 2
«Ядерная физика и технологии»,
«Физика материалов и процессов»,
«Ядерная физика
и космофизика»,
«Ядерная медицина»
«Физика элементарных частиц и космология»,
«Физика плазмы»,
«Лазерная
физика»,
«Физика твердого тела и фотоника».
«Физика быстропротекающих процессов»,
Курс химии для основных направлений подготовки специалистов НИЯУ МИФИ:
Слайд 3
1часть: Основы теории химии
электронное строение атома и химическая связь
химическая термодинамика,
химическая кинетика
химическое равновесие,
электрохимические системы,
дисперсные системы (наносистемы).
2 часть: Свойства химических элементов и их соединений,
методы разделения и очистки, химическая идентификация и измерение
Химические элементы современных материалов ядерной физики, ядерной энергетики и медицины, физики твердого тела (ядерное топливо, поглощающие материалы, радиофармпрепараты, сверхпроводники, лазерные материалы, люминофоры и т.д.)
Курс химии
Слайд 4
1 семестр - зачет
2 семестр - экзамен
Российская и
международная система оценок
Работа в семестре - 50
баллов
(Текущий контроль знаний на каждом занятии и контроль разделов)
Зачет или экзамен - 50 баллов
(A, B,C, D, Е, F)
Контроль знаний
Слайд 5
Коровин Н.В. Общая химия. М.: Высшая школа. 2002,
2013
Ахметов, Н.С. Общая и неорганическая химия/Н.С. Ахметов. – М.:ВШ,
2007
Химия: учебник для вузов. Гуров А.А., Бадаев Ф.З., Овчаренко Л.П., Шаповал В.Н. М.: Изд-во МГТУ им. Н.Э. Баумана, 2004.
Сергиевский В.В., Ананьева Е.А., Жукова Т.В и др. Неорганическая химия: учебное пособие для внеаудиторной работы / М.: МИФИ. 2007
Ананьева Е.А., Звончевская М.Ф. Кучук Ж.С., Сорока И.В. Закономерности протекания химических реакций (химическая термодинамика, кинетика, равновесие). М.: МИФИ. 2015
Сергиевский В.В., Ананьева Е.А., Звончевская М.Ф. и др. Химия растворов. М.: МИФИ. 2005
Ананьева Е.А., Звончевская М.Ф., Глаголева М.А., Сергиевский В.В., Электрохимия: Учебное пособие. М.: МИФИ. 2006.
Общая химия. Лабораторный практикум. Ред. Ананьева Е.А.: МИФИ. 2010
Ананьева Е.А., Безрукова Н.Ю., Глаголева М.А. и др. Сборник задач и тестов по курсу химии: учебное пособие. М.: МИФИ. 2014
Литература
Слайд 6
Электронные курсы по Химии
отдел дистанционного образования
Управления ДПО
Ананьева
Е.А., Глаголева М.А., Звончевская М.Ф., Кучук Ж.С., Месяц
Е.А., Миндлина Т.Б.
Слайд 7
теоретическая часть;
иллюстрации, видео, анимация;
гиперссылки, аннотированные ссылки;
контрольные и учебные
тесты;
глоссарий, персоналии.
Что в этих курсах?
Слайд 9
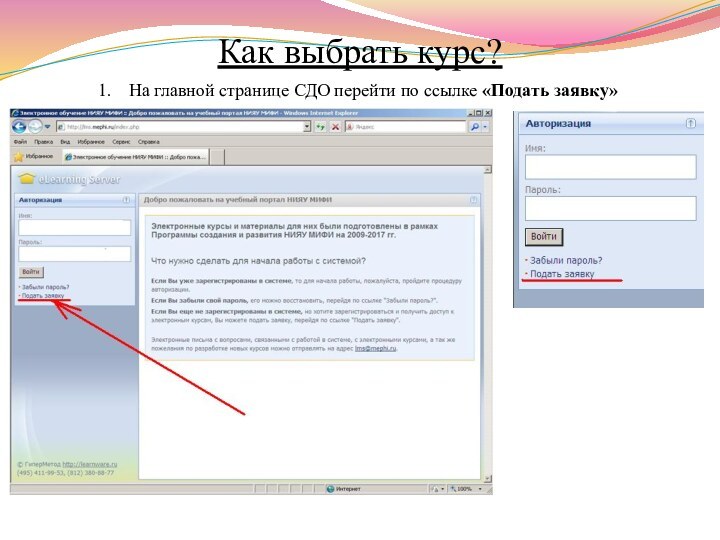
Как выбрать курс?
На главной странице СДО перейти по
ссылке «Подать заявку»
Слайд 10
Электронные курсы по Химии
отдел дистанционного образования
Управления ДПО
Ананьева
Е.А., Глаголева М.А., Звончевская М.Ф., Кучук Ж.С., Месяц
Е.А., Миндлина Т.Б.
Слайд 11
теоретическая часть;
иллюстрации, видео, анимация;
гиперссылки, аннотированные ссылки;
контрольные и учебные
тесты;
глоссарий, персоналии.
Что в этих курсах?
Слайд 13
Как выбрать курс?
На главной странице СДО перейти по
ссылке «Подать заявку»
Слайд 14
ЛЕКЦИЯ 1
ХИМИЧЕСКИЕ СИСТЕМЫ
Введение
Химия, как
наука
Химические системы
Характеристика химических систем:
Вещество, структурная единица
Атом
Молекула
Ионы
Превращения
Признаки
Классификация химических реакций
Химическая двойственность
Характеристика кислотности среды
Ионно-молекулярные уравнения химических реакций
Слайд 15
Классификация фундаментальных наук на уровне макрообъектов
Слайд 17
Химические системы -
совокупность микро- и
макроколичеств веществ, способных под воздействием внешних факторов к превращениям
с образованием новых химических веществ.
Можно выделить три ключевых понятия:
1 - вещество,
2 – химические превращения,
3 – условия, среда
Слайд 18
Факторы, условия
Условия, при которых протекают реакции, принято указывать
над стрелкой символизирующей химические превращения (р,Т, hν, pH, потоки
частиц с высокой энергией, форма и материал реакционного сосуда и т.д.). Если реакция протекает при стандартных земных условиях, то над стрелкой ничего не указывается.
Слайд 19
Факторы, условия
кислотность среды
Слайд 20
Характеристика кислотности среды
Кислотность раствора определяется концентрацией ионов водорода.
в нейтральной [H+] = [OH-]
в кислой среде [H+] > [OH-]
в щелочной [H+] < [OH-]
Водородный показатель: pH= -lg[H+]
Показатель щелочности: pOH= -lg[OH-]
В водных растворах: pH + pOH =14,
следовательно, среду можно охарактеризовать следующим образом:
кислая pH < 7
нейтральная pH = 7
щелочная pH > 7
Слайд 21
Структурные единицы вещества:
Атом – наименьшая частица химического элемента,
сохраняющая все его химические свойства, электронейтральная система, состоящая из
положительно заряженного ядра и отрицательно заряженного электронного облака.
Химический элемент – совокупность атомов с одинаковыми зарядами ядер:
Изотопы – атомы одного и того же химического элемента, но с различными массовыми числами за счёт разного числа нейтронов в ядре:
Ионы – частицы реального вещества, одноатомные или многоатомные, несущие на себе электрический заряд: Na+, SO42-
Молекула – наименьшая частица химического вещества, способная к самостоятельному существованию как единая динамическая система нескольких атомов: Na2SO4
Слайд 22
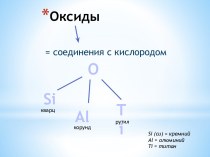
Простые вещества –
вещества , молекулы которых состоят
из атомов одного и того же элемента.
газ - O2, жидкость - Br2, твердые вещества -I2, Салмаз,
металлы (Na, Fe, Au)
Аллотропия –
существование элемента в виде нескольких простых веществ. Это явление обусловлено либо образованием молекул с различным числом атомов (например, кислород О2 или озон О3), либо кристаллов с различной структурой (кристаллические формы углерода: алмаз, графит, карбин, молекулярные формы углерода: фуллерены С60, С70 , С76 и др).
Сложные вещества –
молекулы, состоящие из атомов разных элементов.
H2O, NaCl, CH3COOH, Fe(OH)3
Изомерия- вещества одинакового состава, но с разным химическим строением и свойствами
Слайд 25
Основные признаки химических превращений
выделение газа:
образование осадка:
выделение или поглощение
тепла:
изменение цвета, как результат изменения
электронного
строения или степени
окисления атомов элементов
в химической реакции:
Слайд 26
Метод классической химии
Нобелевский лауреат Р. Фейнман: «Чтобы узнать,
как расположены атомы в какой-нибудь невероятно сложной молекуле, химик
смотрит, что будет, если смешать два разных вещества! Да физик нипочем не поверит что химик, описывая расположение атомов, понимает, о чем говорит. Но вот уже больше 20 лет, как появился физический метод, который позволяет разглядывать молекулы …и описывать расположение атомов, не по цвету раствора, а по измерению расстояний между атомами. И что же? Оказалось, что химики почти никогда не ошибаются».
Слайд 27
Типы химических реакций
Классификационные признаки:
1. Число и состав
исходных веществ и продуктов реакции.
2. Тип химического превращения (обменные,
кислотно-основные, окислительно-восстановительные)
3. Агрегатное состояние реагентов и продуктов реакции.
4. Число фаз, в которых находятся участники реакции.
5. Природа переносимых частиц.
6. Возможность протекания реакции в прямом и обратном направлении.
7. Знак теплового эффекта разделяет все реакции на:
экзотермические реакции, протекающие с экзо-эффектом – выделение
энергии в форме теплоты (Q>0, ∆H <0): С +О2 = СО2 + Q
и эндотермические реакции, протекающие с эндо-эффектом -
поглощением энергии в форме теплоты (Q<0, ∆H >0): N2 +О2 = 2NО - Q.
Слайд 28
Типы химических реакций
Реакция разложения:
CaCO3 → CaO↓ + CO2↑
Реакция соединения:
CO2↑ + H2O → H2CO3
Реакция замещения: Zn + 2HCl → ZnCl2 + H2↑
Реакция обмена: HNO3 + Ba(OH)2 → Ba(NO3)2 + H2O
Окислительно-восстановительная реакция: 2Mg + O2 → 2MgO
Обратимая AgCl↓ + NaI ↔ AgI↓ + NaCl
и необратимая CuSO4 + Na2S → CuS ↓ + Na2SO4 (осадок) реакция
Слайд 29
Ионно-молекулярные уравнения
химических реакций
Для того чтобы
ионно-молекулярные уравнения правильно отражали механизм процесса, необходимо придерживаться следующей
формы их записи:
Малорастворимые, малодиссоциирующие, газообразные вещества и оксиды записывают в виде молекул.
Растворимые сильные электролиты, как полностью диссоциированные, записывают в виде ионов.
Сумма электрических зарядов ионов левой части уравнения должна быть равна сумме электрических зарядов правой части.
Слайд 30
Сильные электролиты
Сильные кислоты: НNO3, HCl, HBr,
HI, HClO4, H2SO4 и т.д.
HnSOm
где m-n ≥ 2 - сильные, эмпирическое правило Полинга
Сильные основания: гидроксиды щелочных и щелочноземельных металлов: LiOH, KOH, NaOH, Ba(OH)2 и другие.
Сa(OH)2 , т.к. K2 = 4,3·10-2
Соли ( хорошо растворимые в воде):
средние (NaCl, KNO3, Na2SO4, FeCl2 и др.).
Кислые (KHCO3, Na2HPO4, NaHS и др.) и основные (ZnOHCl, Al(OH)2NO3, CrOHSO4 и др.) соли диссоциируют в водных растворах по первой ступени как сильные электролиты. В ионно-молекулярных уравнениях кислые и основные соли записываются в виде ионов, которые образуются в результате диссоциации по первой ступени.
KHCO3 → K+ + HCO3−
Al(OH)2NO3 → Al(OH)2+ + NO3−
Слайд 31
Вещества, остающиеся ввиде молекул, при составлении ионных уравнений
оксиды
(пероксиды): BaO, P2O5, Al2O3, H2O, H2O2 и др.
нерастворимые вещества:
CaF2, Ba3(PO4)2, Li3PO4 и др.
газы: CO(г), CO2(г), SO2(г), AsCl3(г) и др.
простые вещества: Na, Cl2, O2 и др.
слабые кислоты: H2S, H2SiO3, H3PO4 и др.
слабые основания: Pb(OH)2, Al(OH)3, Mg(OH)2 , NH4OH и др.
Слайд 32
Примеры ионных уравнений
выделение газа
выпадение осадка
образоване малодис-социирующего вещества
Слайд 34
Опыт №2 «Колебательная система»
Малоновая кислота
С – концентрация
иода, моль/л
Слайд 35
Химическая двойственность
Амфотерность гидроксида алюминия Al(OH)3 :
Al(OH)3 + 3HCl
→ AlCl3 + 3HCl
(pH<7)
основание
Al(OH)3 + 3NaOH → Na3AlO3 + 3H2O (pH>7)
кислота
Окислительно-восстановительная двойственность пероксида водорода H2O2 :
восстановитель
5H2O2 + 2KMnO4 + 3H2SO4 → O2 + K2SO4 + 2MnSO4 + 8H2O
окислитель
H2O2 + 2KI + H2SO4 → I2 + K2SO4 + 2H2O