пропускании через раствор или расплав электролита постоянного электрического тока
Электрод
– система, состоящая из проводника I рода и проводника II родаКатод - восстановление
Анод - окисление
+
-
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть























+
-
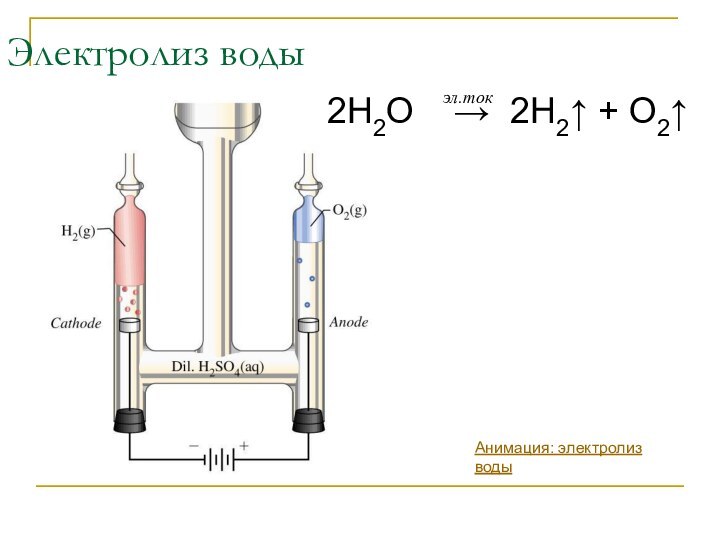
эл.ток
эл.ток
2
4
2
- 4e-
+1
-2
0
эл.ток
эл.ток
Опыт: электролиз раствора хлорида меди(II)
Электролиз растворов солей (2).
эл.ток
эл.ток
2
1
Электролиз растворов солей (3).
эл.ток
эл.ток
Опыт: электролиз раствора KI
эл.ток
эл.ток
эл.ток
2
1
эл.ток
эл.ток
эл.ток
эл.ток
эл.ток
Майкл Ф а р а д е й
(1791-1867)
М. Фарадей, 1833-1836
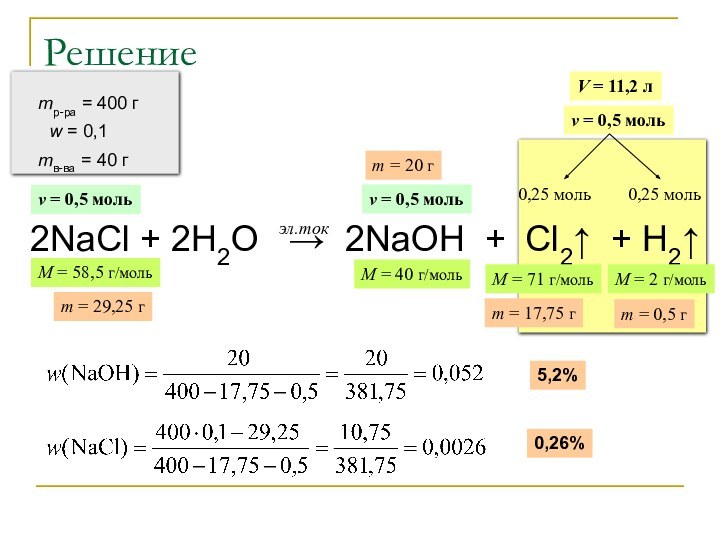
V = 11,2 л
ν = 0,5 моль
0,25 моль
0,25 моль
M = 71 г/моль
M = 2 г/моль
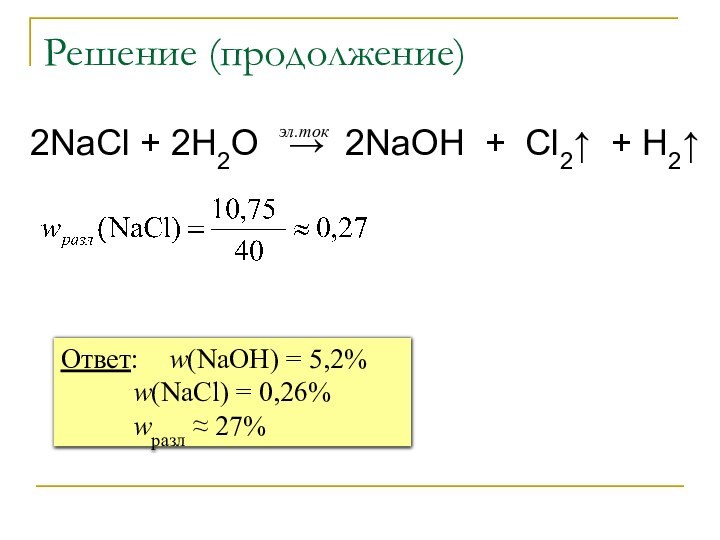
m = 17,75 г
m = 0,5 г
ν = 0,5 моль
M = 40 г/моль
m = 20 г
5,2%
0,26%
ν = 0,5 моль
M = 58,5 г/моль
m = 29,25 г
Гемфри Дэви
Майкл Фарадей