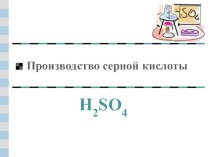
Слайд 2
СВОЙСТВА
Физические свойства Марганца. Плотность Марганца 7,2-7,4 г/см3; tпл1245 °С;

tкип 2150 °С. Марганец имеет 4 полиморфные модификации: α-Мn (кубическая
объемноцентрированная решетка с 58 атомами в элементарной ячейке), β-Мn (кубическая объемноцентрированная с 20 атомами в ячейке), γ-Мn (тетрагональная с 4 атомами в ячейке) и δ-Mn (кубическая объемноцентрированная). Температура превращений: α=β 705 °С; β=γ 1090 °С и γ=δ 1133 °С; α-модификация хрупка; γ (и отчасти β) пластична, что имеет важное значение при создании сплавов.
Атомный радиус Марганца 1,30 Å. ионные радиусы (в Å): Mn2+ 0,91, Mn4+ 0,52; Mn7+ 0,46. Прочие физические свойства α-Mn: удельная теплоемкость (при 25°С) 0,478 кДж/(кг·К) [т. е. 0.114 ккал/(г·°С)]; температурный коэффициент линейного расширения (при 20°С) 22,3·10-6град-1; теплопроводность (при 25 °С) 66,57 Вт/(м·К) [т. е. 0,159 кал/(см·сек·°С)]; удельное объемное электрическое сопротивление 1,5-2,6 мком·м (т. е. 150-260 мком·см): температурный коэффициент электрического сопротивления (2-3)·10-4 град-1. Марганец парамагнитен.
Слайд 3
Химические свойства Марганца. Химически Марганец достаточно активен, при нагревании

энергично взаимодействует с неметаллами - кислородом (образуется смесь оксидов
Марганца разной валентности), азотом, серой, углеродом, фосфором и другими. При комнатной температуре Марганец на воздухе не изменяется: очень медленно реагирует с водой. В кислотах (соляной, разбавленной серной) легко растворяется, образуя соли двухвалентного Марганца. При нагревании в вакууме Марганец легко испаряется даже из сплавов.
Марганец образует сплавы со многими химическими элементами; большинство металлов растворяется в отдельных его модификациях и стабилизирует их. Так, Cu, Fe, Co, Ni и другие стабилизируют γ-модификацию. Al, Ag и другие расширяют области β- и σ-Mn в двойных сплавах. Это имеет важное значение для получения сплавов на основе Марганца, поддающихся пластической деформации (ковке, прокатке, штамповке).
В соединениях Марганец обычно проявляет валентность от 2 до 7 (наиболее устойчивы степени окисления +2, +4 и +7). С увеличением степени окисления возрастают окислительные и кислотные свойства соединений Марганца.
Соединения Mn(+2)- восстановители. Оксид MnO - порошок серо-зеленого цвета; обладает основными свойствами. нерастворим в воде и щелочах, хорошо растворим в кислотах. Гидрооксид Mn(OH)3 - белое вещество, нерастворимое в воде. Соединения Mn(+4) могут выступать и как окислители (а) и как восстановители (б):
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O (а)
(по этой редакции в лабораториях получают хлор)
MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O (б)
(реакция идет при сплавлении).
Оксид Марганца (II) MnO2 - черно-бурого цвета, соответствующий гидрооксид Мп(ОН)4 - темно-бурого цвета. Оба соединения в воде нерастворимы, оба амфотсрны с небольшим преобладанием кислотной функции. Соли типа K2MnO4 называются манганитами.
Из соединений Mn(+6) наиболее характерны марганцовистая кислота и ее соли манганаты. Весьма важны соединения Mn(+7) - марганцовая кислота, марганцовый ангидрид и перманганаты.
Слайд 4
ПОЛУЧЕНИЕ МАРГАНЦА
Получение Марганца. Наиболее чистый Марганец получают в промышленности
по способу советского электрохимика Р. И. Агладзе (1939) электролизом
водных растворов с добавкой (NH4)2SO4 при рН = 8,0-8,5. Процесс ведут с анодами из свинца и катодами из титанового сплава АТ-3 или нержавеющей стали. Чешуйки Марганца снимают с катодов и, если необходимо, переплавляют. Галогенным процессом, например, хлорированием руды Мn, и восстановлением галогенидов получают Марганец с суммой примесей около 0,1%. Менее чистый Марганец получают алюминотермией по реакции:
3Mn3O4 + 8Al = 9Mn + 4Al2O3
а также электротермией.
Слайд 5
МАРГАНЕЦ В ПРИРОДЕ
Марганец в организме. Марганец широко распространен в

природе, являясь постоянной составной частью растительных и животных организмов.
Содержание Марганца в растениях составляет десятитысячные-сотые, а в животных - стотысячные-тысячные доли процента. Беспозвоночные животные богаче Марганцем, чем позвоночные. Среди растений значительное количество Марганца накапливают некоторые ржавчинные грибы, водяной орех, ряска, бактерии родов Leptothrix, Crenothrix и некоторые диатомовые водоросли (Cocconeis) (до нескольких процентов в золе), среди животных - рыжие муравьи, некоторые моллюски и ракообразные (до сотых долей процента). Марганец - активатор ряда ферментов, участвует в процессах дыхания, фотосинтезе, биосинтезе нуклеиновых кислот и других, усиливает действие инсулина и других гормонов, влияет на кроветворение и минеральный обмен. Недостаток Марганца у растений вызывает некрозы, хлороз яблони и цитрусовых, пятнистость злаков, ожоги у картофеля, ячменя и т. п. Марганец обнаружен во всех органах и тканях человека (наиболее богаты им печень, скелет и щитовидная железа). Суточная потребность животных и человека в Марганце - несколько мг (ежедневно с пищей человек получает 3-8 мг Марганца). Потребность в Марганце повышается при физической нагрузке, при недостатке солнечного света; дети нуждаются в большем количестве Марганца, чем взрослые. Показано, что недостаток Марганца в пище животных отрицательно влияет на их рост и развитие, вызывает анемию, так называемых лактационную тетанию, нарушение минерального обмена костной ткани. Для предотвращения указанных заболеваний в корм вводят соли Марганца.