Из 114 известных элементов –
92 относятся к металлам.Металлы – это химические элементы, атомы которых отдают электроны внешнего
( предвнешнего) электронного слоя, превращаясь в положительные ионы (катионы).
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть


![Металлы: общая характеристика Главные особенности элементов металлов.Малое число валентных электронов ( [1-3] ).Сравнительно большие радиусы](/img/tmb/12/1189936/7e5c2bb4d9f25cd152033d23d3155276-720x.jpg)












Металлы – это химические элементы, атомы которых отдают электроны внешнего
( предвнешнего) электронного слоя, превращаясь в положительные ионы (катионы).
Исключительно восстановительные свойства ( - свои электроны).
Некоторые химические элементы металлы обладают двойственными свойствами (амфотерность).
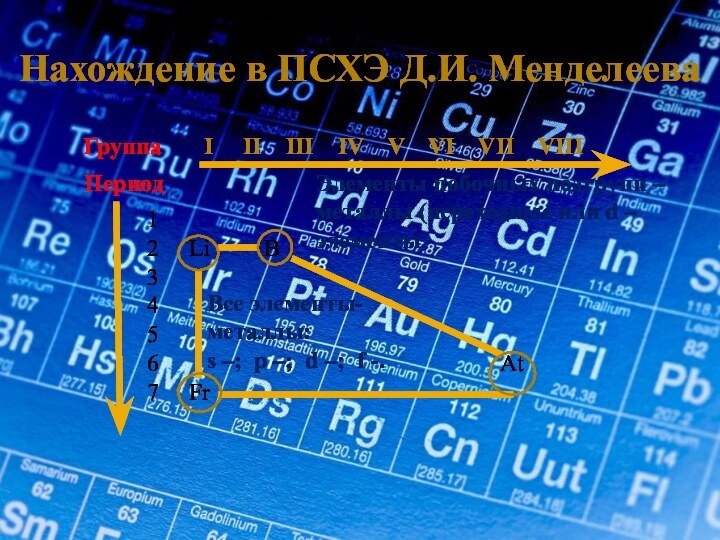
Период
1
2 Li B
3
4
5
6 At
7 Fr
Все элементы-
металлы:
s –; p –; d –; f -.
Элементы побочных подгрупп – металлы (переходные или d – элементы.
Металлические свойства усиливаются
В главной подгруппе
Металлические свойства ослабевают
3. Насыщенностью и направленностью не обладает.
Металлический блеск – наличие свободных электронов.
Электро- и теплопроводность – обусловлена нахождением в кристалле хаотически движущихся электронов.
окисление
Ме, стоящий в ряду левее, вытесняет правее стоящий Ме из растворов его солей;
Ме, стоящие в ряду за водородом, не взаимодействуют с водой;
Me
от Al до H2
металлы средней активности
от Н2 до Au
малоактивные металлы
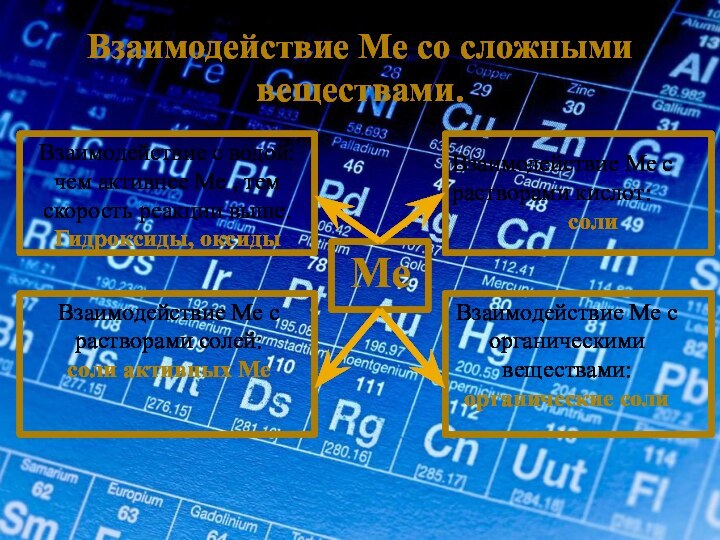
Взаимодействие с металлом/
интерметаллические соединения
Взаимодействие Ме с растворами солей:
соли активных Ме
Взаимодействие Ме с органическими веществами:
органические соли