атом стремится к завершению своей наружной электронной оболочки,.
Сила,связывающая атомы
в единый агрегат.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть

























Задание:
Выпишите формулы веществ с ионной связью.
РС13; С2Н2; Na3P; СС14 MgCl2; СН4; K3N; NaBr.
Na
+
S
Na
Na
S
Na
[
]
+
+
2-
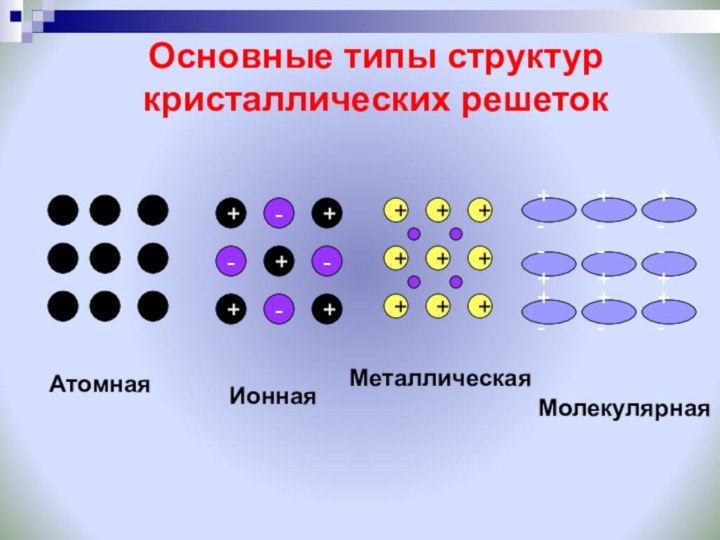
Ионная связь образуется только между атомами таких элементов, которые значительно отличаются по своей электроотрицательности (разность >1,7). Однако полного перехода электронов от одних атомов к другим не происходит.
о п+
М — пе М
Схема образования металлической связи:
Задание:
Выпишите формулы веществ, в которых присутствует металлическая и водородная связи
Na, KF, NH3, C2H2, CH3-COOH, H2S, AL, NaCL.
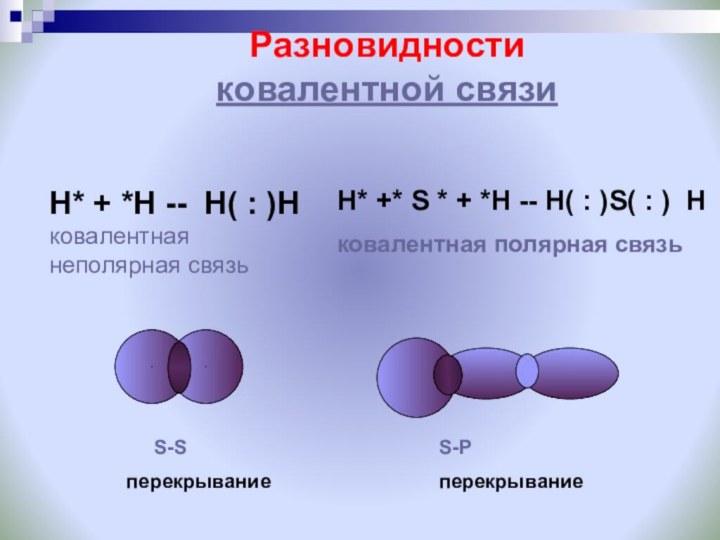
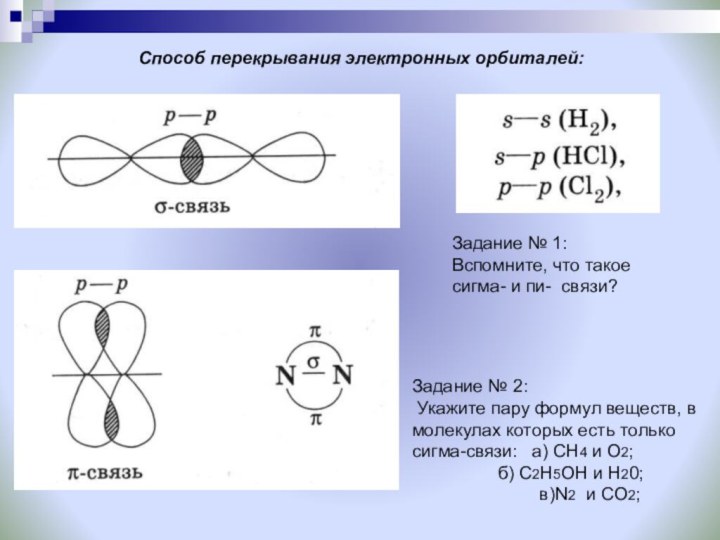
S-S
перекрывание
S-Р
перекрывание
Ковалентную химическую связь, образующуюся между атомами с одинаковой электроотрицательностью, называют неполярной
Ковалентную химическую связь, образующуюся между атомами с разной электроотрицательностью, называют полярной
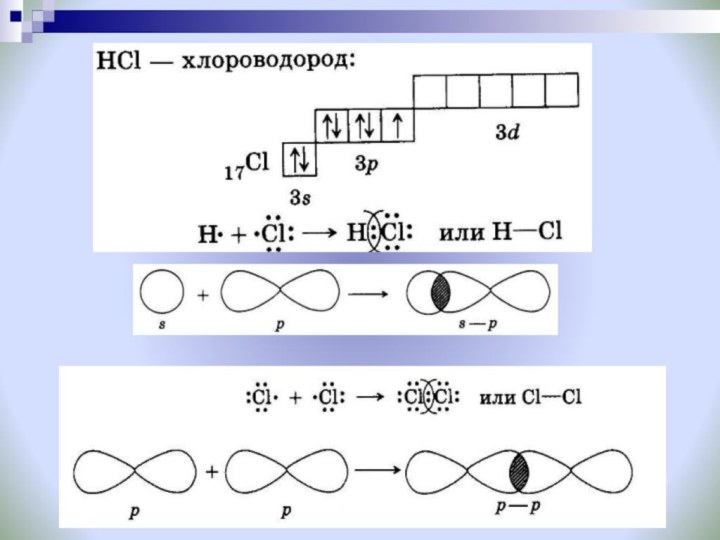
H H
H СL