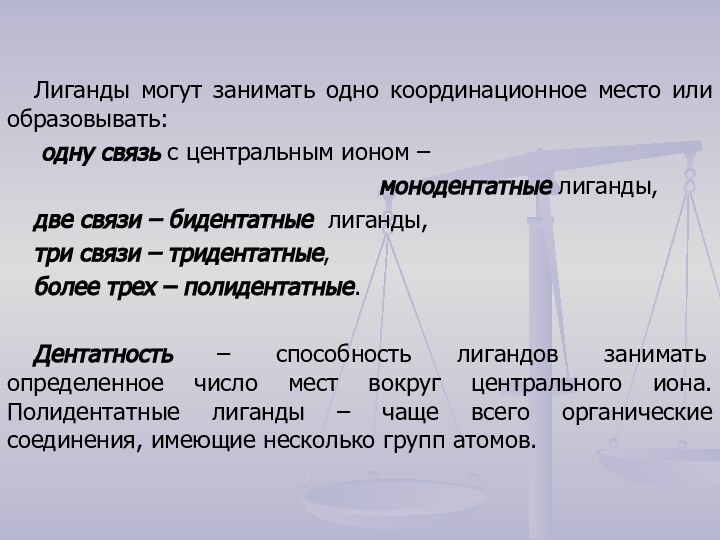
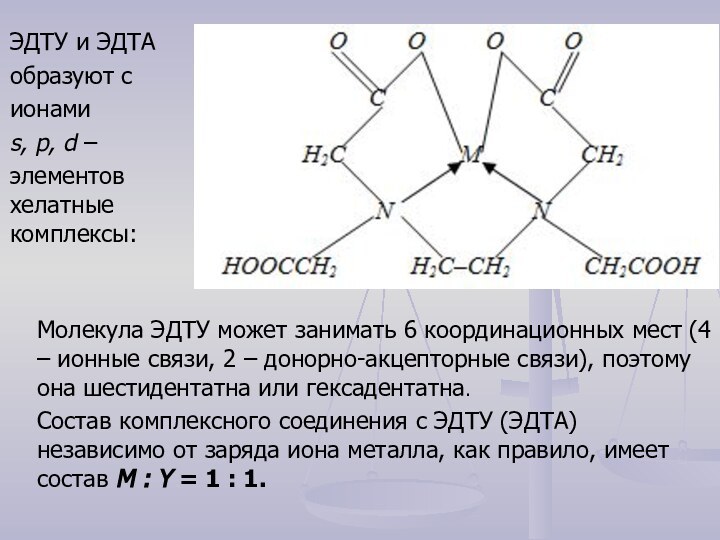
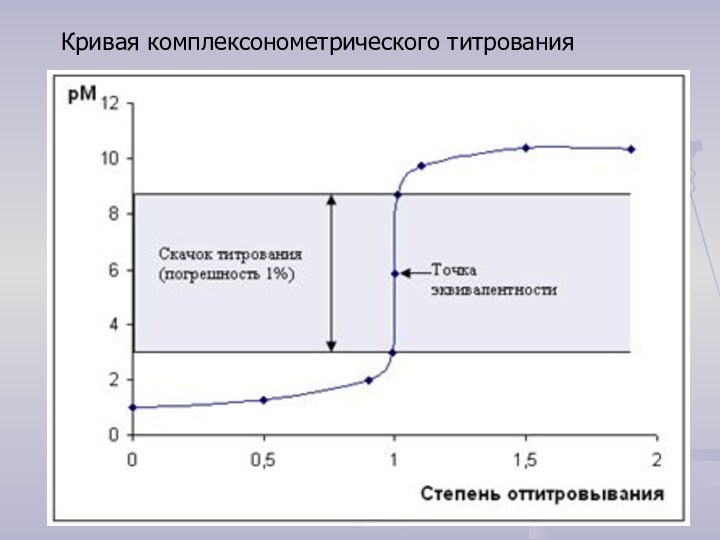
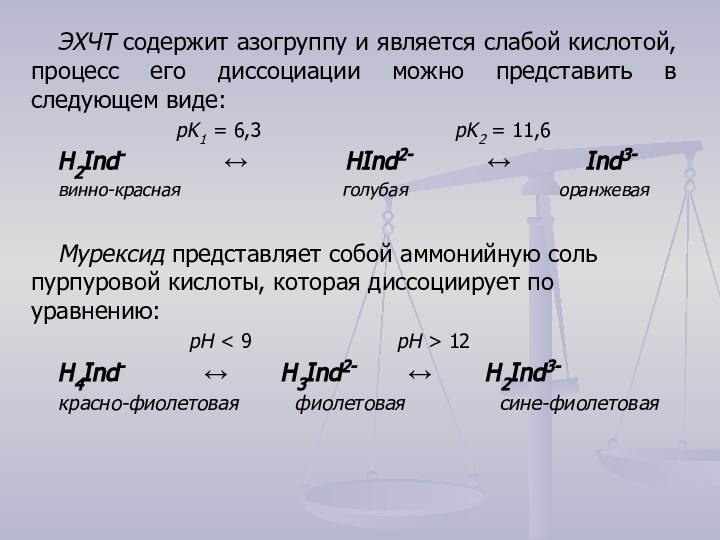
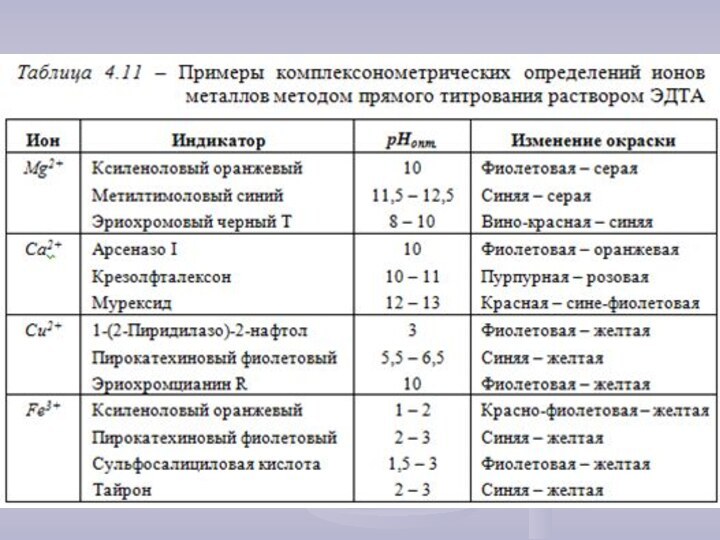
кристаллической решетки которых находятся сложные частицы, способные к самостоятельному
существованию в растворах.Комплексы состоят из центрального иона (комплексообразователя), вокруг которого координируются сложные частицы – лиганды (L). В качестве комплексообразователя чаще всего выступают металлы (М).
Число свободных молекулярных орбиталей определяет координационное число центрального иона.