фтор F, хлор Cl,
бром Br, иод I, астат At Общее название - галогены (греч. «солеобразующие») - большинство их соединений с металлами представляют собой типичные соли (KCl, NaCl и т.д.).
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть












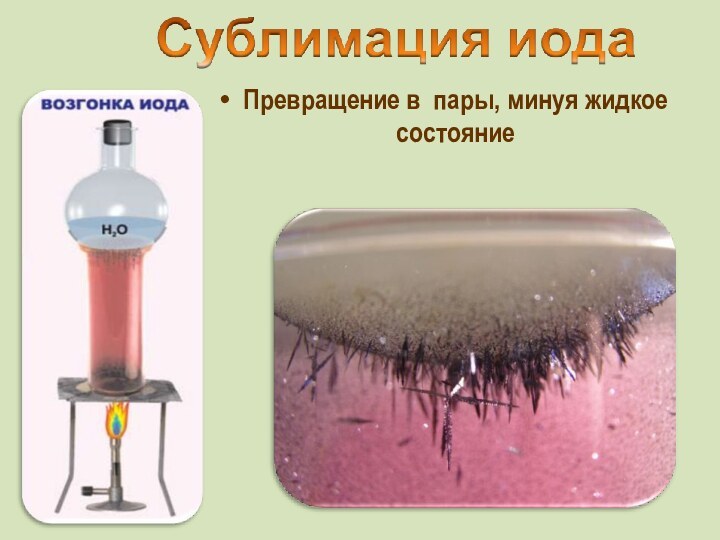


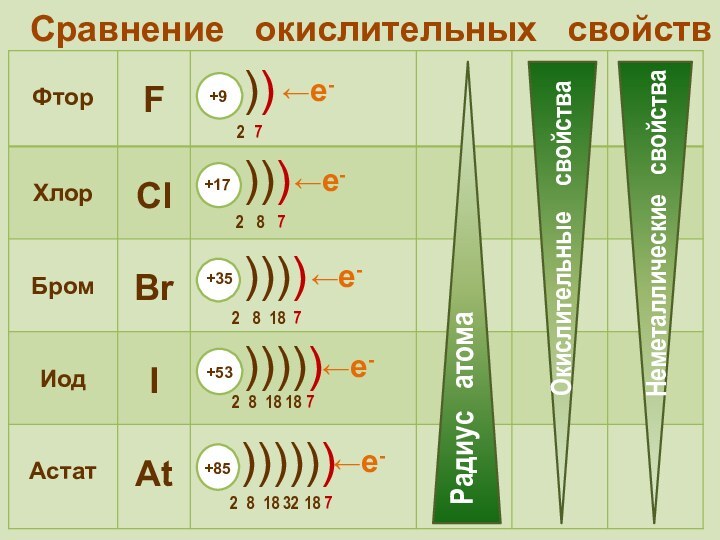







Общее название - галогены (греч. «солеобразующие») - большинство их соединений с металлами представляют собой типичные соли (KCl, NaCl и т.д.).
Это зеленовато-желтый газ, немного тяжелее воздуха, с характерным запахом и необыкновенной химической активностью.
В свободном состоянии фтор был получен 26 июня 1886 г. французским химиком Муассаном.
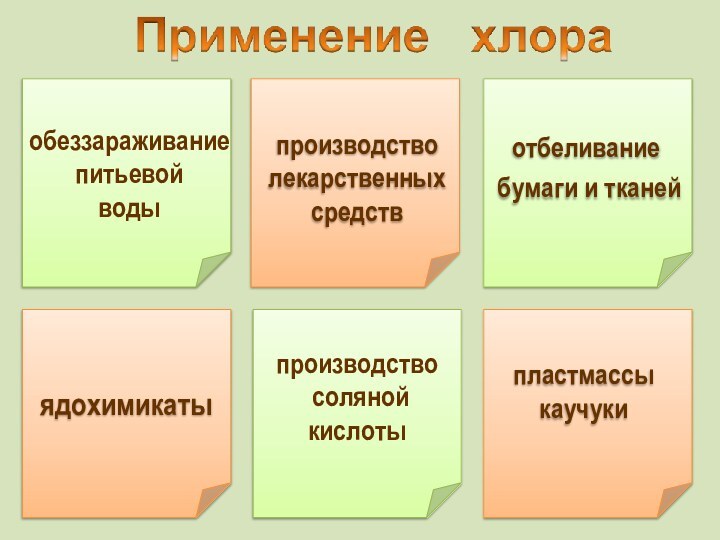
в 1810 году сэр Гемфри Дэви назвал газ "хлорином"(Chlorine), от греческого "зелёный".
Этот термин используется в английском языке,
а в других языках закрепилось название "хлор".
тяжелая красно-бурая жидкость с неприятным запахом
Известны 37 изотопов иода с массовыми числами от 108 до 144.
0
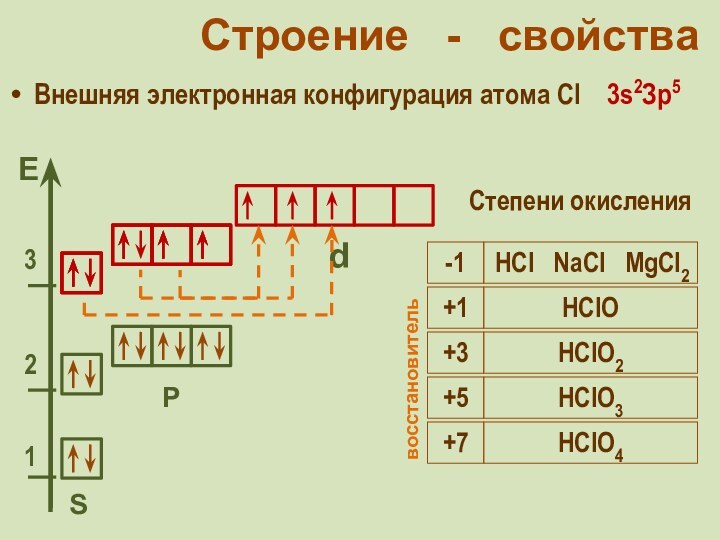
Cила галогеноводородных кислот увеличивается в ряду:
+1
HClO
+3
HClO2
+1
HClO
восстановитель
+3
HClO2
+5
HClO3
+7
HClO4
2. Взаимодействие с неметаллами
C неметаллами (кроме углерода, азота, кислорода и инертных газов), образует соответствующие хлориды.
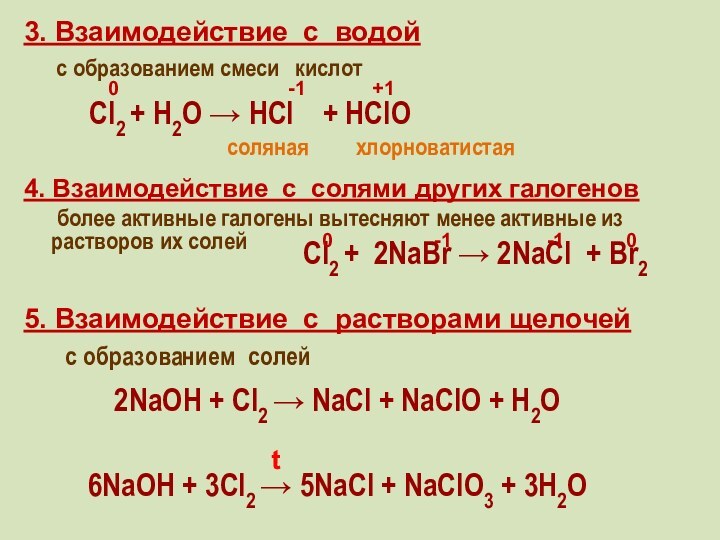
5. Взаимодействие с растворами щелочей
с образованием солей
2NaOH + Cl2 → NaCl + NaClO + H2O
2NaCl → 2Na + Cl2
HСl + MnO2 → MnCl2 + Cl2 ↑+ H2O
16 HСl + 2KMnO4 → 2KСl + 2MnCl2 + 5Cl2 ↑+ 8H2O
- Галоге́нная ла́мпа — лампа накаливания, в баллон которой добавлены пары галогенов (брома или йода)
- Лазерный термоядерный синтез - иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах
В технике
В медицине