Слайд 2
ФЕРМЕНТЫ (ЭНЗИМЫ) - природные биокатализаторы, избирательно преобразующие реагенты,
называемые субстратами, по физиологически полезному пути. Ферменты управляют всеми
метаболическими процессами организма.
Слово «фермент» происходит от лат. fermentium – закваска, а «энзим» – от греч. еп - в, внутри и zуте - дрожжи.
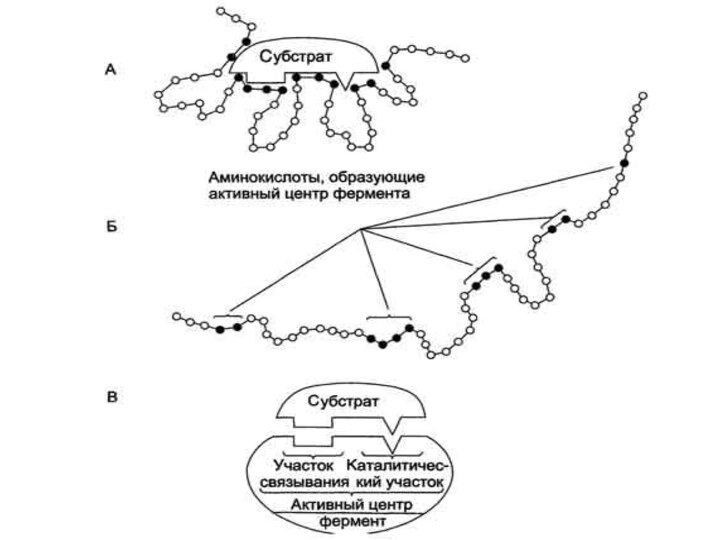
Лиганд, взаимодействующий с активным центром фермента, называют субстратом
Слайд 4
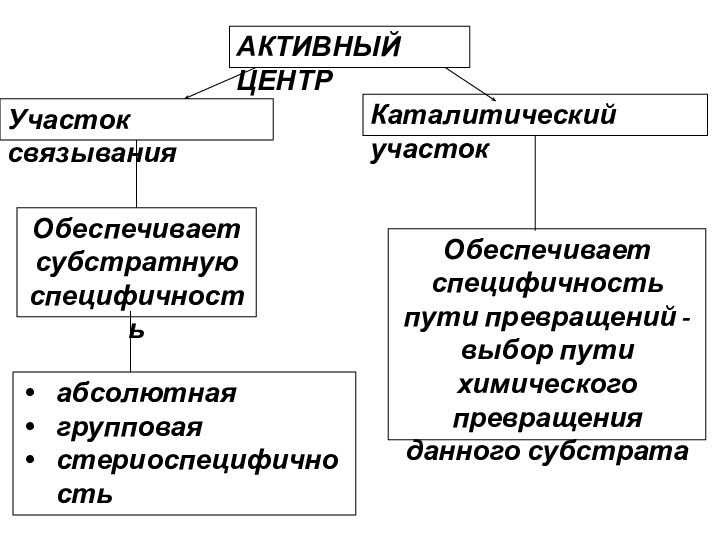
АКТИВНЫЙ ЦЕНТР
Участок связывания
Каталитический участок
Обеспечивает субстратную специфичность
абсолютная
групповая
стериоспецифичность
Обеспечивает специфичность пути
превращений - выбор пути химического превращения данного субстрата
Слайд 5
Абсолютная субстратная специфичность.
Активный центр ферментов, обладающих абсолютной
субстратной специфичностью, комплементарен только одному субстрату.
СПЕЦИФИЧНОСТЬ
Слайд 6
Групповая субстратная специфичность. Большинство ферментов катализирует однотипные реакции
с небольшим количеством (группой) структурно похожих субстратов.
Слайд 7
Стереоспецифичность. При наличии у субстрата нескольких стереоизомеров фермент
проявляет абсолютную специфичность к одному из них.
к D-сахарам
к
L-аминокислотам
к α- и β-гликозидным связям.
к цистрансизомерам
Слайд 8
Каталитическая специфичность
Фруктозо-6-фосфат
Глюкозо-6-фосфат
Глюкозо-1-фосфат
6-фосфоглюконолактон
Глюкоза
глюкозо-6-
фосфатдегидрогеназы
фосфоглюкомутаза
глюкозо-6-фосфатфосфатаза
фосфоглюкоизомераза
Слайд 9
КАТАЛИТИЧЕСКАЯ ЭФФЕКТИВНОСТЬ
Большинство катализируемых ферментами реакций высокоэффективны, они протекают
в 108 – 1014.раз быстрее, чем некатализируемые реакции.
ЛАБИЛЬНОСТЬ
ФЕРМЕНТОВ
Для ферментов характерна конформационная лабильность – способность к небольшим изменениям нативной конформации вследствие разрыва слабых связей.
Слайд 10
СПОСОБНОСТЬ ФЕРМЕНТОВ К РЕГУЛЯЦИИ МЕТАБОЛИЗМ
Активность ферментов в клетке
зависит от количества молекул субстрата, продукта, наличия кофакторов и
коферментов.
«Метаболический путь» - строго упорядоченное направление реакций в клетке (продукт одной ферментативной реакции является субстратом другой).
Регуляторные (ключевые) ферменты расположены, как правило, в начале и/или в месте разветвления метаболического пути. Они катализируют либо самые медленные (скорость-лимитирующие реакции), либо необратимые реакции.
Слайд 11
МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ
Сходство ферментов с небиологическими катализаторами:
ферменты катализируют энергетически возможные реакции;
энергия химической системы остаётся
постоянной;
в ходе катализа направление реакции не изменяется;
ферменты не расходуются в процессе реакции.
Отличия ферментов от небиологических катализаторов:
скорость ферментативных реакций выше, чем реакций, катализируемых небелковыми катализаторами;
ферменты обладают высокой специфичностью;
ферментативная реакция проходит в клетке, т.е. при температуре 37 °С, постоянном атмосферном давлении и физиологическом значении рН;
скорость ферментативной реакции может регулироваться.
Слайд 12
Этапы ферментативного катализа
Формирование фермент-субстратного комплекса
В 1959 г. Кошландом
была предложена гипотеза, «Индуцированного соответствия». По этой гипотезе активный
центр является гибкой структурой
Эффект сближения и ориентации реагентов. Активный центр фермента участвует в упорядочивании и сближении функциональных групп субстратов, что приводит к снижению энергии активации (Еа) и определяет каталитическую эффективность ферментов.
Эффект деформации субстрата. Активный центр фермента также способствует дестабилизации межатомных связей в молекуле субстрата, что облегчает протекание химической реакции и образование продуктов.
Слайд 13
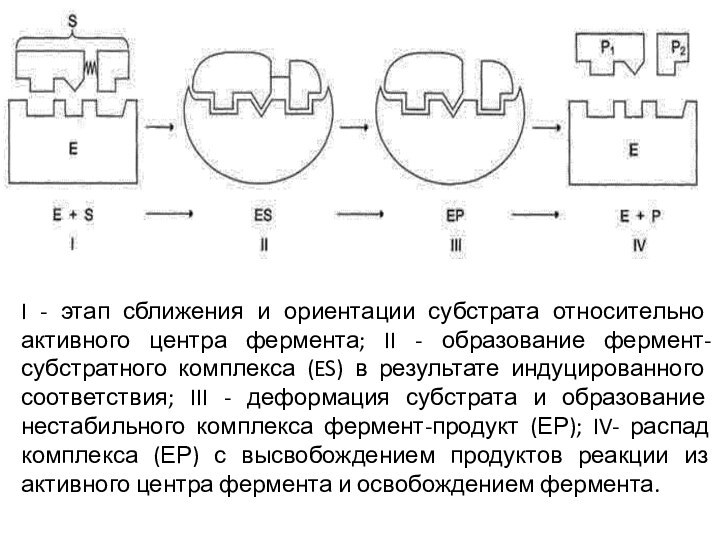
I - этап сближения и ориентации субстрата относительно
активного центра фермента; II - образование фермент-субстратного комплекса (ES)
в результате индуцированного соответствия; III - деформация субстрата и образование нестабильного комплекса фермент-продукт (ЕР); IV- распад комплекса (ЕР) с высвобождением продуктов реакции из активного центра фермента и освобождением фермента.
Слайд 14
Кинетика ферментативных реакций
Для измерения каталитической активности ферментов
используют такие показатели, как скорость реакции или активность фермента.
Скорость ферментативной реакции определяется изменением количества молекул субстрата или продукта за единицу времени.
V= D[S]/t = D[P]/t
Скорость ферментативной реакции зависит:
от количества ферментов,
от активности ферментов,
от концентрации субстрата,
от температуры среды,
от рН раствора,
от присутствия регуляторных молекул (активаторов и ингибиторов).
Слайд 15
Зависимость скорости ферментативной реакции от количества ферментов
Активность фермента
выражается в МЕ.
Одна международная единица активности (ME) соответствует
такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях проведения ферментативной реакции.
Новая единица активности ферментов: 1 катал (кат), соответствующий такому количеству катализатора, которое превращает 1 моль субстрата за 1 с.
1 кат = 1 моль S/c = 60 моль S/мин = 60х106 мкмоль/мин = 6х107 ME,
1 ME = 1 мкмоль/мин = 1/60 мкмоль/с = 1/60 мккат = 16,67 нкат.
Слайд 16
k1 - константа скорости образования фермент-субстратного комплекса; k-1
- константа скорости обратной реакции, распада фермент-субстратного комплекса; k2
- константа скорости образования продукта реакции.
Кm =(k-1 + k2)/k1 - константа Михаэлиса.
Скорость реакции пропорциональна концентрации фермент-субстратного комплекса ES, a скорость образования ES зависит от концентрации субстрата и концентрации свободного фермента.
Слайд 17
2. Зависимость скорости ферментативной реакции от количества субстрата
При
увеличении количества субстрата начальная скорость возрастает. Когда фермент становится
полностью насыщенным субстратом, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта.
Слайд 18
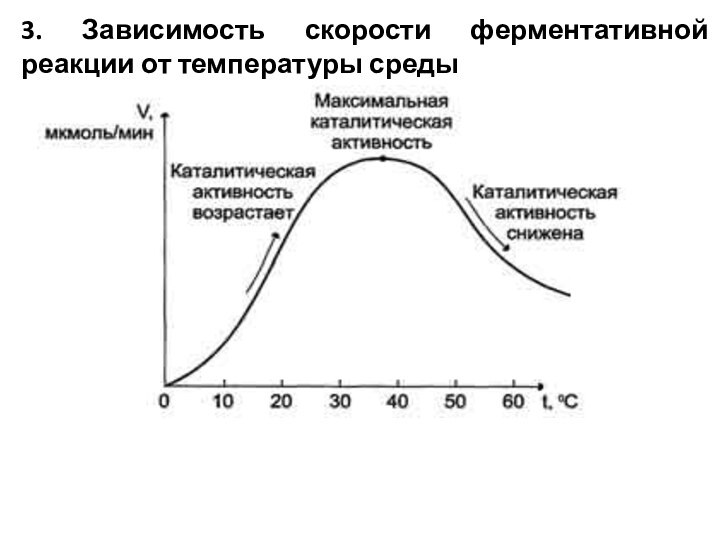
3. Зависимость скорости ферментативной реакции от температуры среды
Слайд 19
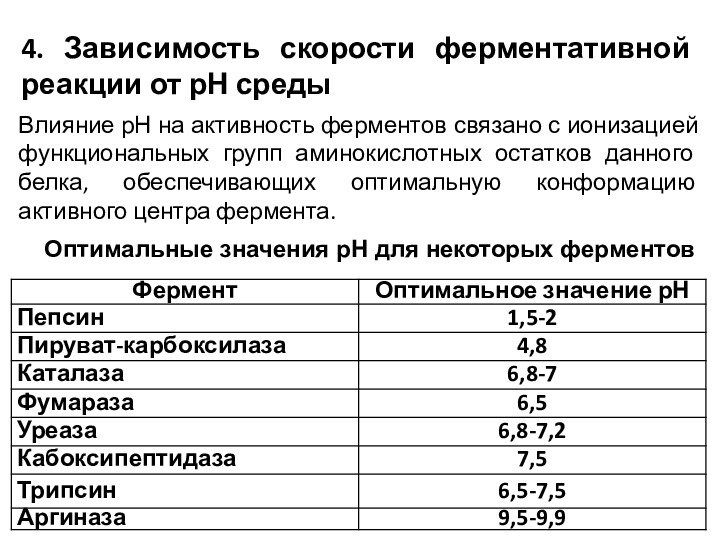
4. Зависимость скорости ферментативной реакции от рН среды
Влияние
рН на активность ферментов связано с ионизацией функциональных групп
аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента.
Оптимальные значения рН для некоторых ферментов
Слайд 20
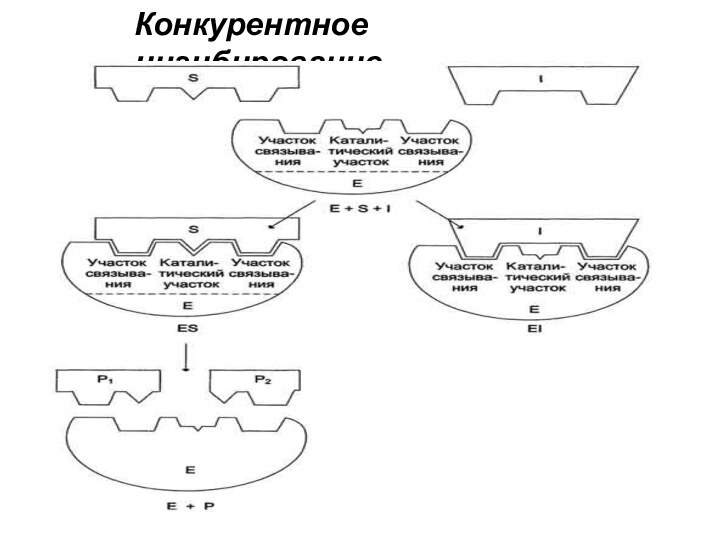
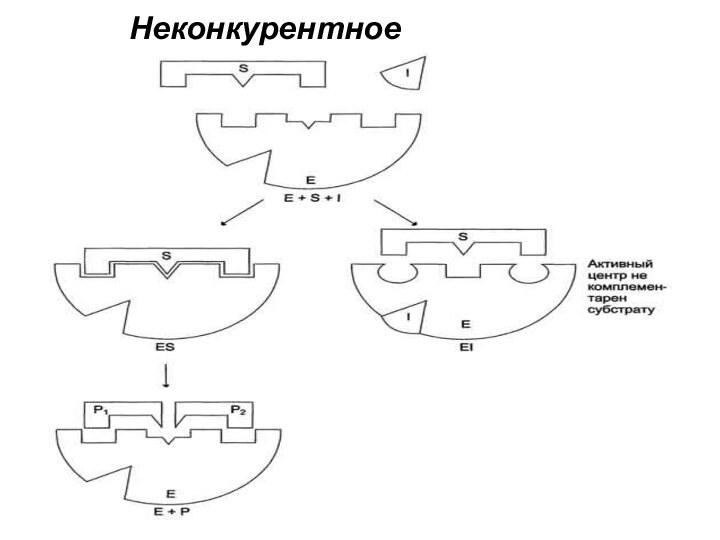
5. Ингибирование ферментативной активности
«Ингибирование ферментативной активности» - снижение
каталитической активности в присутствии определенных веществ – ингибиторов.
По
степени прочности взаимодействия ингибитора с ферментом различают ингибирование:
обратимое
необратимое
По механизму действия ингибиторы подразделяют на:
конкурентные
неконкурентные
Слайд 23
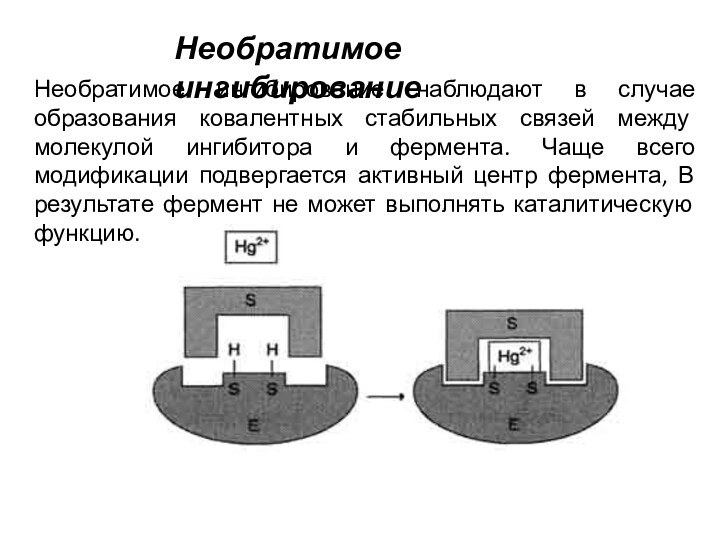
Необратимое ингибирование
Необратимое ингибирование наблюдают в случае образования ковалентных
стабильных связей между молекулой ингибитора и фермента. Чаще всего
модификации подвергается активный центр фермента, В результате фермент не может выполнять каталитическую функцию.
Слайд 24
КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ФЕРМЕНТОВ
Оксидоредуктазы. Катализируют различные окислительно-восстановительные реакции
с участием 2 субстратов (перенос ē- или Н+ с
одного субстрата на другой).
Дегидрогеназы.
Оксидазы.
Оксигеназы (гидроксилазы) .
Название: «донор –акцептороксидоредуктаза».
Слайд 25
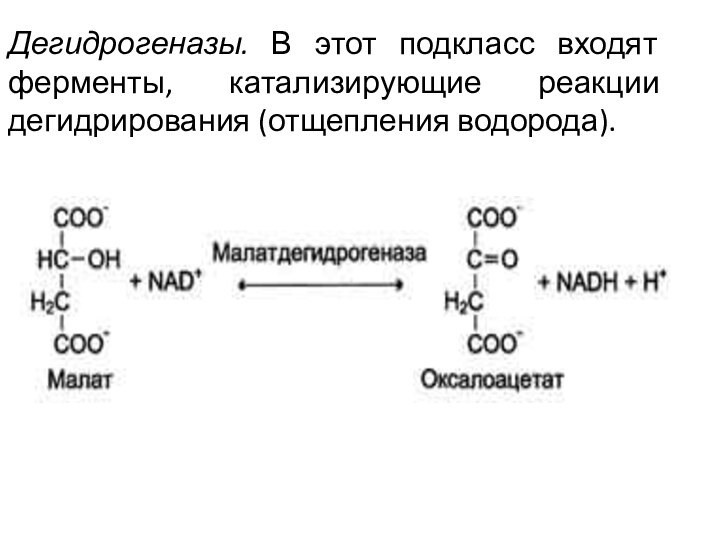
Дегидрогеназы. В этот подкласс входят ферменты, катализирующие реакции
дегидрирования (отщепления водорода).
Слайд 26
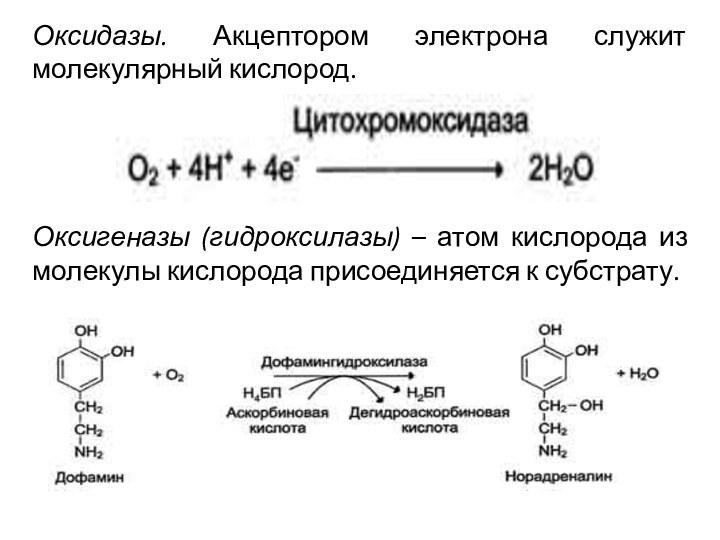
Оксидазы. Акцептором электрона служит молекулярный кислород.
Оксигеназы (гидроксилазы)
– атом кислорода из молекулы кислорода присоединяется к субстрату.
Слайд 27
Трансферазы. Катализируют перенос функциональных групп от одного соединения
к другому. Подразделяют в зависимости от переносимой группы. аминотрансферазы,
ацилтрансферазы, метилтрансферазы, гликозилтрансферазы, киназы (фосфо-трансферазы).
Название: «донор–экспортируемая группа-трансфераза».
Протеинкиназа
Протеин + АТФ
Фосфопротеин + АДФ
Слайд 28
Гидролазы. Катализируют реакции гидролиза (расщепления ковалентной связи с
присоединением молекулы воды по месту разрыва). Подразделяют в зависимости
от расщепляемой связи (протеаза, липаза, фосфолипаза, рибонуклеаза).
Название: «субстрат–гидролаза»
СО NH
СО OН
Слайд 29
Лиазы. К лиазам относят ферменты, отщепляющие от субстратов
негидролитическим путём определённую группу (при этом могут отщепляться СО2,
Н2О, NH2,SН2и др.) или присоединяющие чаще всего молекулу воды по двойной связи.
Название: «субстрат–отщепляемая или присоединяемая группировка».
Слайд 30
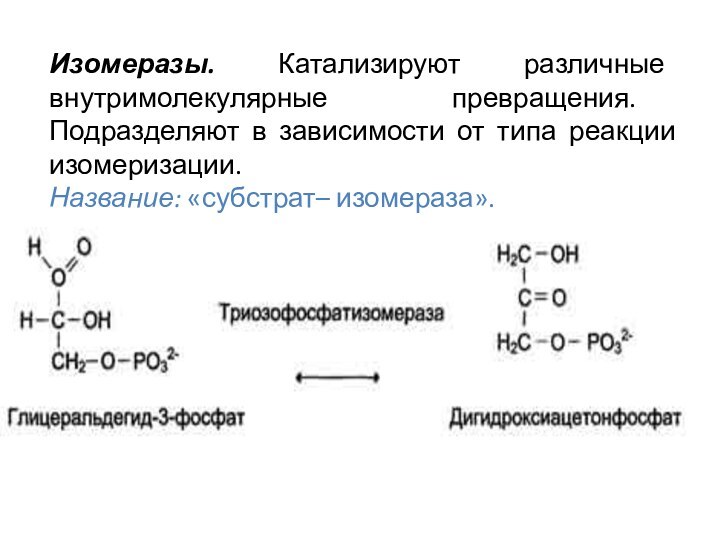
Изомеразы. Катализируют различные внутримолекулярные превращения. Подразделяют в зависимости
от типа реакции изомеризации.
Название: «субстрат– изомераза».
Слайд 31
Лигазы (синтетазы). Катализируют реакции присоединения друг к другу
двух молекул с образованием ковалентной связи. Этот процесс сопряжен
с разрывом макроэргических связей в молекуле АТФ (или других нуклеозидтрифосфатов).
Название: «субстрат– лигаза».
В случае, когда источником энергии служит любое другое макроэргическое соединение (не АТФ), ферменты называют синтазами
Слайд 32
В 1972 г. комиссией по номенклатуре биохимических соединений
Международного союза теоретической и прикладной химии были предложены «Правила
номенклатуры ферментов», имеющие кодовое четырехзначное цифровое обозначение
первая цифра обозначает класс фермента,
вторая цифра (подкласс) уточняет преобразуемую группировку,
третья (подподкласс) – уточняет дополнительных участников реакции (например, донора и акцептора),
четвертая – порядковый номер фермента в данной подгруппе.
Слайд 33
КОФАКТОРЫ И КОФЕРМЕНТЫ
Часть фермента небелковой природы – кофермент
Ион
металлов в составе фермента - кофактор
Белковая часть фермента
– апофермент
Кофермент с белковой молекулой (апоферментом) формируют молекулу холофермента
Слайд 34
Кофакторы
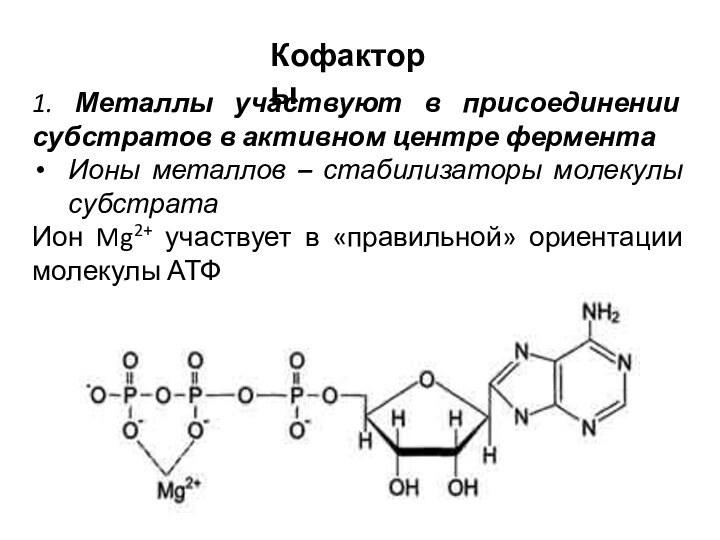
1. Металлы участвуют в присоединении субстратов в активном
центре фермента
Ионы металлов – стабилизаторы молекулы субстрата
Ион Mg2+
участвует в «правильной» ориентации молекулы АТФ
Слайд 35
Ионы металла – стабилизаторы активного центра фермента
Выполняют
функцию стабилизаторов активного центра, облегчая присоединение к нему субстрата
и протекание химической реакции.
Mg2+, Mn2+, Zn2+, Co2+, Мо2+.
Слайд 36
2. Металлы участвуют в стабилизации третичной и четвертичной
структуры фермента
Некоторые ферменты в отсутствие ионов металлов способны к
химическому катализу, однако они нестабильны.
Слайд 37
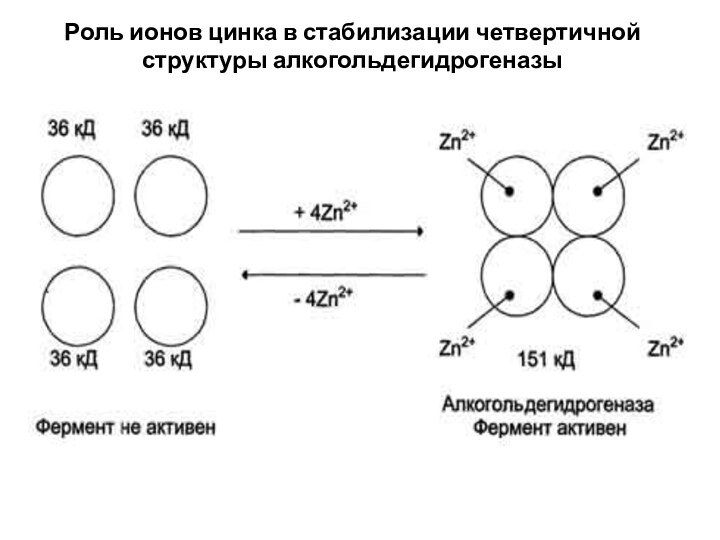
Роль ионов цинка в стабилизации четвертичной структуры алкогольдегидрогеназы
Слайд 38
3. Металлы участвуют в ферментативном катализе
Участие в электрофильном
катализе
Эту функцию выполняют ионы металлов, выступающие в качестве
электрофилов. Это, в первую очередь, такие металлы, как Zn2+, Fe2+, Mn2+, Cu2+.
Участие в окислительно-восстановительных реакциях
Ионы металлов с переменной валентностью могут также участвовать в переносе электронов.
Слайд 39
4. Металлы участвуют в регуляции активности ферментов
Иногда ионы
металлов выступают в роли регуляторных молекул. Например, ионы Са2+
служат активаторами фермента протеинкиназы С, катализирующего реакции фосфорилирования белков. Ионы Са2+ также изменяют активность ряда кальций-кальмодулинзависимых ферментов.
Слайд 40
КОФЕРМЕНТЫ
Большинству ферментов необходимо наличие кофермента. Исключение составляют гидролитические
ферменты (например, протеазы, липазы, рибонуклеаза).
Кофермент может выступать в
качестве акцептора и донора химических группировок, атомов, электронов.
Кофермент может быть связан с белковой частью молекулы ковалентными (простетическая группа) и нековалентными связями.