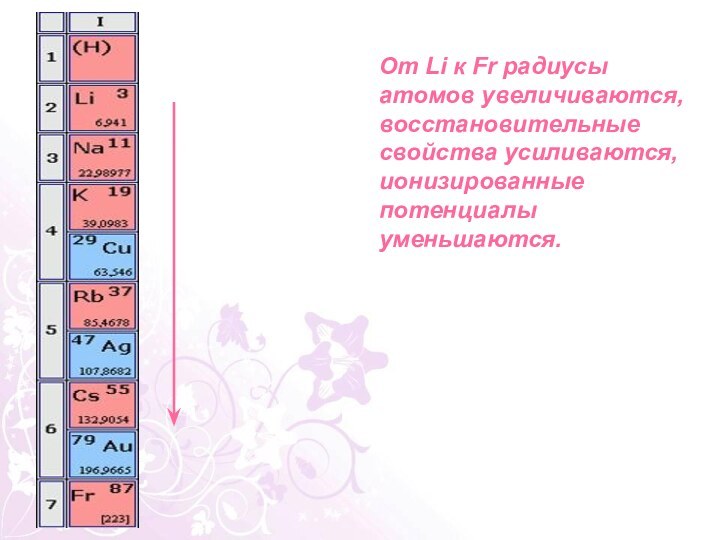
характеристика элементов щелочных металлов по их положению в периодической
системе.2.Нахождение в природе.
3.Получение.
4.Физические свойства.
5.Химические свойства.
6.Соединения щелочных металлов
А)гидроксиды
Б) гидриды, пероксиды, оксиды.
7. Применение щелочных металлов и их соединений.
8.Осуществить превращения
9.Задача 1 стр 126
10 Задание на дом :§47, задача3 стр.127