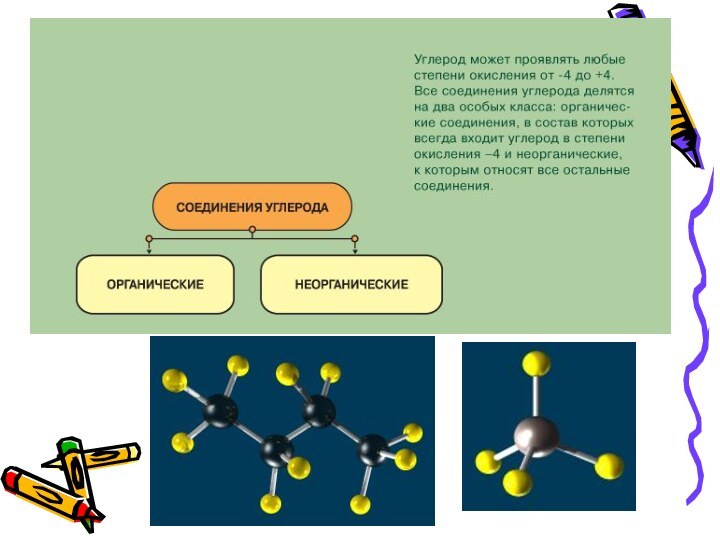
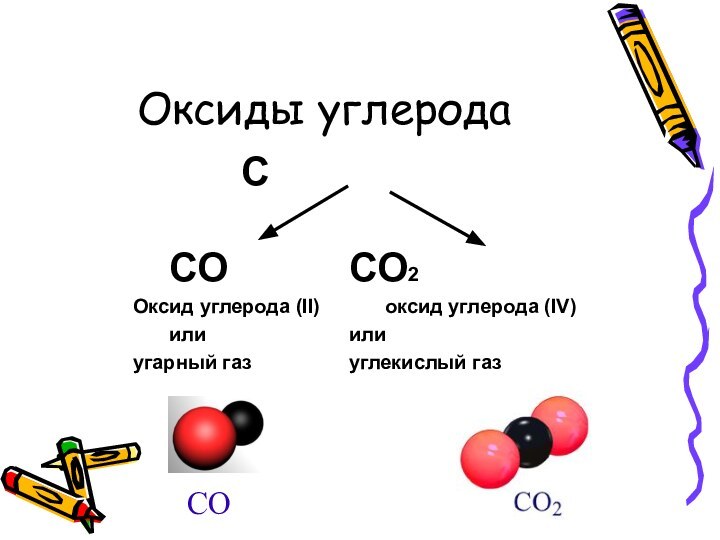
имеющий запаха, плохо растворимый в воде ядовитый газ, относится
к несолеобразующим оксидам.Молекулы СО очень прочны, поскольку связь между атомами углерода и кислорода в них тройная.
Для оксида углерода (II) характерны восстановительные свойства. Например, он восстанавливает металлы из оксидов:
CuO + CO = Cu + CO2
На воздухе угарный газ горит:
2CO + O2 = 2CO2