- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Основания
Содержание
- 2. Основания - сложные вещества, состоящие из атомов металла, соединённых с одной или несколькими гидроксогруппамиОбщая формула: Me(OH)n
- 3. основанияРастворимые (щелочи)Li OH, Ba(OH)2(гидроксиды Ме главных
- 4. НоменклатураНазваниеоснованияГидроксидНазвание металла в род. падВалентностьметалла римскими цифрамиFe(OH)3Ca(OH) 2NaOH
- 5. Химические свойства основанийКачественные реакцииВзаимодействия с кислотамиВзаимодействие с оксидами неметаллов
- 6. Индикатор – вещество, изменяющее свой цвет
- 7. Взаимодействие с кислотами
- 8. НейтрализацияНейтрализация- реакция кислот с основаниями, приводящая к
- 9. Взаимодействие с оксидами неметалловNaOH + CO2 =
- 10. КИСЛОТЫ
- 11. Кислоты – сложные вещества,
- 12. НОМЕНКЛАТУРА КИСЛОТ
- 13. А) по числу атомов водорода (основность)Кислотыкислородныебескислородные
- 14. Химические свойства кислотДействие кислот на индикаторыВзаимодействие с металламиС основными оксидамиС основаниямиС солями
- 15. Качественные реакцииназадДействие кислот на индикаторы
- 16. 2. Взаимодействие с металлами2HCl + Fe=FeCl2
- 17. 3. Взаимодействие с основными оксидамиt2HCl + CaO
- 18. 4. Взаимодействие с основаниямиHCL + NaOH = NaCl + H2OH2SO4 + Ba(OH)2 = BaSO4 + 2H2Oназад
- 19. 5. Взаимодействие с солямиБолее сильные кислоты вытесняют
- 20. Нахождение кислот в природе (органические)яблочнаящавелеваямуравьинаялимоннаямолочная
- 21. Применение кислот Очистка поверхности металловОчистка нефтепродуктовПолучение красокПолучение
- 22. Скачать презентацию
- 23. Похожие презентации
Основания - сложные вещества, состоящие из атомов металла, соединённых с одной или несколькими гидроксогруппамиОбщая формула: Me(OH)n



















Слайд 3
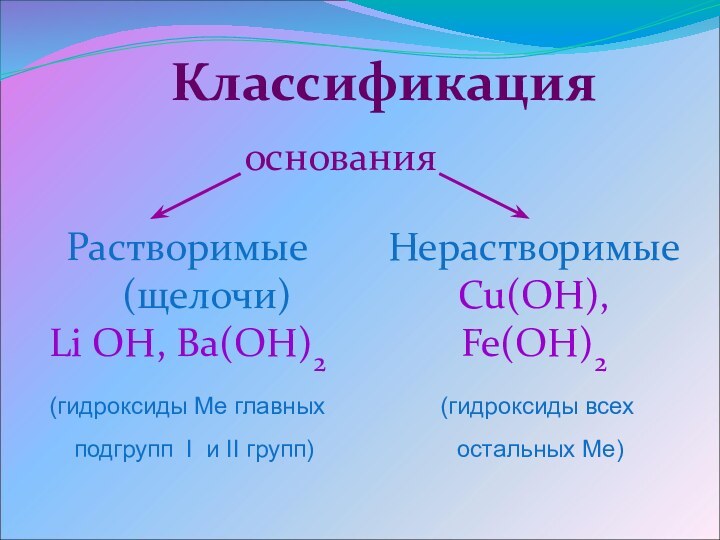
основания
Растворимые
(щелочи)
Li OH, Ba(OH)2
(гидроксиды Ме главных
подгрупп
I и II групп)
Нерастворимые
Cu(OH), Fe(OH)2
(гидроксиды всех
остальных
Ме)Классификация
Слайд 4
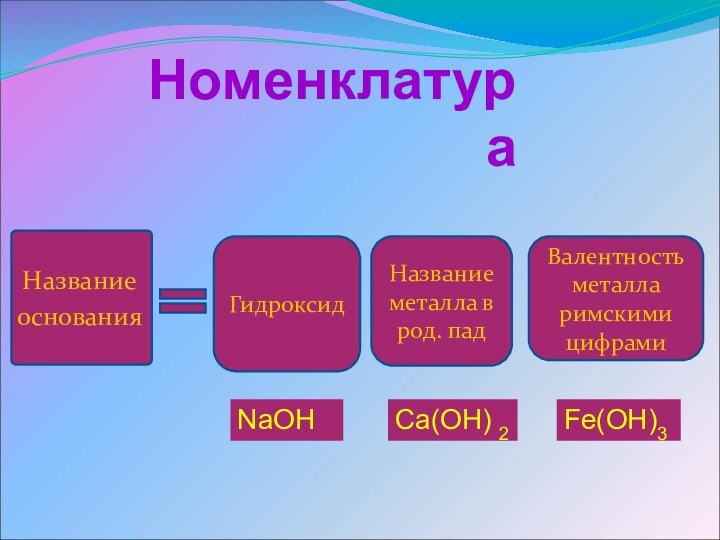
Номенклатура
Название
основания
Гидроксид
Название металла в род. пад
Валентность
металла римскими цифрами
Fe(OH)3
Ca(OH) 2
NaOH
Слайд 5
Химические
свойства оснований
Качественные реакции
Взаимодействия с кислотами
Взаимодействие с оксидами
неметаллов
Слайд 6
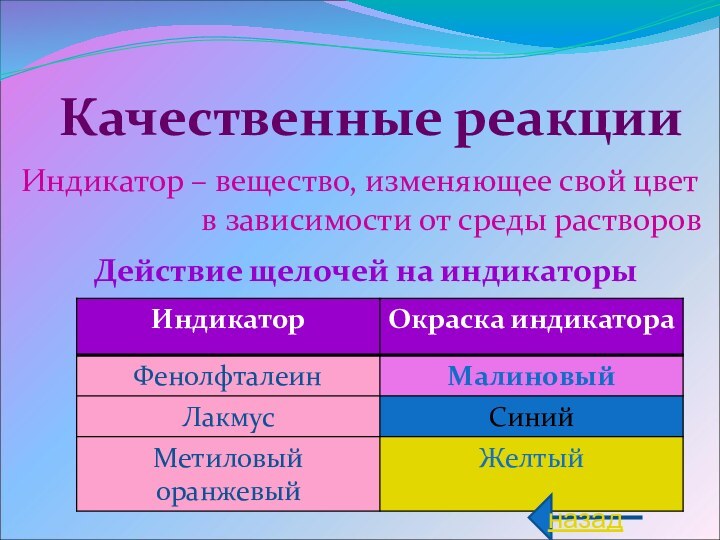
Индикатор – вещество, изменяющее свой цвет
в зависимости от среды растворов
Действие щелочей на индикаторы
Качественные реакции
назад
Слайд 8
Нейтрализация
Нейтрализация- реакция кислот с основаниями, приводящая к образованию
соли и воды:
NaOH + HCl = NaCl + H2O
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
За прохождением реакций можно наблюдать по изменениям окраски индикаторов.
Вывод: В результате данных реакций раствор стал нейтральными.
назад
Слайд 9
Взаимодействие с оксидами неметаллов
NaOH + CO2 = Na2CO3
+ H2O
Ca(OH)2 + CO2 = CaCO3 + H2O
(качественная реакция
на гидроксид кальция –помутнение известковой воды)
Слайд 11
Кислоты – сложные вещества,
состоящие из атомов
водорода, способныхзамещаться на металл и
кислотного остатка
ОБЩАЯ ФОРМУЛА
HR
Слайд 13
А) по числу атомов водорода (основность)
Кислоты
кислородные
бескислородные
H2SO4
– серная кислота
HNO3 - азотная кислота
H3PO4 –
фосфорная кислотаHCl – хлороводородная
кислота
H2S – сероводородная
кислота
Классификация
Кислоты
oдноосновные
НCl HNO3
двухосновные
H2S H2SO4
трехосновные
H3PO4
Б) по наличию кислорода в кислотном остатке
Слайд 14
Химические свойства кислот
Действие кислот на индикаторы
Взаимодействие с металлами
С
основными оксидами
С основаниями
С солями
Слайд 16
2. Взаимодействие с металлами
2HCl + Fe=FeCl2 +
H2
H2SO4 + Zn=ZnSO4 + H2
(стоящими в электрохимическом ряду напряжения
до водорода)
назад
Слайд 19
5. Взаимодействие с солями
Более сильные кислоты вытесняют из
солей более слабые кислоты.
2HCl + Na2S = H2S +
2NaCl2HCl + Na2CO3 = 2NaCl + H2CO3
CO2
H2O