- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Основные типы химической связи
Содержание
- 2. Химическая связь – совокупность сил, обуславливающих взаимодействие атомов в химических соединениях
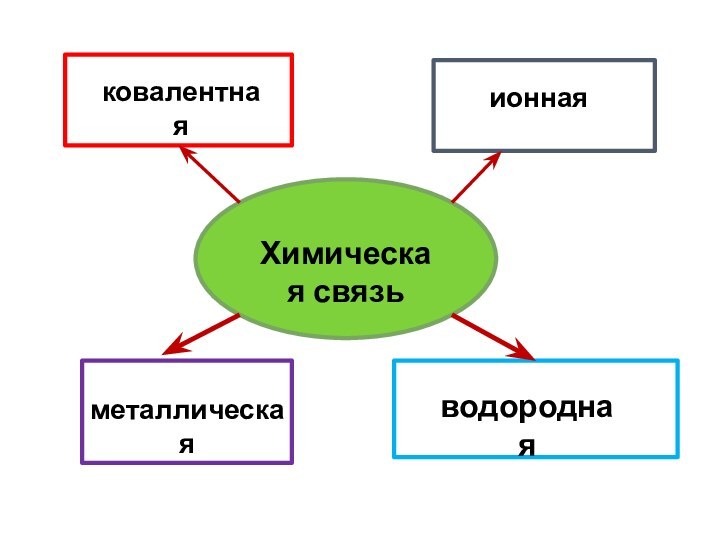
- 3. Химическая связьковалентнаяионнаяметаллическаяводородная
- 4. Ковалентная связьЭто связь, которая возникает за счет образования между атомами общих электронных пар
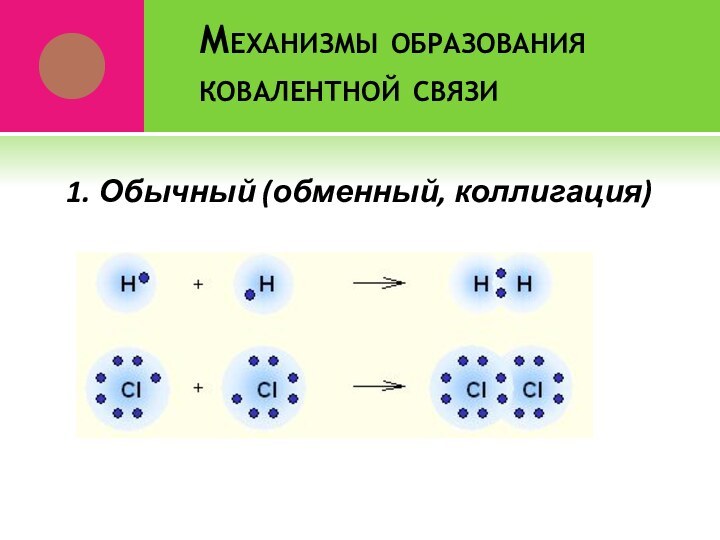
- 5. Механизмы образования ковалентной связи1. Обычный (обменный, коллигация)
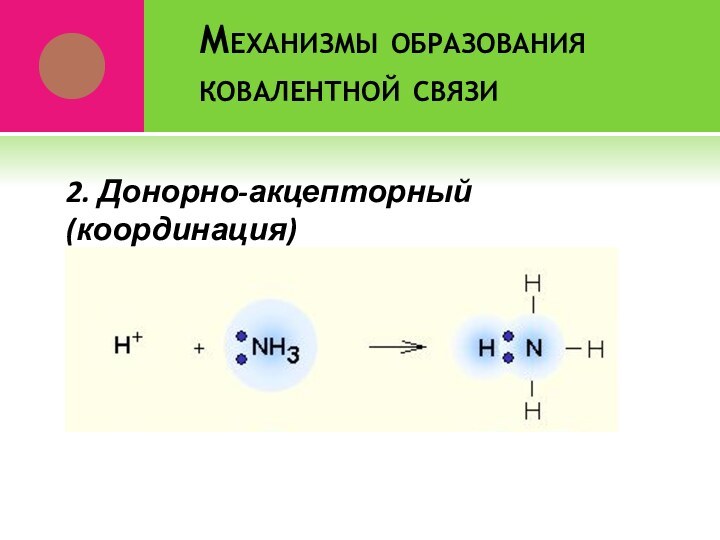
- 7. Механизмы образования ковалентной связи2. Донорно-акцепторный(координация)
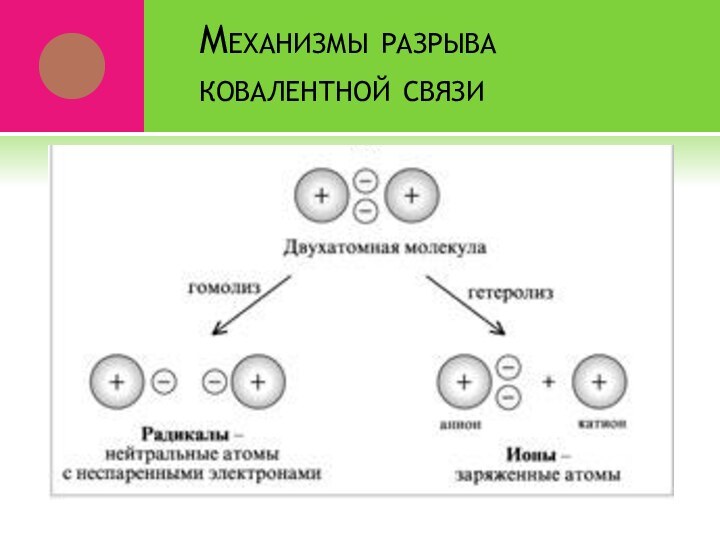
- 9. Механизмы разрыва ковалентной связи
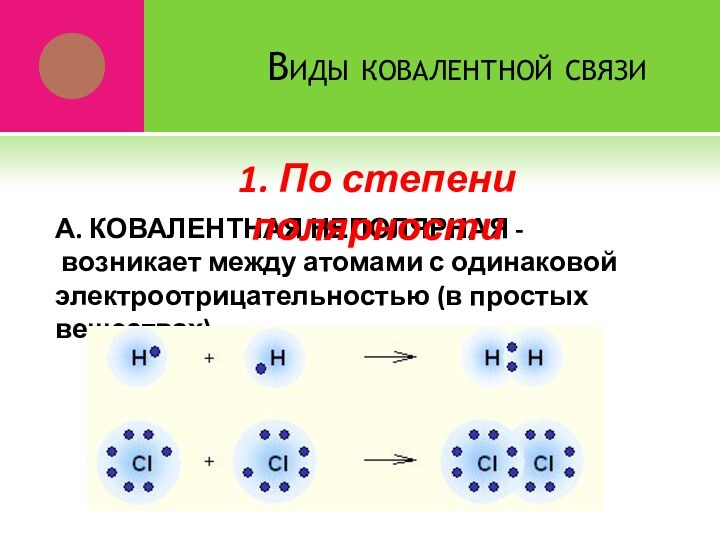
- 10. Виды ковалентной связиА. КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ - возникает
- 11. Виды ковалентной связиБ. КОВАЛЕНТНАЯ ПОЛЯРНАЯ - возникает между атомами с различной электроотрицательностью, разница ЭО
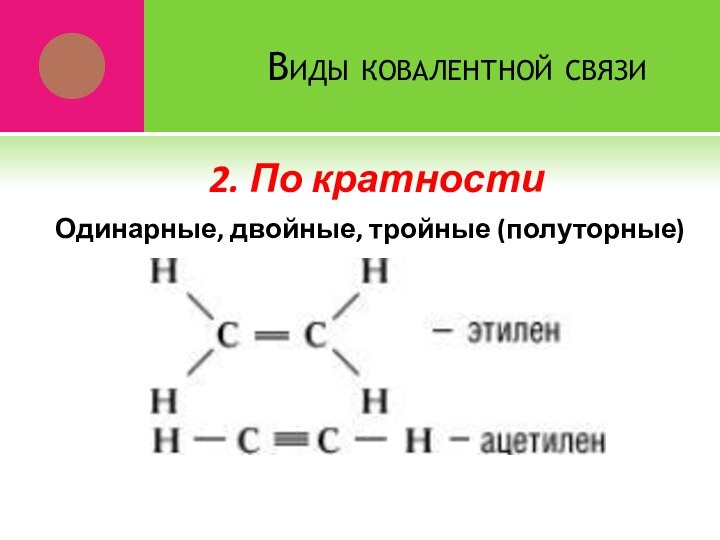
- 12. Виды ковалентной связиОдинарные, двойные, тройные (полуторные)2. По кратности
- 13. Виды ковалентной связиА. Ϭ-связи 3. По способу перекрывания
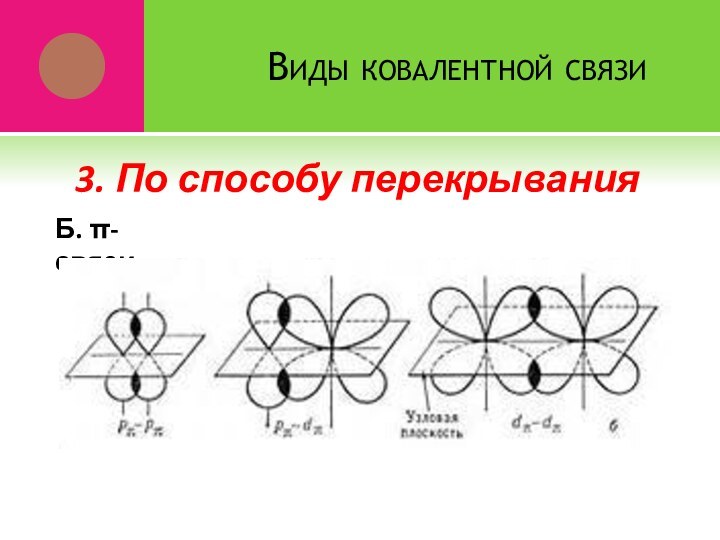
- 14. Виды ковалентной связиБ. π-связи 3. По способу перекрывания
- 15. Параметры ковалентной связиДлина связи – это расстояние
- 16. Параметры ковалентной связиВалентный угол – угол
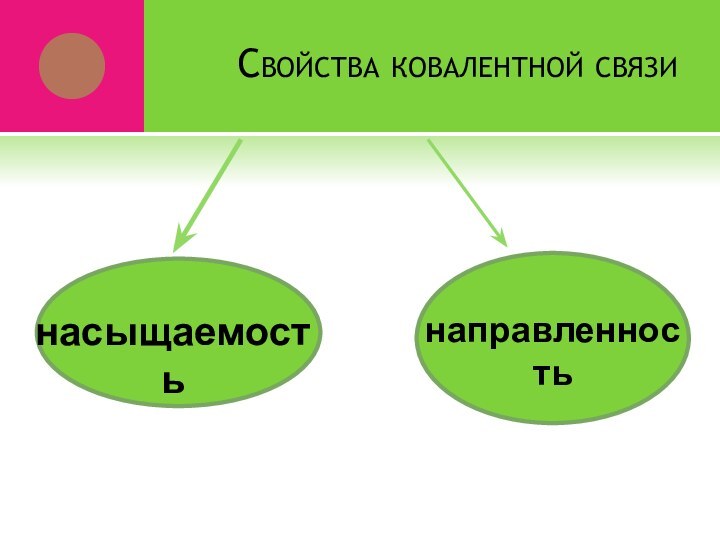
- 17. Свойства ковалентной связинасыщаемостьнаправленность
- 18. насыщаемостьАтомы могут образовывать определенное число ковалентных химических
- 19. направленностьАтомные орбитали (перекрывающиеся при образовании ковалентных связей)
- 20. Ионная химическая связьВозникает между типичными металлами и
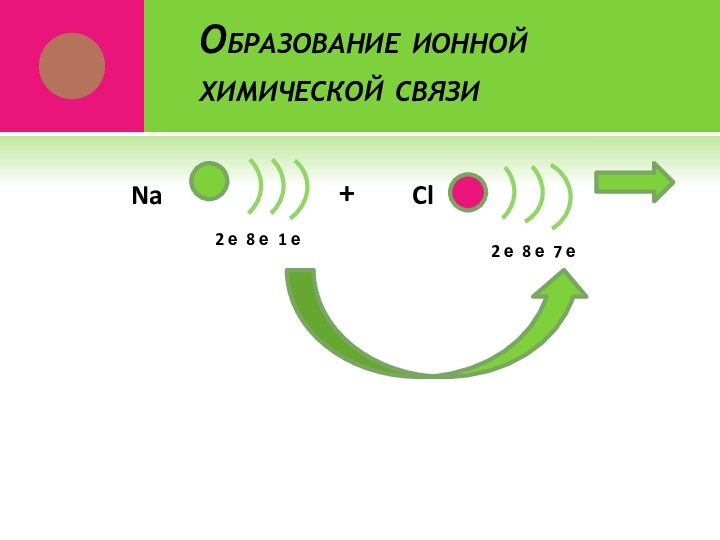
- 21. Образование ионной химической связи2 е 8 е 1 еNa+Cl2 е 8 е 7 е
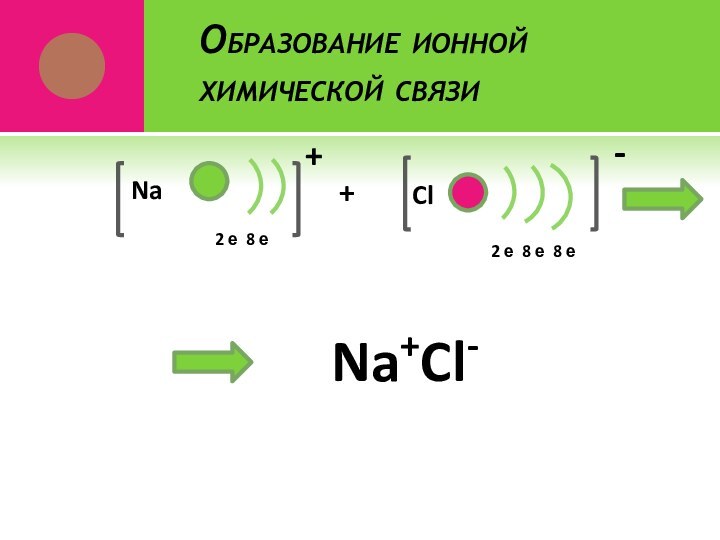
- 22. Образование ионной химической связи2 е 8 е Na+Cl2 е 8 е 8 е+-Na+Cl-Na+Cl-
- 23. Заряженные частицы, в которые превращаются атомы в
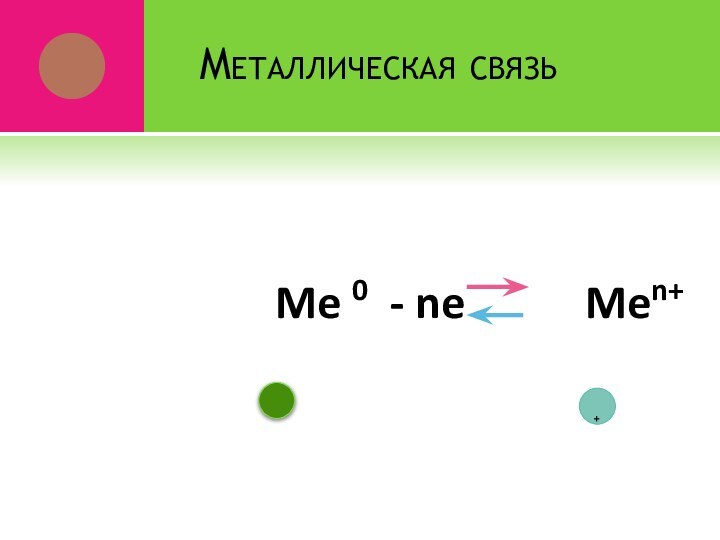
- 24. Металлическая связь Me 0 - ne Men++
- 25. Металлическая связь
- 26. Оторвавшиеся электроны перемещаются от одного иона к
- 27. Скачать презентацию
- 28. Похожие презентации
Химическая связь – совокупность сил, обуславливающих взаимодействие атомов в химических соединениях














Слайд 2 Химическая связь – совокупность сил, обуславливающих взаимодействие атомов
в химических соединениях
Слайд 4
Ковалентная связь
Это связь, которая возникает за счет образования
между атомами общих электронных пар
Слайд 10
Виды ковалентной связи
А. КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ -
возникает
между атомами с одинаковой электроотрицательностью (в простых веществах)
1. По
степени полярности
Слайд 11
Виды ковалентной связи
Б. КОВАЛЕНТНАЯ ПОЛЯРНАЯ -
возникает
между атомами с различной электроотрицательностью, разница ЭО
Слайд 15
Параметры ковалентной связи
Длина связи – это расстояние между
центрами взаимодействующих атомов
Энергия связи – энергия, которая выделяется при
ее образовании (или поглощается при разрыве). Измеряется в кДж/моль
Слайд 16
Параметры ковалентной связи
Валентный угол – угол между центрами
взаимодействующих атомов
Полярность связи (определяется разницей в ЭО)– характеризуется дипольным
моментомµ=q·r
Слайд 18
насыщаемость
Атомы могут образовывать определенное число ковалентных химических связей
(валентность)
Валентность определяется:
числом неспаренных электронов
числом неподеленных электронных пар (могут
участвовать в донорно-акцепторном взаимодействии)числом свободных орбиталей
Слайд 19
направленность
Атомные орбитали (перекрывающиеся при образовании ковалентных связей) имеют
направленность в пространстве (кроме s-орбиталей)
Направленность орбиталей обуславливает пространственную конфигурацию
молекул
Слайд 20
Ионная химическая связь
Возникает между типичными металлами и неметаллами
(разница в электроотрицательности ˃ 2,
элементы I, II групп +
элементы VI, VII групп)Слайд 23 Заряженные частицы, в которые превращаются атомы в результате
отдачи или присоединения электронов называются ионами
Связь между ионами называется
ионной химической связьюСоединения, в которых присутствует ионная химическая связь, называются ионными соединениями
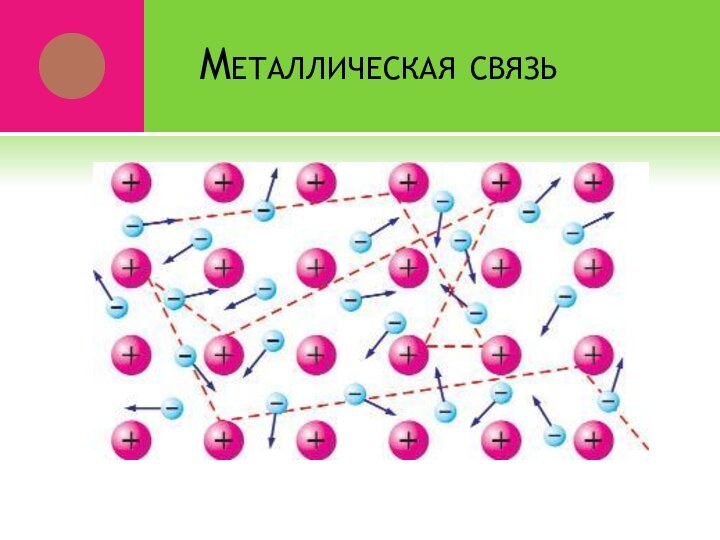
Слайд 26 Оторвавшиеся электроны перемещаются от одного иона к другому,
связывая их в единое целое
Связь в металлах между ионами
посредством обобществленных электронов называется металлическойМеталлическая связь характерна для металлов и их сплавов в твердом и жидком состоянии





























