- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Основы кристаллохимии
Содержание
- 2. Кристаллохимия связывает кристаллическую структуру (строение кристалла) и
- 3. Атомы химических элементов в природе находятся в
- 4. В настоящее время в кристаллохимии наметились три
- 5. 1. Классическая кристаллохимия: структура любого минерала представляется
- 6. 2. На основании квантово-механических орбитальных (ковалентных) радиусов
- 7. 3. Остовно-электронная (электридная) модель: структура минералов состоит
- 8. Расстояние, на которое центр сферы одного атома
- 9. В 1923 г. с помощью рефрактометрических исследований
- 10. Радиусы, измеренные в Ǻ (ангстремы), называются эффективными,
- 11. 1. Атомные радиусы в периодах уменьшаются слева
- 13. 2. У элементов, которые могут выступать в
- 14. 3. В рядах или группах радиусы атомов
- 15. Размеры атомных радиусов изменяются в пределах от
- 16. В подгруппах лантаноидов и актиноидов отмечается закономерное
- 17. Более значительные уменьшения радиусов наблюдаются у элементов
- 18. Близость ионных радиусов наблюдается и по диагонали
- 19. Максимальные или минимальные (экстремальные) радиусы в сочетании
- 20. На размеры радиусов влияют факторы: температура (с
- 21. Ионно-атомные радиусы (по В.И. Лебедеву) – это
- 22. Мерой прочности связи электрона с ядром является
- 23. Отдавая валентные электроны, атом переходит в положительно
- 24. Первый и единственный электрон, расположенный на внешней
- 25. Каждый последующий электрон связан с ядром сильнее,
- 26. Потенциал ионизации
- 27. Потенциал ионизации определяет химическую активность элемента, его
- 28. Зависимость потенциала ионизации атомов от порядкового номера элемента
- 29. Энергия сродства к электрону (ε) - способность
- 30. Сродство атома к электрону численно близко
- 31. Высокую энергию сродства имеют р-элементы VII группы,
- 32. ЭлектроотрицательностьЭлектроотрицательность (χ – греч. хи) – количественная
- 33. Электроотрицательность носит периодический характер - в периодах
- 35. Величина электроотрицательности характеризует силовое поле атома (ядра)
- 36. Энергия электроотрицательности – одна из важных характеристик
- 37. Химическая связь Химическая связь – это взаимодействие
- 38. Основная причина соединений атомов в кристаллические постройки
- 39. Ионная (гетерополярная, электровалентная) связь Ионная связь –
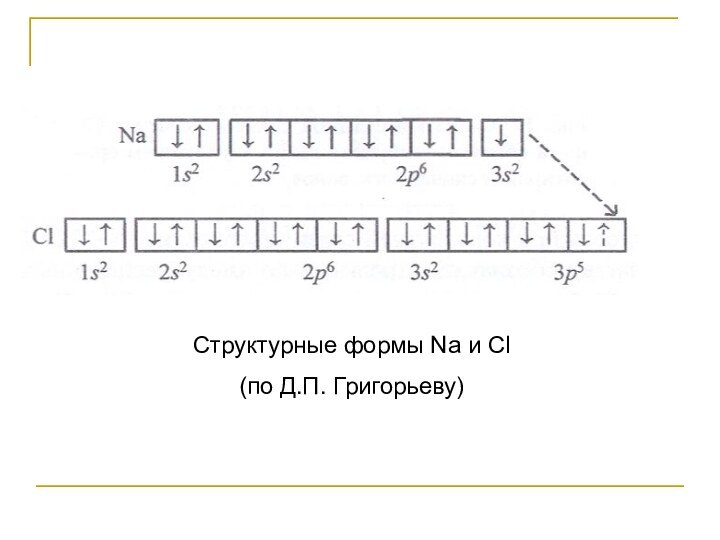
- 40. Нейтральные атомы или противоположно заряженные ионы с
- 42. Структурные формы Na и Cl (по Д.П. Григорьеву)
- 43. Ковалентная (атомная) связь Ковалентная связь – химическая
- 44. Направленность связи обусловлена молекулярным строением вещества и
- 45. Полярность связи обусловлена неравномерным распределением электронной плотности
- 46. Поляризуемость связи выражается в смещении электронов связи
- 47. Если энергия электроотрицательности у двух атомов, вступающих
- 49. Схема ковалентной связи в молекуле Cl: а
- 50. Донорно-акцепторная связь Донорно-акцепторная связь может рассматриваться как
- 51. Доноры предоставляют пару электронов, а акцепторы –
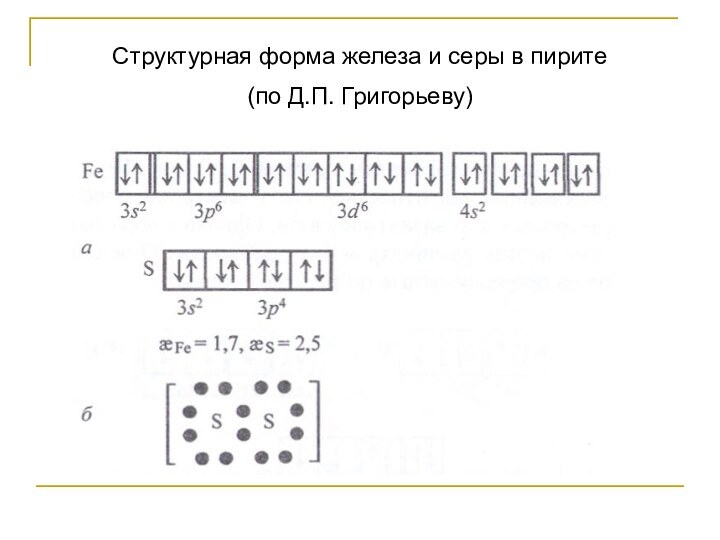
- 52. Структурная форма железа и серы в пирите
- 53. Структурная форма железа и серы в пирите (по Д.П. Григорьеву)
- 54. Металлическая связь Металлическая связь – химическая связь,
- 55. Металлическая связь
- 56. Металлическая связь не имеет направленности. Это способствует
- 57. Молекулярная связь Молекулярная (остаточная или ван-дер-ваальсовская) связь
- 58. Смешанные связи Один и тот же элемент
- 59. Промежуточные связи В «чистом» виде какая-то конкретная
- 60. Кривая зависимости между разностью электроотрицательности атомов в бинарном соединении и соотношением ионной и ковалентной связи
- 61. Координационное число Координационное число - число ближайших
- 62. Прямые линии, соединяющие центры ближайших атомов или
- 63. По данным А.Ф. Капустинского, самое распространенное координационное
- 64. Согласно классической кристаллохимии координационное число, а следовательно,
- 66. Поляризация Поляризация - смещение электронного облака по
- 67. Когда ион деформирует электронное облако соседа, искажает
- 68. Активная поляризация характерна для катионов, пассивная –
- 69. Влияние поляризации на структуры кристаллов типа АХ2 (морфотропия) СO2 - молекулярная решетка
- 70. При соединении катионов с активной поляризацией и
- 71. Комплексные анионы обычно очень стойкие и не
- 72. Это ведет к распаду комплексного аниона (и
- 73. Очень сильными поляризаторы: халькофильные элементы, особенно Сu
- 74. Данные радиусов, координационные числа и поляризация определяют
- 75. Энергия кристаллической решетки Прочность кристаллической постройки, устойчивость
- 76. Энергия, которую надо затратить, чтобы разрушить соединение
- 77. В 1933 г. А.Ф. Капустинский предложил формулу
- 78. Эта формула выражает второй основной закон кристаллохимии
- 79. На основе этой формулы А.Ф. Капустинского А.Е.
- 80. Экспериментальный метод подсчета энергии решеток основывается на
- 82. На смену понятию энергии кристаллической решетки пришло
- 83. Энергия атомизации слагается из суммы стандартной энтальпии
- 84. Значение энергии кристаллической решетки Механическая прочность (твердость)
- 85. Если взять два минерала форстерит Mg2SiO4 и
- 86. От энергии решетки (минералов) можно прийти к
- 87. Первый закон (принцип) термодинамики гласит, что в
- 88. Энергия есть функция энтропии (S) и объема
- 89. Во всех природных самопроизвольных процессах энтропия (S)
- 90. Энтальпия (Н) или полная энергия системы Н
- 91. Второй принцип или закон термодинамики указывает на
- 92. Остовно-электронная модель Любое химическое соединение состоит из
- 93. Схема связей в кристалле сфалерита ZnS с разверткой на плоскость тетраэдрической координации атомов
- 94. Схема ординарной связи металл-неметалл по X. Бенту
- 95. M и X – атомные остовы, между
- 97. Электронный заряд - заряд электрида (q) двухцентровой
- 98. Любая химическая связь есть электронный мостик между
- 99. В гомоатомных соединениях λ = 0 (симметричное
- 100. Количественная оценка смещения электронной плотности от менее
- 101. Алгебраическим суммированием зарядов остова и долей окружающих
- 102. Формулы минералов с эффективными зарядами атомов
- 103. С позиции остовно-электронной модели рассматривается проблема взаимного
- 104. Скачать презентацию
- 105. Похожие презентации
Кристаллохимия связывает кристаллическую структуру (строение кристалла) и его химический состав, объясняет устойчивость тех или иных кристаллических конструкций.





































































































Слайд 2 Кристаллохимия связывает кристаллическую структуру (строение кристалла) и его
химический состав, объясняет устойчивость тех или иных кристаллических конструкций.
Слайд 3 Атомы химических элементов в природе находятся в постоянном
взаимодействии, а различные соединения, кристаллические постройки зависят от строения
электронных оболочек.Взаимодействия атомов вызваны стремлением их к устойчивому состоянию, к минимуму энергии, которое осуществляется заполнением электронами всех соответствующих уровней и подуровней.
Слайд 4
В настоящее время в кристаллохимии наметились три направления:
Классическая
кристаллохимия
Кристаллохимия на основании квантово-механических орбитальных радиусов атомов
Остовно-электронная (электридная) модель
Основные
параметры:энергетические величины (энергия решетки, ионный потенциал, электроотрицательность и др.)
радиусы
координационные числа
Слайд 5 1. Классическая кристаллохимия: структура любого минерала представляется как
система с крупными анионами (–) и мелкими катионами (+),
расположенных по принципу плотнейшей упаковки.Слайд 6 2. На основании квантово-механических орбитальных (ковалентных) радиусов атомов
сделаны выводы, что кристаллическая структура минералов слагается из крупных
металлических катионов и мелких неметаллических анионов.Слайд 7 3. Остовно-электронная (электридная) модель: структура минералов состоит из
положительно заряженных атомов-остовов металлов и неметаллов и связывающих их
валентных электронов, придающих минералу электронно-нейтральное состояниеСлайд 8 Расстояние, на которое центр сферы одного атома (шара)
может приблизиться к поверхности сферы соседа, или половина расстояния
между атомами одного и того же элемента называется атомным радиусом.Его можно назвать также ковалентным радиусом.
Радиусы атомов и ионов
Слайд 9 В 1923 г. с помощью рефрактометрических исследований И.В. Вазештерном
были получены размеры радиусов F–= 1,33Ǻ (1 Ǻ =
10-8 см) и О2- = 1,32 Ǻ, что позволило вычислить размеры других ионов и определить некоторые закономерности.В 1926 г. В.М. Гольдшмидт дал систему ионных радиусов. Он считал размеры атомов основными характеристиками, универсальными величинами в геохимии.
Слайд 10 Радиусы, измеренные в Ǻ (ангстремы), называются эффективными, а
вычисленные – истинными, лишенными влияния побочных факторов.
На основе квантовой
механики были рассчитаны орбитальные радиусы, т.е. расстояния от ядра атома до максимума электронной плотности определенной электронной орбиты.Слайд 11 1. Атомные радиусы в периодах уменьшаются слева направо
до VII группы. Радиусы ионов тоже уменьшаются слева направо
до VI группы, когда элементы ведут себя как катионы, а в VI и VII группах увеличиваются, когда элементы ведут себя как анионы.Слайд 13 2. У элементов, которые могут выступать в соединениях
и как катионы, и как анионы, существует такая зависимость:
RкПример: RS-2 = 1,74 Ǻ, RS0=0,91 ǺS6+, =0,34 Ǻ
(к - катион, ат - атом, а - анион, S - сера).
Слайд 14 3. В рядах или группах радиусы атомов и
ионов растут, что связано с добавлением электронных оболочек к
каждому нижестоящему элементу.Слайд 15 Размеры атомных радиусов изменяются в пределах от 0,46
Ǻ у водорода до 2,68 у Cs, а ионные
радиусы - от 0,15 Ǻ у азота до 2,20 Ǻ у йода.По А.Е. Ферсману это - элементы с крайними радиусами, т.е. меньше 0,65 Ǻ («мелкие») и больше 1,40 Ǻ (крупные), которые с трудом находят для себя устойчивые решетки и часто оказываются «не удел» в ходе кристаллизации, накапливаются в остаточных расплавах, переходят в растворы, газовые смеси.
Слайд 16 В подгруппах лантаноидов и актиноидов отмечается закономерное плавное
уменьшение ионного радиуса.
Это явление получило название «лантаноидное сжатие», вызванное
добавлением электронов на внутренний третий слой (оболочку). Увеличение заряда ядра приводит к увеличению притяжения внешних электронов и уменьшению ионного радиуса. В группе самих лантаноидов все элементы имеют близкие радиусы и стремятся к совместному нахождению в природе.
Слайд 17 Более значительные уменьшения радиусов наблюдаются у элементов 5
и 6 периодов середины таблицы, вызванные добавлением 10 d-электронов
(5 период) и 14 электронов лантаноидных элементов к внутренним оболочкам.Образуются пары элементов 5-го и 6-го периодов, у которых радиусы атомные и ионные одинаковы: Zr – Hf, Nb – Та, Mo – W, Cd – Hg, Ag – Au, что обусловливает их совместное нахождение в геохимических процессах
Слайд 18 Близость ионных радиусов наблюдается и по диагонали в
периодической системе слева сверху направо вниз.
Эту особенность отметил А.Е. Ферсман
и назвал ее «законом диагональных рядов».Закон объясняет сходное поведение этих элементов в природе.
Слайд 19 Максимальные или минимальные (экстремальные) радиусы в сочетании также
с экстремальными позициями потенциала ионизации и электросродства позволяют выявить
окислительные состояния химических элементов
Слайд 20
На размеры радиусов влияют факторы:
температура (с увеличением
температуры радиус иона увеличивается),
давление (с повышением давления радиус
уменьшается),координационное число (при переходе от большего числа координации к меньшему радиус сокращается),
валентность (увеличение зарядности приводит к уменьшению радиуса иона: Fe3+ – Ri 067; Fe22+ 0,83.
Слайд 21 Ионно-атомные радиусы (по В.И. Лебедеву) – это расстояние
от ядра до того подуровня, электроны которого принимают участие
в соединении, т.е. радиусы не являются неизменными.Слайд 22 Мерой прочности связи электрона с ядром является энергетическая
величина – потенциал ионизации (J).
Потенциал ионизации - это
минимальное напряжение поля, в электроновольтах, при котором происходит отрыв от нейтрального атома его наружного электрона, т.е. это та энергия, которую нужно затратить, чтобы оторвать электрон и вывести его из поля действия ядра Потенциал ионизации - энергия, с которой атом удерживает свои электроны.
Потенциал ионизации
Слайд 23 Отдавая валентные электроны, атом переходит в положительно заряженный
ион (Na+, К+, Са2+ ...) – катион.
Если атом
принимает электроны и достраивает внешний слой до завершенного, он переходит в отрицательно заряженный ион – анион (F–, Сl–, О2-, S2-...). Слайд 24 Первый и единственный электрон, расположенный на внешней оболочке,
наиболее слабо связан с ядром, т.е. для его отрыва
затрачивается незначительная энергия – это первый потенциал ионизации J1.Для удаления следующего электрона с этой же оболочки от однозарядного положительного иона требуется затратить больше энергии – это второй потенциал ионизации – J2, затем третий – J3 и т.д.
Слайд 25 Каждый последующий электрон связан с ядром сильнее, чем
предыдущий и имеет большую величину J.
Потенциал ионизации носит
периодический характер: в ряду уменьшается сверху вниз, а в периодах увеличивается слева направо Слайд 27 Потенциал ионизации определяет химическую активность элемента, его способность
участвовать в химических реакциях: чем меньше J, тем легче
атом переходит в ион, тем он более химически активен (например, щелочи).Самый высокий потенциал ионизации у благородных газов, которые не участвуют в химических процессах.
Слайд 29 Энергия сродства к электрону (ε) - способность атома
удерживать в своем электрическом поле чужие электроны.
Энергией сродства атома
к электрону (ε), называют энергию, выделяющуюся в процессе присоединения электрона к свободному атому в его основном состоянии с превращением его в отрицательный ион (анион). Слайд 30 Сродство атома к электрону численно близко (или
равно), но противоположно по знаку энергии ионизации (потенциалу ионизации)
соответствующего изолированного однозарядного аниона.По аналогии с потенциалом ионизации различают первое и второе сродство к электрону.
Сродство к электрону выражают в килоджоулях на моль (кДж/моль) или в электронвольтах на атом (эВ/атом).
Слайд 31 Высокую энергию сродства имеют р-элементы VII группы, которым
не хватает всего одного электрона, чтобы достроить внешнюю оболочку
до завершенного состояния (F, Сl).Так же как и потенциал ионизации, эта величина носит периодический характер: в периодах слева направо электросродство увеличивается, а в рядах сверху вниз, как правило, уменьшается:
Li – 0,82, Be – 0,19, В – 0,33 ... О – 1,47; Na – 0,47, Mg – 0,32 ... S – 2,07; Сu – 2,4, Ag – 2,5, Аu – 2,1 (в эВ или ккал).
Слайд 32
Электроотрицательность
Электроотрицательность (χ – греч. хи) – количественная характеристика
способности атома а молекуле, смещать к себе общие электронные
пары или способность атома удерживать в своем электрическом поле свои и чужие электроны.Определяется как сумма потенциала ионизации и сродства к электрону: χ = J+ ε в ккал/г-ат или в относительных единицах.
Слайд 33 Электроотрицательность носит периодический характер - в периодах увеличивается
слева направо, а в рядах - уменьшается сверху вниз
(в относительных единицах).Слайд 35 Величина электроотрицательности характеризует силовое поле атома (ядра) и
зависит от заряда ядра, завершенности строения электронной оболочки, степени
экранирования ядра электронной оболочкой и отдельными электронами, а также от валентности элемента.Слайд 36 Энергия электроотрицательности – одна из важных характеристик атома,
объясняющая поведение его в химических процессах, кислотность – основность
в соединениях с ОН, характер химической связи, изоморфизм и, видимо, еще другие особенности поведения атома как на поверхности, так и в глубинах Земли.
Слайд 37
Химическая связь
Химическая связь – это взаимодействие атомов,
обусловливающее устойчивость молекулы или кристалла как целого.
Современное описание
химической связи проводится на основе квантовой механики.Основные характеристики химической связи – прочность, длина, полярность.
Слайд 38 Основная причина соединений атомов в кристаллические постройки –
стремление атомов к заполнению внешнего (иногда и внутреннего) электронного
слоя до устойчивого состояния (8-ми, 18-ти и т.д. электронного типа).Общее число связей атомов, участвующих в соединении (и их знак), называется валентностью.
Слайд 39
Ионная (гетерополярная, электровалентная) связь
Ионная связь – химическая
связь, образующаяся между атомами с большой разностью электроотрицательностей, при
которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.Слайд 40 Нейтральные атомы или противоположно заряженные ионы с резко
различными значениями электроотрицательтности при взаимодействии образуют соединения (кристаллические постройки)
почти с чистой ионной связью.Примером может служить NaCl.
Слайд 43
Ковалентная (атомная) связь
Ковалентная связь – химическая связь,
образованная перекрытием (обобществлением) пары валентных электронных облаков.
Обеспечивающие связь
электронные облака (электроны) называются общей электронной парой.Характерные свойства ковалентной связи – направленность, насыщаемость, полярность, поляризуемость.
Слайд 44 Направленность связи обусловлена молекулярным строением вещества и геометрической
формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость
– способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.Слайд 45 Полярность связи обусловлена неравномерным распределением электронной плотности вследствие
различий в электроотрицательностях атомов.
По этому признаку ковалентные связи
подразделяются на неполярные и полярные.Слайд 46 Поляризуемость связи выражается в смещении электронов связи под
влиянием внешнего электрического поля, в том числе и другой
реагирующей частицы.Поляризуемость определяется подвижностью электронов.
Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Слайд 47 Если энергия электроотрицательности у двух атомов, вступающих во
взаимодействие, одинакова или почти одинакова, происходит «спаривание» холостых электронов
с разными спинами, а не отрыв.Эта возникшая пара электронов будет являться общей и принадлежать как одному, так и другому атому.
Слайд 49 Схема ковалентной связи в молекуле Cl: а –
в обычном изображении, б – с указанием ориентировки спинов
электронов
Слайд 50
Донорно-акцепторная связь
Донорно-акцепторная связь может рассматриваться как разновидность
ковалентной, так как пара электронов здесь тоже является общей.
Однако в отличие от ковалентной эта пара попеременно присутствует в оболочке одного, потом другого атома.Этот тип связи характерен для d-элементов, достраивающих свою оболочку до 18-электронного типа.
Слайд 51 Доноры предоставляют пару электронов, а акцепторы – свободную
ячейку.
В качестве доноров обычно выступают анионы, получающие после
ионизации 8-электронную оболочку, а акцепторов - катионы с незаселенной d-подгруппой, а иногда и электронных групп из разных слоев.Пример: пирит Fe[S2]
Слайд 54
Металлическая связь
Металлическая связь – химическая связь, которая
обусловлена взаимодействием положительных ионов металлов, составляющих кристаллическую решётку, с
электронным газом из валентных электронов.Слайд 56 Металлическая связь не имеет направленности. Это способствует плотнейшей
упаковке атомов (кубическая, гексагональная сингонии), когда каждый ион стремится
окружить себя максимальным (12) числом соседей.
Слайд 57
Молекулярная связь
Молекулярная (остаточная или ван-дер-ваальсовская) связь наблюдается
между молекулами.
Молекулы притягиваются между собой под действием дисперсионного
эффекта (создания мгновенных диполей), электрических полей соседних молекул – индукционный эффект.
Слайд 58
Смешанные связи
Один и тот же элемент в
одном соединении может проявлять разные связи.
Пример: в кальците Са[СО3],
углерод выступает как трехковалентный с одной ионной связью, а кислород – одновалентный (ионная связь) и одноковалентный (одна ковалентная связь). Таким образом, углерод и кислород проявляют смешанную связь. Известны соединения, в которых внутри молекул осуществляется ковалентная связь, а между молекулами – молекулярная связь (сенармонтит Sb4О6).
Слайд 59
Промежуточные связи
В «чистом» виде какая-то конкретная связь
в минерале (гетероатомном соединении) проявляется редко, чаще это промежуточные
связи, представляющие только доли участия в постройке кристалла разных типов связей, чаще – это ионно-ковалентные связи.Слайд 60 Кривая зависимости между разностью электроотрицательности атомов в бинарном
соединении и соотношением ионной и ковалентной связи
Слайд 61
Координационное число
Координационное число - число ближайших соседей.
Координационное число – характеристика, которая определяет число ближайших равноудаленных
одинаковых частиц (ионов или атомов) в кристаллической решётке. Слайд 62 Прямые линии, соединяющие центры ближайших атомов или ионов
в кристалле, образуют координационный многогранник, в центре которого находится
данный атом.Слайд 63 По данным А.Ф. Капустинского, самое распространенное координационное число
в кристаллических постройках – 6, затем идут числа в
порядке понижения частоты встречаемости – 4, 8, 12, очень редко встречаются 3, 5, 7, 9, 11.В наиболее устойчивых и наиболее распространенных кристаллических решетках преобладают четные координационные числа.
Слайд 64 Согласно классической кристаллохимии координационное число, а следовательно, и
тип решетки, зависят от величины отношения радиуса катиона к
радиусу аниона (Rк/Rа) и направленности связей.
Слайд 66
Поляризация
Поляризация - смещение электронного облака по отношению
к ядру под действием электрического поля соседа (образование диполя)
или деформация электронной оболочки одного атома или иона другим атомом или ионом.Изменение плотности электронного облака приводит к изменению эффективного радиуса иона.
Слайд 67 Когда ион деформирует электронное облако соседа, искажает его,
притягивает к себе и даже сам входит в его
электронное облако, он проявляет активную поляризацию. Ион, который подвергается деформации, относится к пассивным поляризаторам.Слайд 68 Активная поляризация характерна для катионов, пассивная – для
анионов.
Поляризация – энергетическая величина может быть определена количественно.
В рядах или группах (сверху вниз) активная поляризация уменьшается (растет радиус), а пассивная - увеличивается как у катионов, так и у анионов.
.
Слайд 69 Влияние поляризации на структуры кристаллов типа АХ2 (морфотропия)
СO2 - молекулярная решетка
Слайд 70 При соединении катионов с активной поляризацией и анионов
с пассивной поляризацией образуются прочно связанные группы или комплексные
анионы (ионы): [СO3]2-, [SiO4]4-, [WO4]2-, [NbO3]3-, [РО4]3- и др.Слайд 71 Комплексные анионы обычно очень стойкие и не разрушаются
в растворах и расплавах, однако воздействие на катион более
сильно поляризующего катиона может вызвать явление нейтрализации или деполяризацию.Слайд 72 Это ведет к распаду комплексного аниона (и минерала).
Но иногда из деполяризующего иона (катиона) и части прежней
комплексной группы может образоваться новый комплексный анион (уже в составе другого минерала).Такое явление называется контрполяризацией.
Слайд 73 Очень сильными поляризаторы: халькофильные элементы, особенно Сu и
Рb, сульфиды которых образуют комплексные соединения с As2S3, Sb2S3,
Bi2S3, GeS2 и др., и такие минералы, как блеклые руды Cu12As4S13 – Cu12Sb4S13 (теннантит - тетраэдрит), прустит - пираргирит Ag3AsS3 – Ag3SbS3, айкинит PbCuBiS3, галенобисмутит PbBi2S3, джемсонит - буланжерит Pb4As4S14- Pb5Sb4S11 и другие сульфосоли.Слайд 74 Данные радиусов, координационные числа и поляризация определяют основной
закон или первый принцип кристаллохимии, сформулированный В.М. Гольдшмидтом: «Строение кристаллов
определяется количественным соотношением структурных единиц (атомов, ионов), относительными их размерами и поляризационными свойствами».
Слайд 75
Энергия кристаллической решетки
Прочность кристаллической постройки, устойчивость минерала
зависит от энергии.
Из одинакового набора элементов можно построить
несколько структур, которые удовлетворяют требованиям геометрической стабильности, но устойчивым будет то соединение (минерал), для которого запас свободной (работоспособной) внутренней энергии будет минимальным, т.е. энергетически выгодным в данной обстановке. Слайд 76 Энергия, которую надо затратить, чтобы разрушить соединение на
составляющие его структурные единицы и удалить их из сферы
своего действия на бесконечное расстояние, или, иными словами, энергия, которая выделяется при образовании кристаллической постройки из отдельных, изолированных друг от друга атомов или ионов, называется энергией кристаллической решетки.Слайд 77 В 1933 г. А.Ф. Капустинский предложил формулу подсчета
энергии решетки для ионных (бинарных) соединений.
U - энергия
решетки; Σn - количество ионов в молекуле; Wк, Wa - валентности катиона и аниона; Rк, Ra - радиусы катиона и аниона в Å; 256,1 - коэффициент, в котором усреднены значения структурных факторов (константа Моделунга, зависящая от характера расположения атомов или ионов в решетке и постоянная для данного типа решетки).Слайд 78 Эта формула выражает второй основной закон кристаллохимии (2-й
принцип): «Энергия кристалла (U) и свойства, от нее зависящие,
определяются числом ионов (∑n), их радиусами (Rк, Ra) и их валентностями (W), а в ряде случаев - и их поляризационными свойствами».Слайд 79 На основе этой формулы А.Ф. Капустинского А.Е. Ферсман
создал геоэнергетическую теорию и ввел понятия ЕК и VEK
(ЭК и ВЭК).ЕК - это пай энергии, который вносит каждый атом или ион в кристаллическую постройку.
ЕК = W2/2R, a VEK = Е K/W = W2/2R × W = W/2R - валентный энергетический коэффициент.
Слайд 80 Экспериментальный метод подсчета энергии решеток основывается на круговом
процессе Н. Борна – Ф. Габера (термодинамический цикл): учитывается
энергия, которая выделяется при образовании ионного соединения, но не сразу, а в результате ряда последовательных элементарных процессов (кристаллизация, в основном, - процесс экзотермический).Слайд 82 На смену понятию энергии кристаллической решетки пришло понятие
энергия атомизации Еа (по B.C. Урусову), т.е. работа разрыва
химических связей соединения на свободные атомы и анионные группы (как бинарных соединений): альбит Na+ и [AlSi3O8]-, анортит - Са2+ и [Al2Si2O8].Слайд 83 Энергия атомизации слагается из суммы стандартной энтальпии соединения
- ΔH, кДж/моль (справочные величины) и энергии – энтальпии
составляющих минерал свободных атомов – ΔН ат., кДж/моль, а также анионных групп.Кристаллизация минералов из магмы отвечает тенденции понижения энергии атомизации.
Слайд 84
Значение энергии кристаллической решетки
Механическая прочность (твердость) и
растворимость минералов, как установил А.Е. Ферсман, зависят от энергии
кристаллической решетки.Им была дана формула твердости, откуда видно, что твердость у минералов простых ионных структур (типа NaCl) падает с увеличением Ri (радиус иона) и уменьшением ЕК.
Слайд 85 Если взять два минерала форстерит Mg2SiO4 и фаялит
Fe2SiO4, то первым выделится форстерит, так как ЕКмg >
EKFe, UMg2SiO4 > UFe2SiO4 а также температура плавления Mg2SiO4 выше температуры плавления Fe2SiO4 -1460 и 1055°С соответственно.Слайд 86 От энергии решетки (минералов) можно прийти к энергии
процессов, которые всегда направлены в сторону уменьшения свободной энергии
(приращения энтропии системы)Слайд 87 Первый закон (принцип) термодинамики гласит, что в замкнутой
системе сумма всех видов энергии постоянна, при взаимопревращениях энергия
не теряется и не создается вновь.Так, если придать системе тепло (Q), которое увеличит внутреннюю энергию (она может быть принята за энергию кристаллической решетки), то система произведет работу (A): ΔU = Q - А.
Слайд 88 Энергия есть функция энтропии (S) и объема (V):
U = f(S, V).
Система находится в состоянии покоя
или равновесия, когда она не производит работу, и чтобы вывести систему из состояния равновесия, необходимо затратить энергию. Слайд 89 Во всех природных самопроизвольных процессах энтропия (S) стремится
к максимуму (неуклонно растет), а внутренняя (свободная) энергия уменьшается.
В замкнутой системе энтропия возрастает при необратимых процессах и остается постоянной – при обратимых.
Слайд 90 Энтальпия (Н) или полная энергия системы Н =
U + pV, где U - внутренняя энергия, pV
- механическая энергия (р - давление, V - объем): H=f(S, Р).Энтальпия есть функция энтропии и давления. При постоянном давлении и энтропии (состояние термодинамического равновесия) энтальпия системы минимальна.
Слайд 91 Второй принцип или закон термодинамики указывает на направленность
процессов, идущих самопроизвольно и стремящихся к равновесию.
Принцип Ле-Шателье: «Если
на находящуюся в равновесии систему воздействовать извне (изменяя Р, Т, V), то в системе возникают такие процессы, которые будут направлены на то, чтобы нейтрализовать это воздействие».
Слайд 92
Остовно-электронная модель
Любое химическое соединение состоит из положительно
заряженных остовов- атомов и отрицательно заряженных связывающих электронов (электридов).
Атомы-остовы
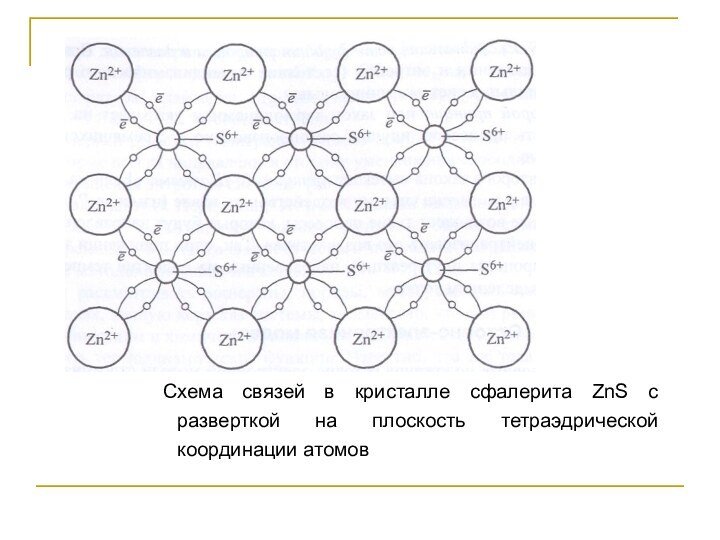
(металлы и неметаллы) располагаются в узлах кристаллической решетки в тетраэдрических и октаэдрических позициях в виде шаров (или по системе координационных полиэдров Полинга), между которыми распределяются связывающие электроны. Слайд 93 Схема связей в кристалле сфалерита ZnS с разверткой
на плоскость тетраэдрической координации атомов
Слайд 95 M и X – атомные остовы, между которыми
находится связующее электронное облако (2e);
roM, roX – ионные
радиусы остовов металла (М) и неметалла (X);R - радиус связывающего электронного облака или электрида;
riM, riX - ионные радиусы металлического (катиона) и неметаллического (аниона) компонентов;
rcM, rcX, их ковалентные радиусы
Слайд 97 Электронный заряд - заряд электрида (q) двухцентровой связи
в соединении путем деления общего числа заключенных между остовами
электронов на координационное число (к.ч.).Пример: в металлическом Mg q (Mg - Mg) = 4e : 12 = 0,33e; в графите q (С - С) = 8e : 3 = 2,6e; в пирите q (Fe - S) = 12e : 6 = 2e и т.д.
Электронный заряд может иметь как целые, так и дробные значения.
Слайд 98 Любая химическая связь есть электронный мостик между положительными
остовами вне зависимости от типа связи.
Определение ионности cвязи
(λ) или полярность, а также эффективных, неноминальных (валентных) зарядов атомов (Q) в гетероатомных структурах проводится по формулам с учетом радиусов (к.ч.), валентности, энергетических величин и др. Слайд 99 В гомоатомных соединениях λ = 0 (симметричное расположение
электронов), в гетероатомных (в основном ионно-ковалентных) λ выражается в
долях единиы (λ ≠ 0), а в структурах с чисто ионными связями λ = 1.Такое разделение происходит в соответствии с энергетическими или силовыми характеристиками (F) этих атомов (заряд, к.ч., радиус, электроотрицательность, ионный потенциал и др.).
Слайд 100 Количественная оценка смещения электронной плотности от менее к
более электроотрицательному атому или определение эффективного заряда Q (распределение
зарядов) проводится в несколько этапов: находится общее число валентных электронов (по сумме положительных зарядов остовов), затем определяются электронные заряды связей (q), потом оцениваются доли электридов, приходящихся на каждый атомный остов по формулам, учитывающим силовые параметры структуры (F), атомные радиусы (r), степень ионности связи (λ).Слайд 101 Алгебраическим суммированием зарядов остова и долей окружающих его
электронов определяется эффективный заряд (Q).
Применительно к минералам зоны
гипергенеза эффективные заряды позволяют судить о реальной степени окисленности или восстановленности минералов, о парагенных ассоциациях, условиях минералообразования и др. Слайд 103 С позиции остовно-электронной модели рассматривается проблема взаимного влияния
катионов (ВВК) в сложных кристаллах.
В общем случае кристаллохимические
параметры соединений (q, λ, Q, к.ч., ЭО, r и др.) будут отличаться от параметров простых слагающих эти соединения – отдельных катионов или комплексных анионов. ВВК рекомендуется учитывать при классификации и систематике минералов.





























