- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Неметаллы, особенности строения
Содержание
- 2. Ответьте на вопросы:Какой химический элемент входит в состав любого органического вещества?УГЛЕРОД
- 3. Элемент, в переводе с греческого «несущий свет»?ФОСФОР
- 4. Какие 2 элемента наиболее распространены в космосе?ВОДОРОД И ГЕЛИЙ
- 5. Вещество, поддерживающее горение и дыхание?КИСЛОРОД
- 6. Самый легкий газ?ВОДОРОД
- 7. Артур Конан Дойль«СОБАКА БАСКЕРВИЛЕЙ»Найдите химическую ошибку:
- 8. Шерлок Холмс: «Фосфор! Странная смесь…Совершенно без запаха. Состав преступления теперь налицо…»
- 9. На воздухе белый фосфор действительно светится в
- 10. Что объединяет все элементы из данного
- 11. Что объединяет все показанные слайды?
- 12. Что такое неметаллы?
- 13. Используя опыт повседневной жизни, школьные знания приведите примеры, связанные с понятием неметаллов.
- 14. Что вы знаете о неметаллах?Запишите в тетрадях
- 15. У атомов неметаллов внешняя
- 16. И стремится к завершению либо
- 17. Если на внешней электронной оболочке 8 электронов это инертный газ.
- 18. У атомов элементов-неметаллов в периоде с увеличением
- 19. У атомов элементов-неметаллов в подгруппе (в длиннопериодной
- 20. Простые вещества. Большинство неметаллов -
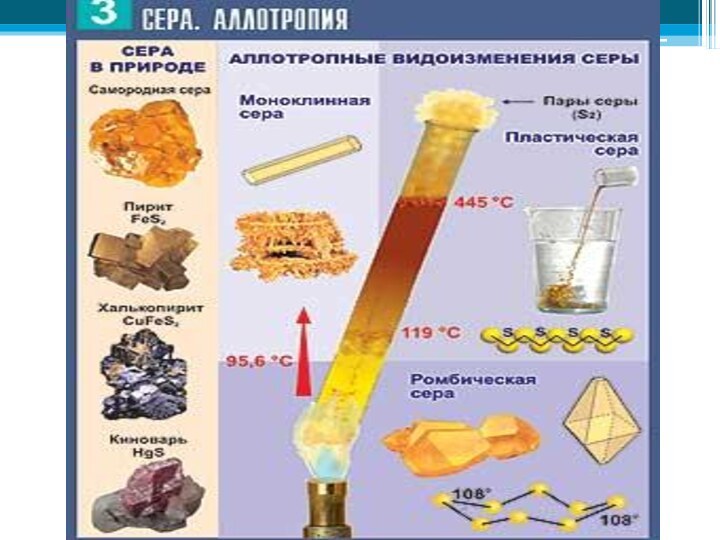
- 21. Неметаллы в природеВ природе встречаются самородные неметаллы
- 22. Кислород — газ без цвета, а озон имеет
- 24. Красный фосфорСераАлмазКислород
- 25. Фосфор в природеАпатит (содержит фосфат кальция)
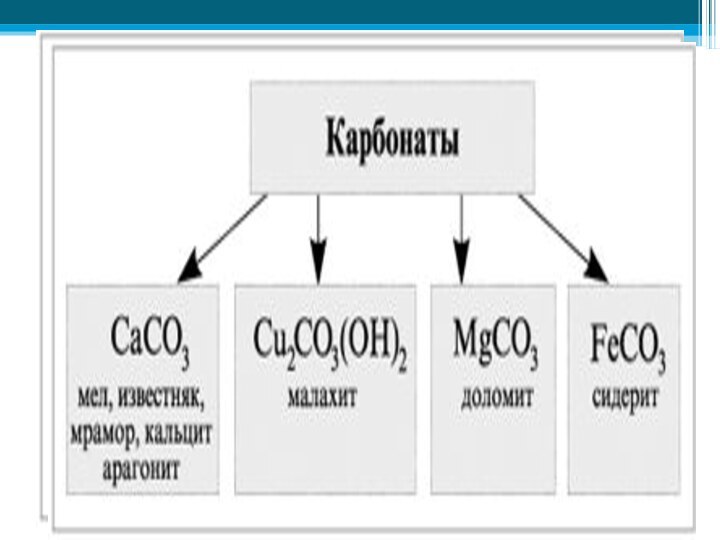
- 26. Карбонаты
- 28. В состав внутренней мантии Земли в основном
- 29. Галогены в природеФтор-F2
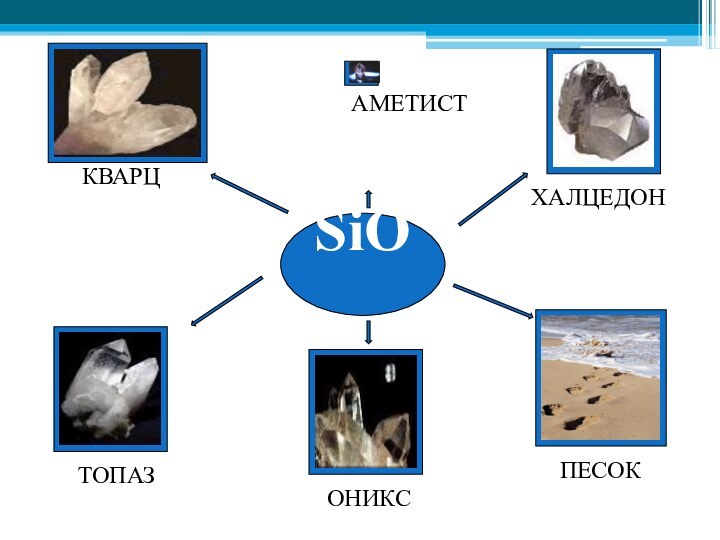
- 30. SiO2
- 31. АллотропияАллотро́пия (от др-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и
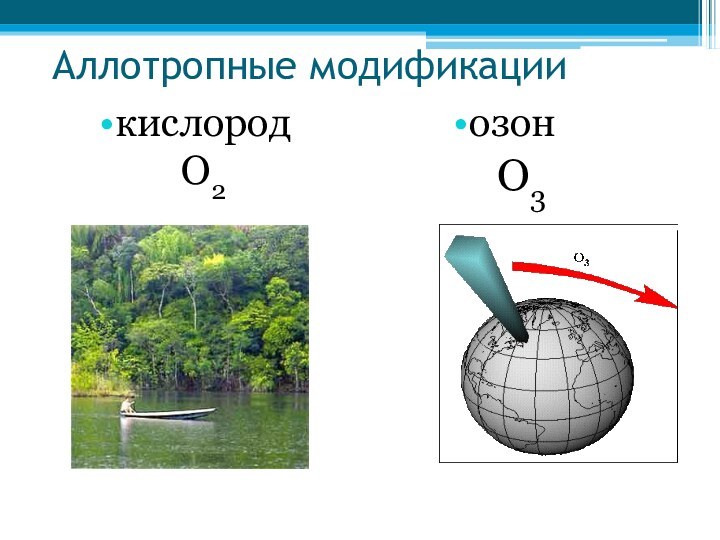
- 32. Аллотропные модификациикислород О2озон О3
- 35. Аллотропные видоизменения фосфораБелый фосфорКрасный фосфор
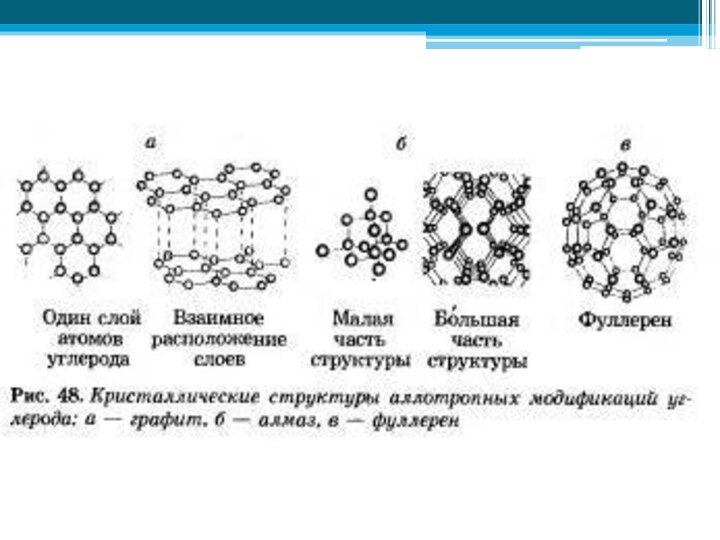
- 36. Аллотропия углеродаалмазграфит
- 37. АЛЛОТРОПИЯ (ответьте на вопросы)Что такое аллотропия?Чем вызвано явление аллотропии?
- 38. Перед вами фотографии различных веществ, найдите среди
- 39. Конфигурация внешнего электронного слоя
- 41. Скачать презентацию
- 42. Похожие презентации
Ответьте на вопросы:Какой химический элемент входит в состав любого органического вещества?УГЛЕРОД
































Слайд 8 Шерлок Холмс: «Фосфор! Странная смесь…Совершенно без запаха. Состав
преступления теперь налицо…»
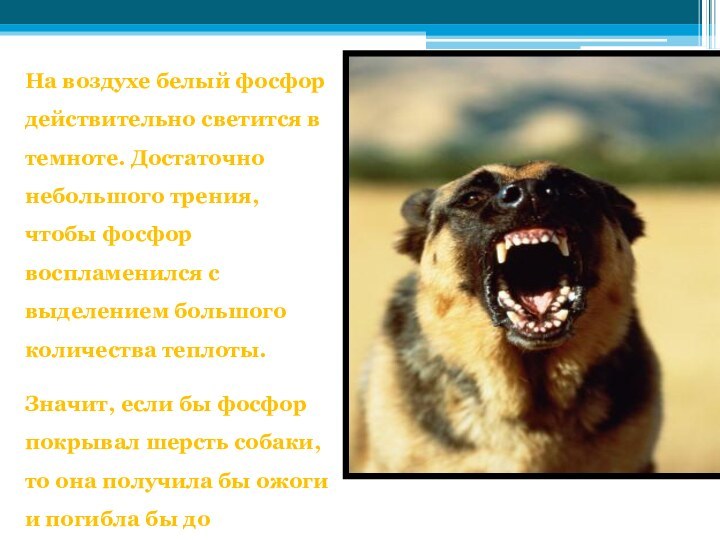
Слайд 9 На воздухе белый фосфор действительно светится в темноте.
Достаточно небольшого трения, чтобы фосфор воспламенился с выделением большого
количества теплоты.Значит, если бы фосфор покрывал шерсть собаки, то она получила бы ожоги и погибла бы до нападения на человека
Слайд 13 Используя опыт повседневной жизни, школьные знания приведите примеры,
связанные с понятием неметаллов.
Слайд 14
Что вы знаете о неметаллах?
Запишите в тетрадях вопросы,
которые вы хотите узнать о неметаллах, используя:
А) «тонкие» вопросы
(где, кто, что, когда, как);Б) «толстые» вопросы (зачем , почему)
Слайд 15
У атомов неметаллов внешняя электронная
оболочка содержит много ( от 4 до 7) электронов(
исключение атом гелия, у которого 2 электрона)
Слайд 16
И стремится к завершению либо путем
принятия недостающих электронов (тогда неметалл - окислитель) , либо
путем отдачи электронов ( тогда неметалл - восстановитель).Слайд 18 У атомов элементов-неметаллов в периоде с увеличением порядкового
номера
заряд ядра увеличивается;
радиусы атомов уменьшаются;
число электронов на
внешнем слое увеличивается;число валентных электронов увеличивается;
электроотрицательность увеличивается;
окислительные (неметаллические) свойства усиливаются (кроме элементов VIIIA группы).
Слайд 19 У атомов элементов-неметаллов в подгруппе (в длиннопериодной таблице
- в группе) с увеличением порядкового номера
заряд ядра увеличивается;
радиус
атома увеличивается;электроотрицательность уменьшается;
число валентных электронов не изменяется;
число внешних электронов не изменяется (за исключением водорода и гелия);
окислительные (неметаллические) свойства ослабевают (кроме элементов VIIIA группы).
Слайд 20
Простые вещества.
Большинство неметаллов - простые
вещества, в которых атомы связаны ковалентными связями; в благородных
газах химических связей нет. Среди неметаллов есть как молекулярные, так и немолекулярные вещества. Все это приводит к тому, что физических свойств, характерных для всех неметаллов, нет.
Слайд 21
Неметаллы в природе
В природе встречаются самородные неметаллы N2
и O2 (в воздухе), сера (в земной коре), но
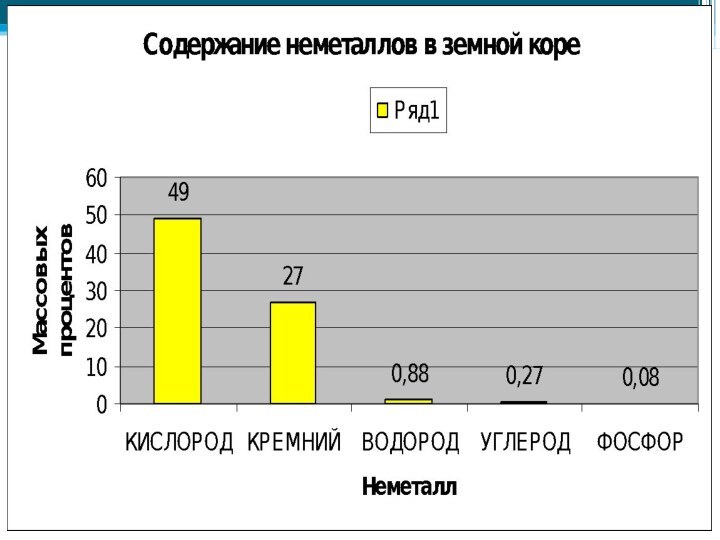
чаще неметаллы в природе находятся в химически связанном виде. В первую очередь это вода и растворённые в ней соли, затем минералы и горные породы (например различные силикаты, алюмосиликаты, фосфаты, бораты, сульфаты и карбонаты).По распространенности в земной коре неметаллы занимают самые различные места: от трех самых распространенных элементов (O, Si, H) до весьма редких (As, Se, I, Te).
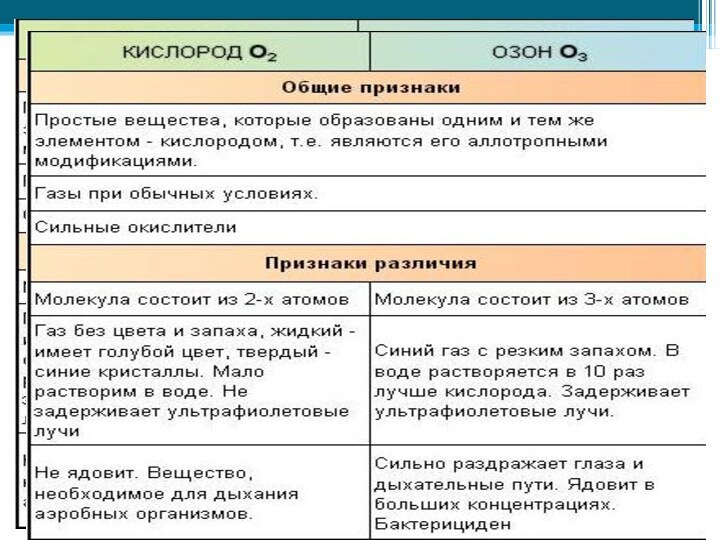
Слайд 22 Кислород — газ без цвета, а озон имеет бледно-фиолетовый
цвет. Озон более бактерициден (лат. ицдао — «убивать»), чем
кислород. Поэтому озон применяется для обеззараживания питье вой воды. Озон способен удерживать ультрафиолетовые лучи солнечного спектра, которые губительны для всего живого на Земле, и потому озоновый экран, который располагается в атмосфер на высот» 20—35 км, защищает жизнь на нашей планетеКислород
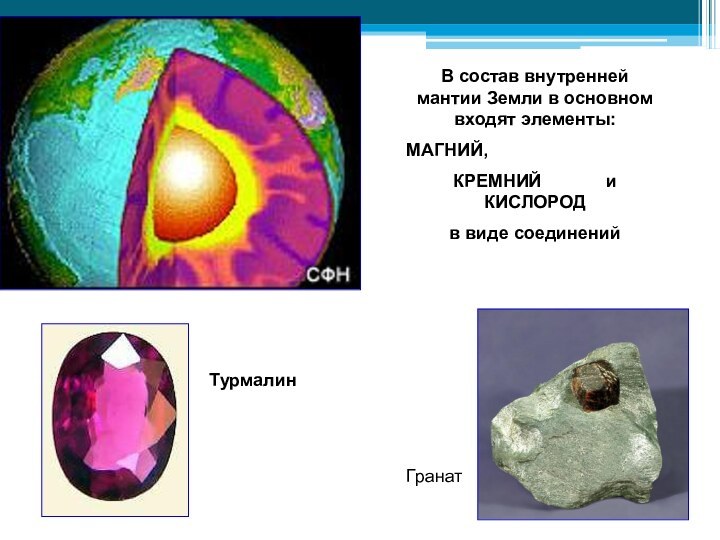
Слайд 28 В состав внутренней мантии Земли в основном входят
элементы:
МАГНИЙ,
КРЕМНИЙ и КИСЛОРОД
в виде соединений
Турмалин
Гранат
Слайд 29
Галогены в природе
Фтор-F2
Флюорит -CaF2
Бром-Br2
в аналогичных
соединениях, вместе с хлором Хлор-Cl2 каменная соль- NaCl
сильвинит –NaCl*KCl
Иод-J2
морская вода , водоросли, буровые воды
Кристаллы хлорида натрия – минерал галит
Слайд 31
Аллотропия
Аллотро́пия (от др-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и того
же химического элемента в виде двух и более простых веществ, различных по
строению и свойствам: так называемых аллотропических модификаций или аллотропических форм.Слайд 38 Перед вами фотографии различных веществ, найдите среди них
неметаллы, попробуйте догадаться о каком неметалле идет речь, объясните
ваш выбор.1
2
3
4
5
6
7
8
9





























