- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
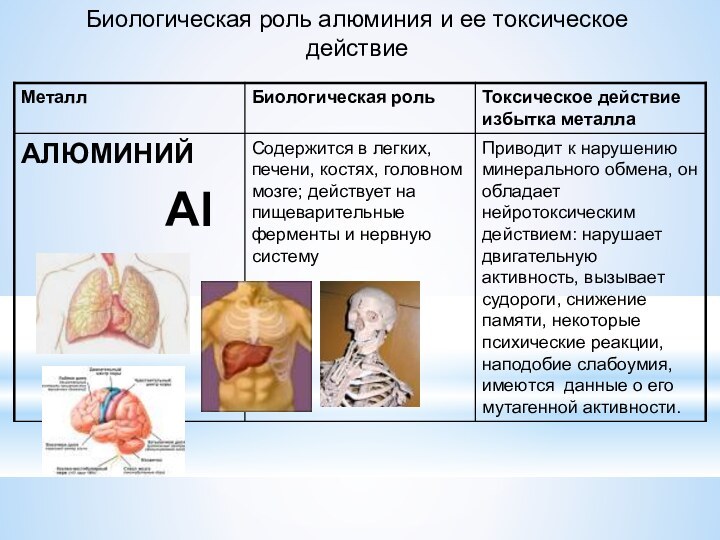
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему
Содержание
- 2. СОДЕРЖАНИЕУченые, получившие алюминийХарактеристика элемента - алюминияНахождение в природеФизические свойстваХимические свойстваПрименениеСоединения алюминия и их свойстваВопросы для проверки
- 3. ALЭлемент III(A)группы таблицы Д.И. МенделееваЭлемент с порядковым
- 4. Датский физик Ганс Эрстед(1777-1851) Впервые алюминий был
- 5. Современноеполучение алюминияСовременные метод получения был разработан независимо
- 6. Будучи студентом Оберлинского колледжа, он узнал, что
- 7. Поль Эру (1863-1914) –французский инженер - химикВ
- 8. Нахождение в природеВажнейшим на сегодня минералом алюминия
- 9. Физические свойства мягкийлегкий (с малой плотностью –
- 10. с серой, образуя сульфид алюминия:
- 11. Химические свойства1. с водой (после удаления защитной
- 12. ПРИМЕНЕНИЕ АЛЮМИНИЯЛегкий сплав дюраль используетсяв различных областяхВ АвиацииВ Космической техникеВ ЭлектротехникеВ СудостроенииВ СтроительствеВ АвтотранспортеВ быту
- 13. Соединения алюминияОксид алюминия (AL2O3)Гидроксид алюминияAL(OH)3
- 14. Химические свойства оксида алюминияАмфотерный оксидРеагирует с кислотамиРеагирует с щелочамиAL2O3 + 6HCL=2ALCL3 + 3H2OAL2O3+ 2NaOH +3H2O=2Na[AL(OH)4]
- 15. AL2O3ГлинозёмКорундсапфиррубинБоксит
- 16. Применение сапфировзнаменитые сапфиры английской королевской семьи
- 17. Применение рубинов
- 18. Химические свойства гидроксида алюминияАмфотерныйРеагирует с кислотамиРеагирует с
- 19. Соли алюминияРастворимые в водеНерастворимые в водеПри реакции
- 20. Скачать презентацию
- 21. Похожие презентации












![Презентация Химические свойства оксида алюминияАмфотерный оксидРеагирует с кислотамиРеагирует с щелочамиAL2O3 + 6HCL=2ALCL3 + 3H2OAL2O3+ 2NaOH +3H2O=2Na[AL(OH)4]](/img/tmb/11/1098225/6c9d3f137951154425eb0f65902a3586-720x.jpg)





Слайд 2
СОДЕРЖАНИЕ
Ученые, получившие алюминий
Характеристика элемента - алюминия
Нахождение в природе
Физические
свойства
Слайд 3
AL
Элемент III(A)
группы таблицы
Д.И. Менделеева
Элемент
с порядковым
№
13, его
Элемент 3 -его
периода
Третий по
распространенности в земной кореназвание
образовано от лат. «Aluminis» – квасцы
Слайд 4
Датский физик
Ганс Эрстед
(1777-1851)
Впервые алюминий был получен
им
в 1825 году действием амальгамы калия
на хлорид
алюминия с последующей отгонкой ртути.
Слайд 5
Современное
получение алюминия
Современные метод получения был разработан независимо друг
от друга: американцем Чарльзом Холлом и французом Полем Эру
в 1886 году.Он заключается в растворении оксида алюминия в расплаве криолита с последующим электролизом с использованием расходуемых коксовых или графитовых электродов.
Слайд 6
Будучи студентом Оберлинского колледжа,
он узнал, что
можно разбогатеть и получить благодарность человечества,
если изобрести способ получения
алюминия в промышленных масштабах.
Как одержимый, Чарльз проводил эксперименты
по выработке алюминия путем
электролиза криолитно-глиноземного
расплава.
23 февраля 1886 года спустя год
после окончания колледжа Чарльз получил с помощью электролиза первый алюминий.
Холл Чарльз
(1863 – 1914) американский инженер-химик
Слайд 7
Поль Эру (1863-1914) –
французский
инженер - химик
В 1889
году открыл алюминиевый завод во Фроне (Франция), став его
директором, он сконструировал электродуговую печь для выплавки стали, названную его именем; он разработал также электролитический способ получения алюминиевых сплавов
Слайд 8
Нахождение в природе
Важнейшим на сегодня минералом алюминия является
боксит
Основной химический компонент боксита - глинозем (Al2O3)
(28 -
80%).
Слайд 9
Физические свойства
мягкий
легкий (с малой плотностью – 2,7
г/см3)
с высокой тепло- и электропроводностью
легкоплавкий (температура плавления 660°C)
серебристо-белый
с характерным металлическим блескомЗанимает 1-е место в земной коре среди металлов
Совокупность этих важных свойств позволяет отнести алюминий к числу важнейших технических материалов
Э Т О В А Ж Н О :
Слайд 10
с серой, образуя сульфид алюминия:
2Al
+ 3S = Al2S3
с азотом, образуя
нитрид алюминия: 2Al + N2 = 2AlN
с углеродом, образуя карбид алюминия:
4Al + 3С = Al4С3
с хлором, образуя хлорид алюминия:
2Al + 3Cl2 = 2AlCl3
Химические свойства
с кислородом, образуя оксид алюминия:
4Al + 3O2 = 2Al2O3
Взаимодействие с простыми веществами:
Слайд 11
Химические свойства
1. с водой (после удаления защитной оксидной
пленки)
2Al + 6H2O = 2Al(OH)3 + 3H2
2. с растворами щелочей (с образованием тетрагидроксоалюмината)
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
3. c соляной и разбавленной серной кислотами:
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2
4. с оксидами менее активных металлов (алюминотермия)
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
2Al + Cr2O3 = Al2O3 + 2Cr
Взаимодействие со сложными веществами:
Слайд 12
ПРИМЕНЕНИЕ
АЛЮМИНИЯ
Легкий сплав дюраль используется
в различных областях
В Авиации
В
Космической технике
В Электротехнике
В Судостроении
В Строительстве
В Автотранспорте
В быту
Слайд 14
Химические свойства оксида алюминия
Амфотерный оксид
Реагирует с кислотами
Реагирует с
щелочами
AL2O3 + 6HCL=2ALCL3 + 3H2O
AL2O3+ 2NaOH +3H2O=2Na[AL(OH)4]
Слайд 18
Химические свойства
гидроксида алюминия
Амфотерный
Реагирует с кислотами
Реагирует с щелочами
AL(OH)3
+ 3HCL = ALCL3+ 3H2O
AL(OH)3 + NaOH = Nа[AL(OH)4
]Разлагается при
нагревании
2AL(OH)3 = AL2О3+ 3H2O





























