- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему РОЗЧИННИК
Содержание
- 2. Розчини - однорідна багатокомпонентна система, що складається
- 4. Процес взаємодії розчинника і розчиненої речовини називається
- 6. Розчинністю - називається здатність речовини розчинятися в
- 8. Чинники, що впливають на розчинність
- 9. Концентрація розчинівМасова частка розчиненої речовини - це
- 10. Дисперсні системи – це системи, в яких
- 11. Суспензії - це дисперсні системи, в яких
- 12. Емульсії - це дисперсні
- 13. Колоїдні розчини - це високодисперсні двофазні системи,
- 15. Для осадження золю необхідно, щоб його частинки
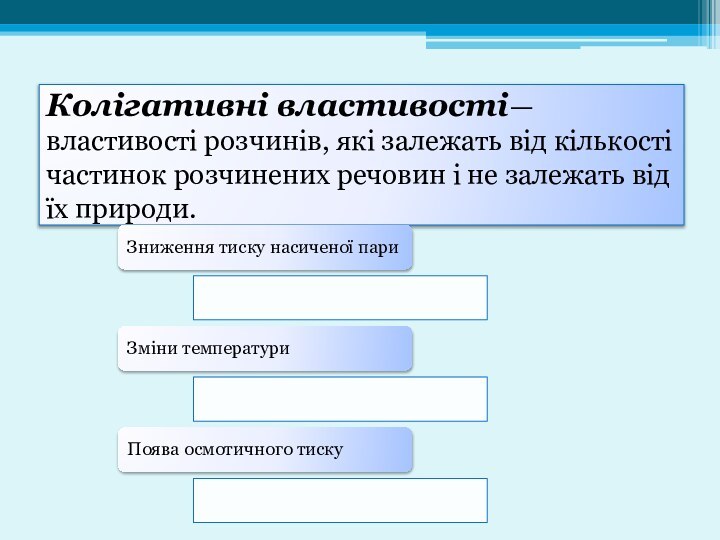
- 16. Колігативні властивості— властивості розчинів, які залежать від
- 17. Зниження тиску насиченої пари розчину описується законом
- 18. Щоб кількісно оцінити збільшення температури кипіння і
- 19. Осмос— це спонтанний перехід чистого розчинника у
- 20. Причини застосування розчинів
- 21. Скачать презентацию
- 22. Похожие презентации
Розчини - однорідна багатокомпонентна система, що складається з розчинника, розчинених речовин і продуктів їх взаємодії. Розчини - це молекулярні суміші, які за агрегатним станом можуть бути рідкими - морська вода, газоподібними – повітря ,або твердими -


















Слайд 2 Розчини - однорідна багатокомпонентна система, що складається з
розчинника, розчинених речовин і продуктів їх взаємодії.
це молекулярні суміші, які за агрегатним станом можуть бути рідкими - морська вода, газоподібними – повітря ,або твердими - багато сплавів металів.
Слайд 4
Процес взаємодії розчинника і розчиненої речовини називається сольватацією,
якщо розчинником є вода - гідратацією.
Процес розчинення внаслідок
взаємодій компонентів супроводжується різними тепловими явищами.
Слайд 6
Розчинністю - називається здатність речовини розчинятися в тому
чи іншому розчиннику.
Розчинність залежить від природи речовини і
розчинника,температури і тиску.
Слайд 9
Концентрація розчинів
Масова частка розчиненої речовини - це безрозмірна
величина,що дорівнює відношенню маси розчиненої речовини до загальної маси
розчину.Молярна концентрація показує, скільки моль розчиненої речовини міститься в 1 літрі розчину.
Слайд 10 Дисперсні системи – це системи, в яких одна
речовина рівномірно розподілено у вигляді частинок всередині іншої речовини.
До
дисперсних систем відносяться звичайні (справжні) розчини, колоїдні розчини, а також суспензії та емульсії.Слайд 11 Суспензії - це дисперсні системи, в яких дисперсної
фазою є тверда речовина, а дисперсним середовищем – рідина.
Слайд 12 Емульсії - це дисперсні системи, в яких і
дисперсна фаза і дисперсне середовище є рідинами, взаємно не
змішуються. Прикладом емульсії є молоко, в якому дрібні кульки жиру плавають у рідині.
Слайд 13
Колоїдні розчини - це високодисперсні двофазні системи, що
складаються з дисперсійного середовища і дисперсної фази, причому лінійні
розміри частинок останньої лежать в межах від 1 до 100 нм.Колоїдні розчини інакше називають золями.
Слайд 15 Для осадження золю необхідно, щоб його частинки з'єдналися
в більш великі агрегати. З'єднання часток в більш великі
агрегати називається коагуляцією, а осадження їх під впливом сили тяжіння - седиментацією.Значення золів виключно велике, тому що вони більш поширені, ніж істинні розчини: протоплазма живих клітин, кров, соки рослин.





























