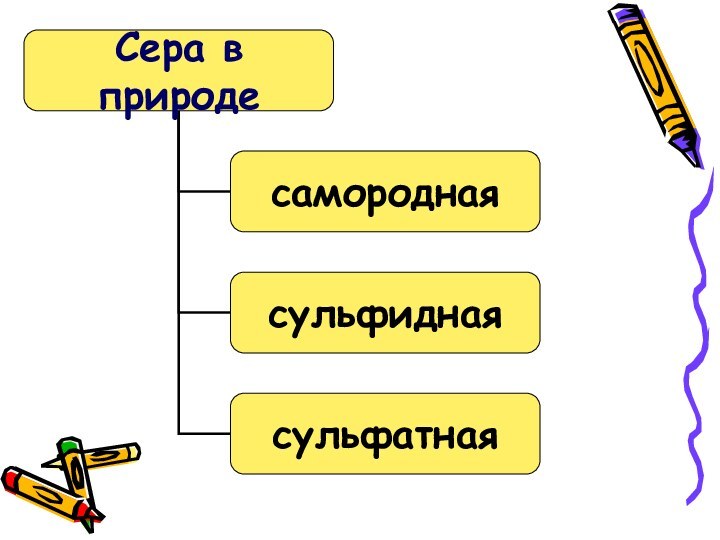
и сульфиды
Оксиды серы
Оксид серы (Оксид серы (IV)
Оксид серы (Оксид
серы (VI)Сернистая кислота
Серная кислота
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть


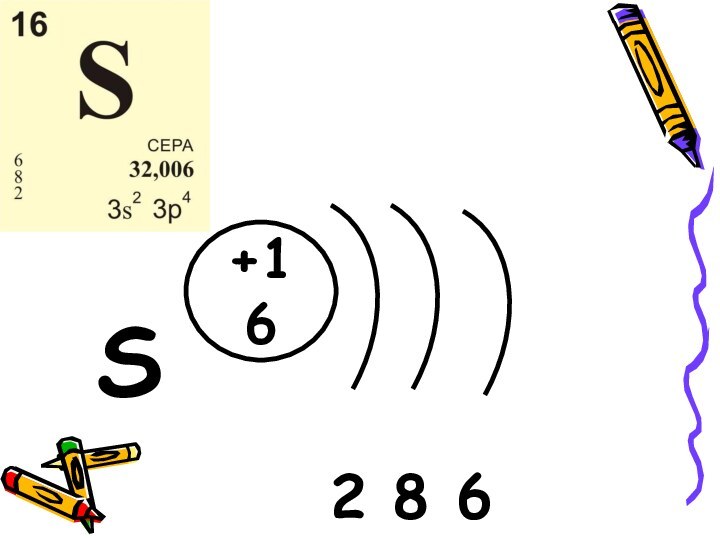



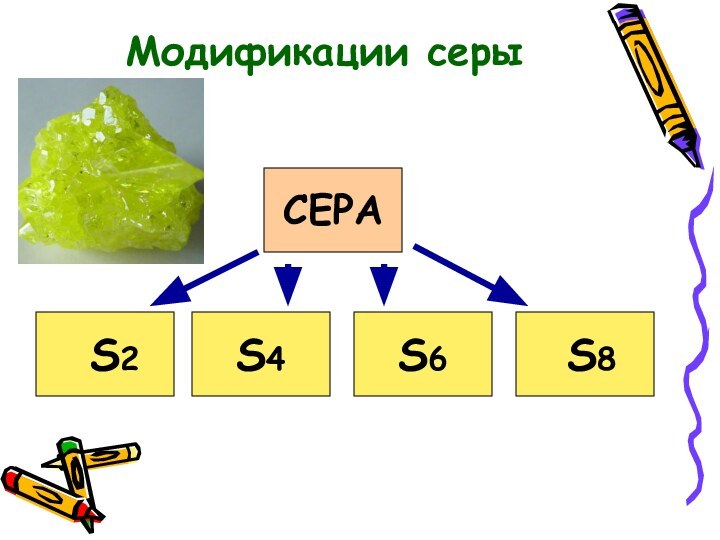
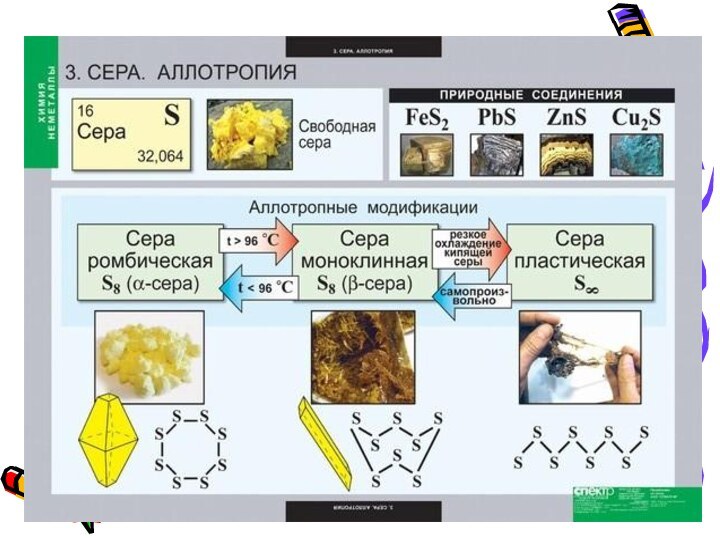











Аллотропные модификации серы.
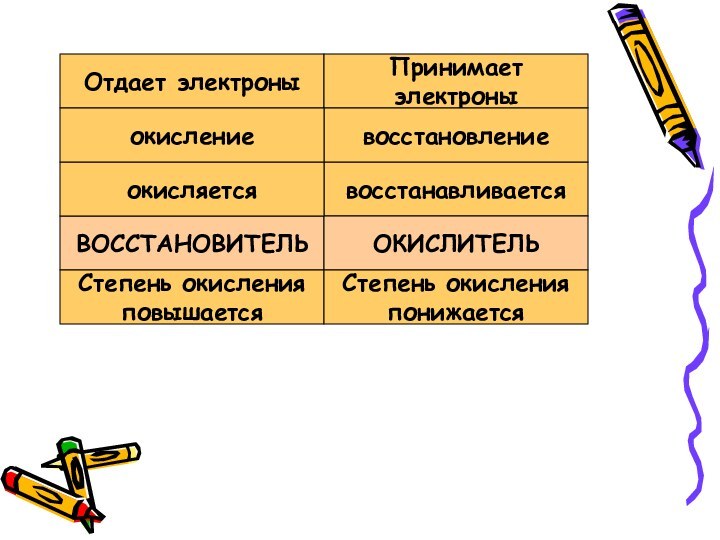
Химические свойства
Химические свойства