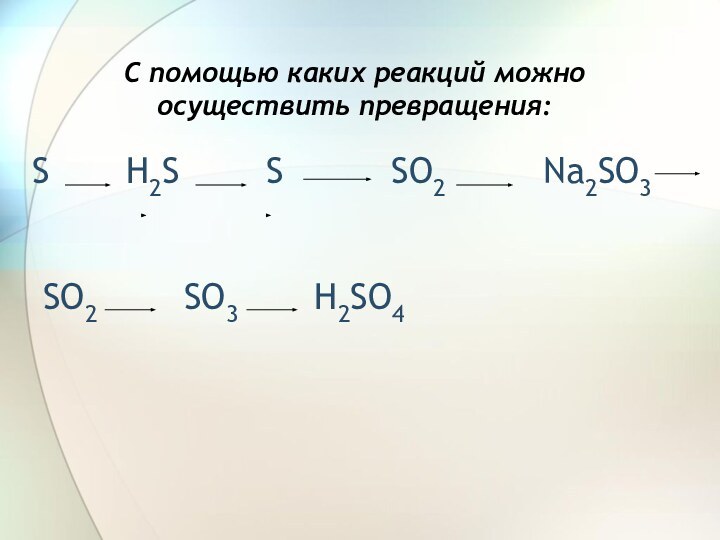
H2S S
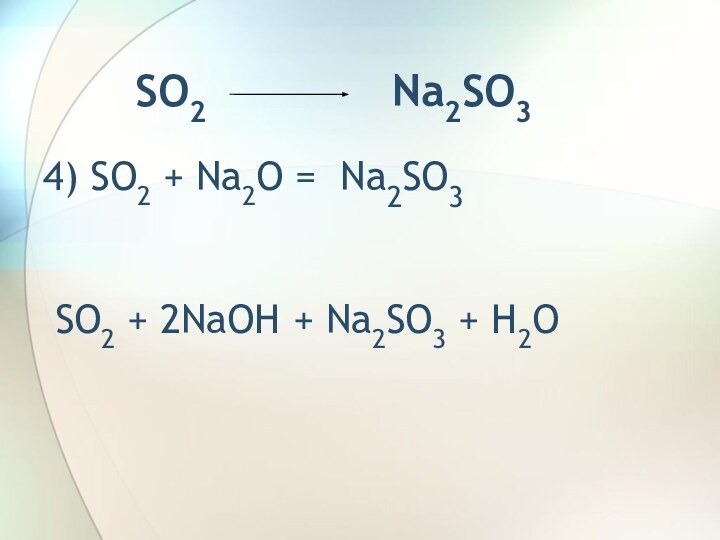
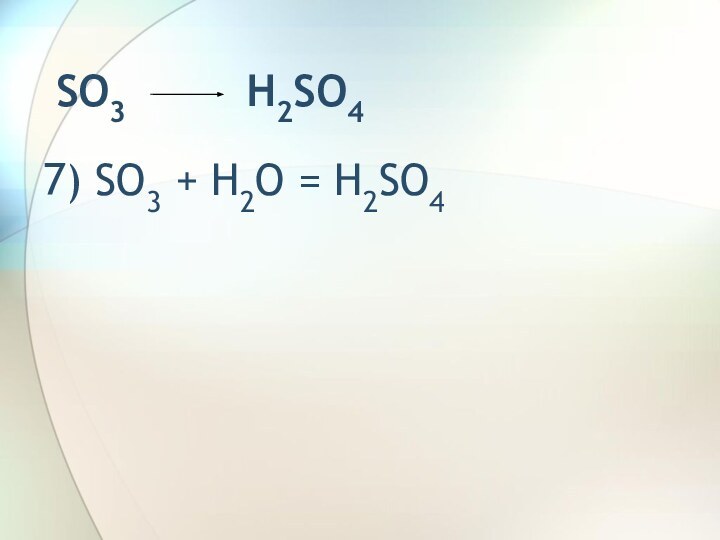
SO2 Na2SO3SO2 SO3 H2SO4
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть

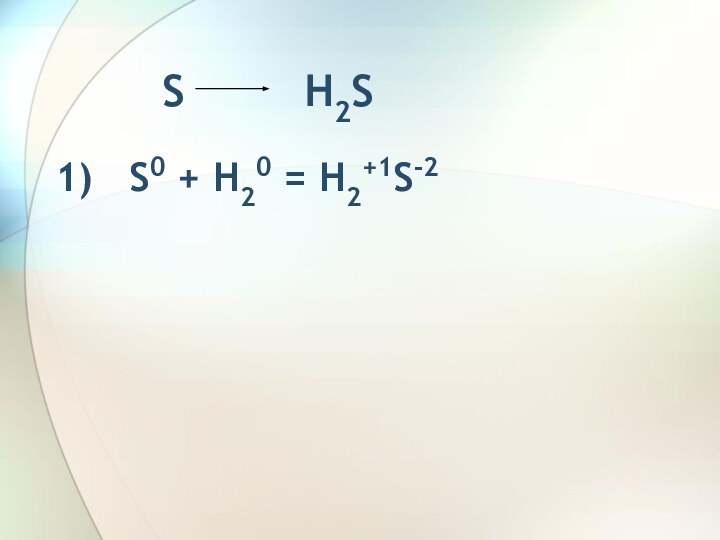
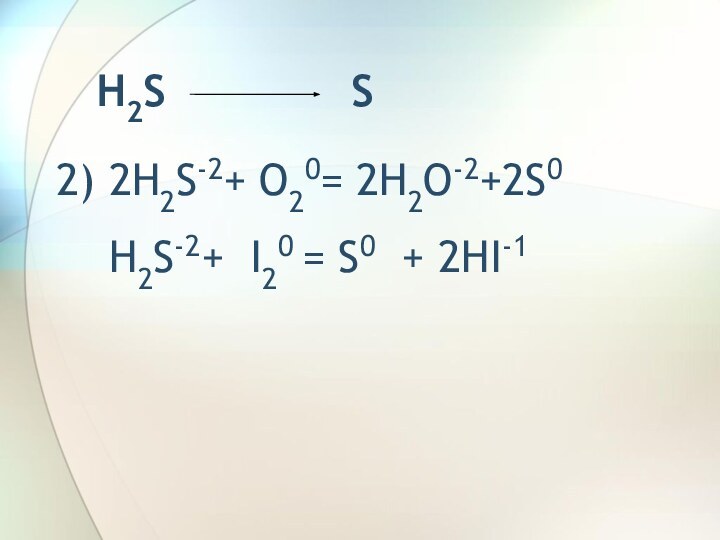
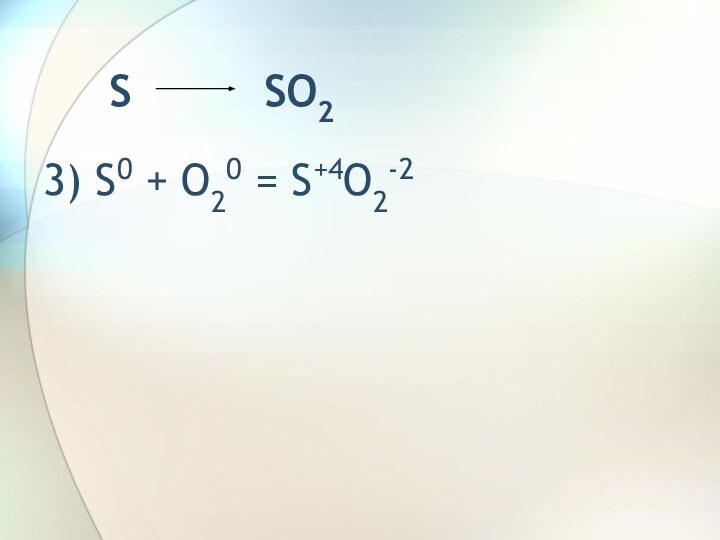
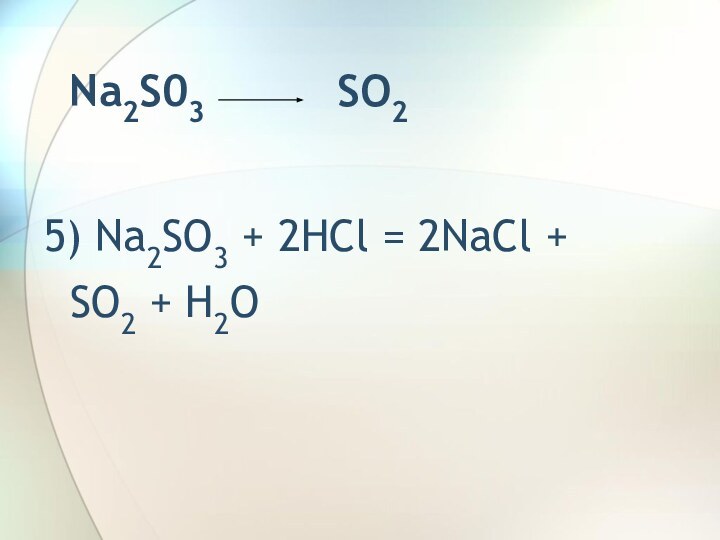
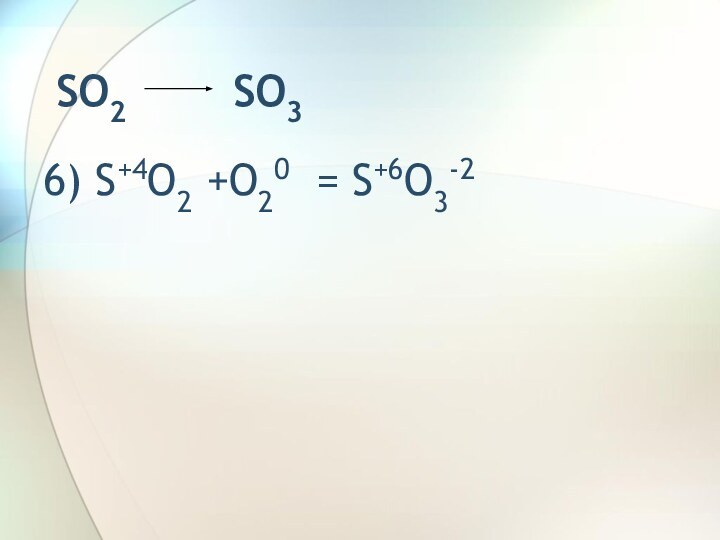












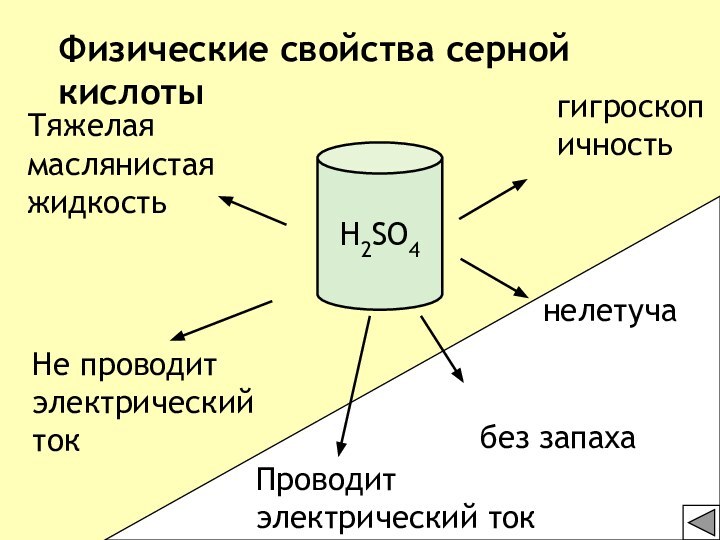









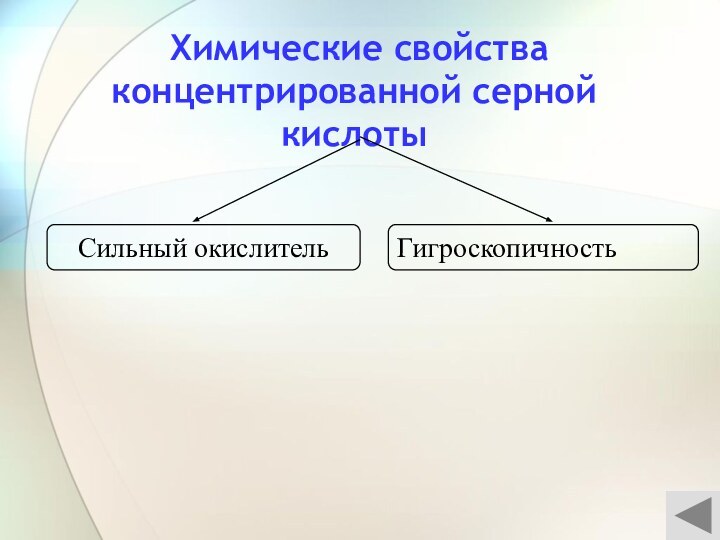


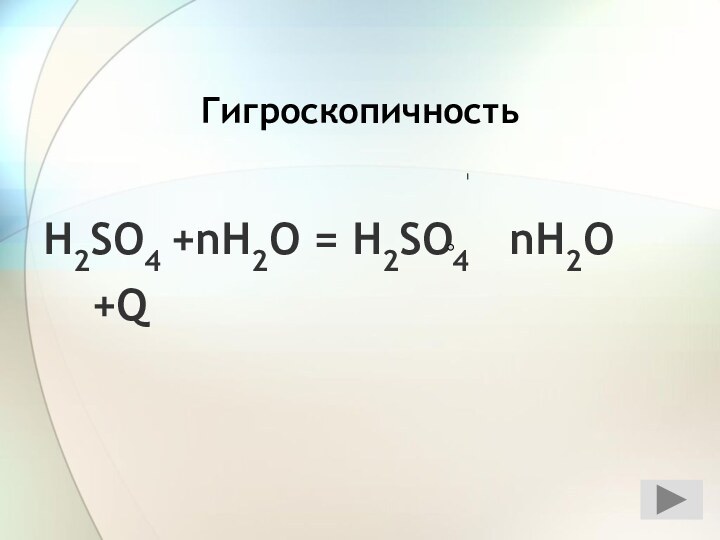

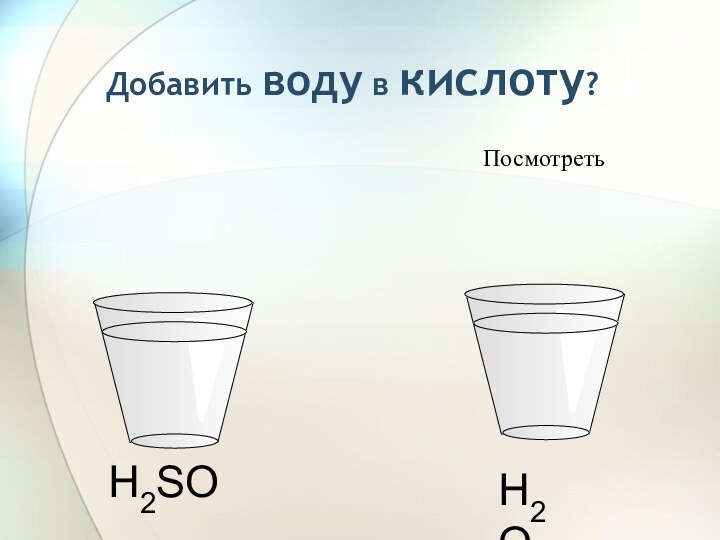
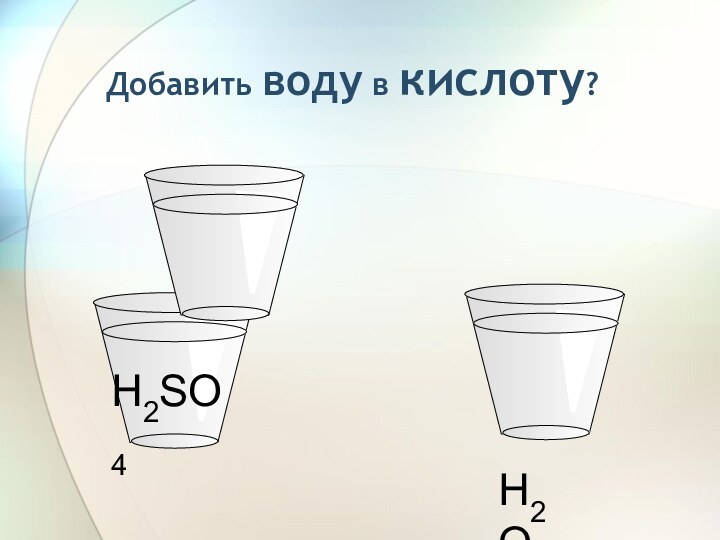









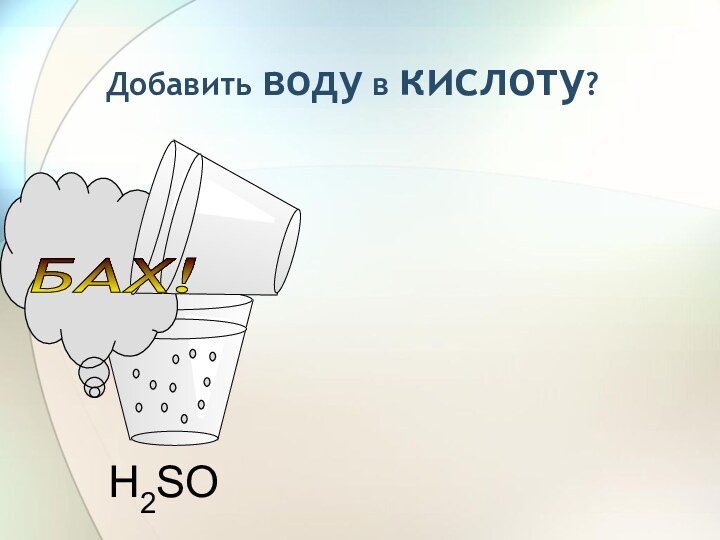
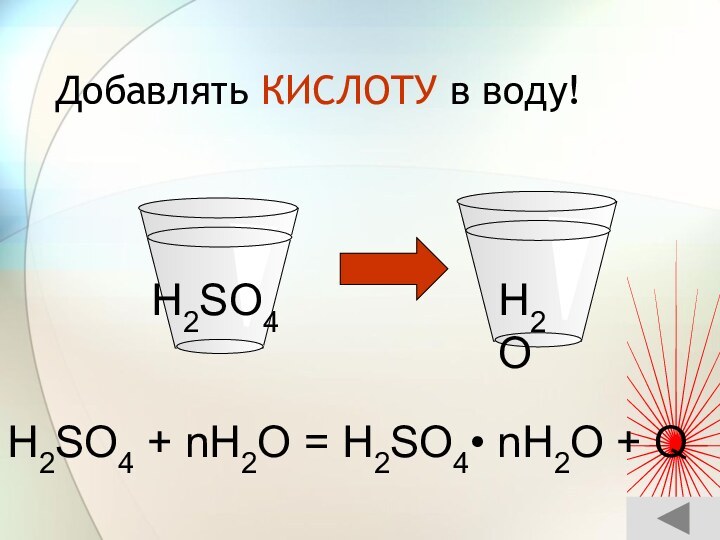
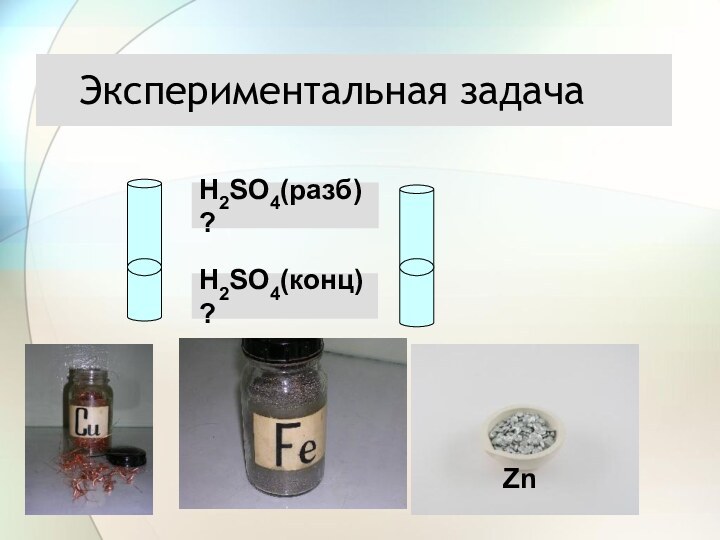




3) С растворами солей
( качественная реакция)
4)С металлами ,стоящими в ряду активности до водорода ( исключение- свинец)
Взаимодействие разбавленной серной кислоты с металлами
ОКИСЛИТЕЛЬ – S+6O4