- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Сульфатна кислота
Содержание
- 2. Сульфатна кислота (Застаріла назва — купоросне масло)
- 3. Вільна сірчана кислота зустрічається в природі дуже
- 4. Сировиною для виробництва сірчаної кислоти є елементарна
- 5. Дисоціація у водному розчині йде в декілька
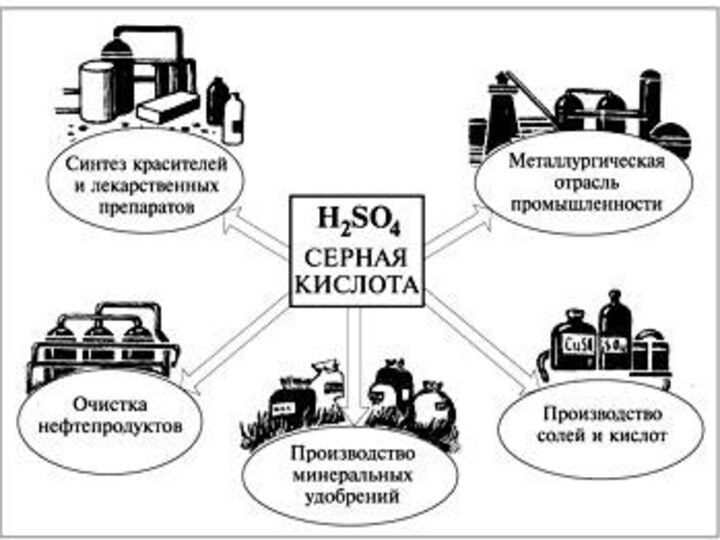
- 6. Сірчана кислота є дуже важливим товаром хімічної
- 8. Сірчана кислота дуже їдка. Окрім звичайних властивостей
- 9. Скачать презентацию
- 10. Похожие презентации








Слайд 3 Вільна сірчана кислота зустрічається в природі дуже рідко.
В атмосфері вона утворюється з діоксиду сірки, який утворюється
при згоранні сірковмісних речовин або вулканічних вивержень. Діоксид сірки окислюється гідроксильними радикалами та киснем з утворенням триоксиду сірки, який вступаючи в реакцію з атмосферною вологою утворює кислоту. У кислотних дощах вона виступає в розбавленому виді. Невелику кількість вільної сірчаної кислоти також можна знайти в деяких вулканічних джерелах, які називаються сольфатари. Найбільшу кількість сірчаної кислоти у світі містить озеро в кратері вулкана Іджен в Індонезії. На відміну від вільної кислоти, її солі, зокрема, сульфати, зустрічається в природі набагато частіше. Існує багато різних мінералів сульфатів. Серед них найвідомішими й найважливішими є гіпс (CaSO4 · 2 H2O), барит (BaSO4), Халькантит (CuSO4 · 5 H2O) і глауберова сіль (Na2SO4 · 10 H2O).Слайд 4 Сировиною для виробництва сірчаної кислоти є елементарна сірка
яку отримують в величезних кільскостях на нафто- та газовопереробних
заводах, з сірководню, за допомогою процесу, який відомий як процес Клауса.Потім сірку оксилюють до діоксиду сірки:Реакція сірки з киснем
Ще одним джерелом діоксиду сірки є виплавлення руд, що містять сірку. Прикладами є мідні, цинкові і свинцові сульфіди. Діоксид сірки утворюється при випаленні з киснем повітря.
Реакція під час випалу сульфіду цинку
У 1999 році в Європі було випалено близько 3 млн. тонн піриту для виробництва сульфатноъ кислоти. В Азії ця цифра більша,оскільки і запаси його більші.[4] Для бідних ресурсами країнах, які не мають ні сірки, ні сульфідних руд, існує процес Мюллера-Кюне. В цьому процесі діоксид сірки утворюється при випаленні гіпсу і вугілля в печі. Цей процес можна зробити прибутковішим, якщо в піч додавати пісок і глину для утворення цементу як побічного продукту.Для подальшого виробництва потребується сірчаний ангідрид. Прямої реакції діоксиду сірки і кисню в триоксид сірки не існує, так як рівновага лежить на стороні триоксида сірки. Тому для проведення цієї реакції потрібні каталізатори.
Окиснення діоксиду сірки до триоксиду
Триоксид сірки не розбавляється у воді відразу ж. Спочатку його вводять у концентровану сірчану кислоту,цей розчин називають - олеумом. Потім олеум розчиняють у воді до утворення сірчаної кислоти.
Розчинення сірчаного ангідриту в концентрованій сірчаній кислоті з утворення дисульфатної кислоти
Розчинення дисульфатної кислоти у воді
В останні роки виробництво сірчаної кислоти зросло в основному в Китаї, у той час як в європейських країнах, виробництво скоротилося.