Слайд 2
СТРОЕНИЕ И СВОЙСТВА АТОМОВ
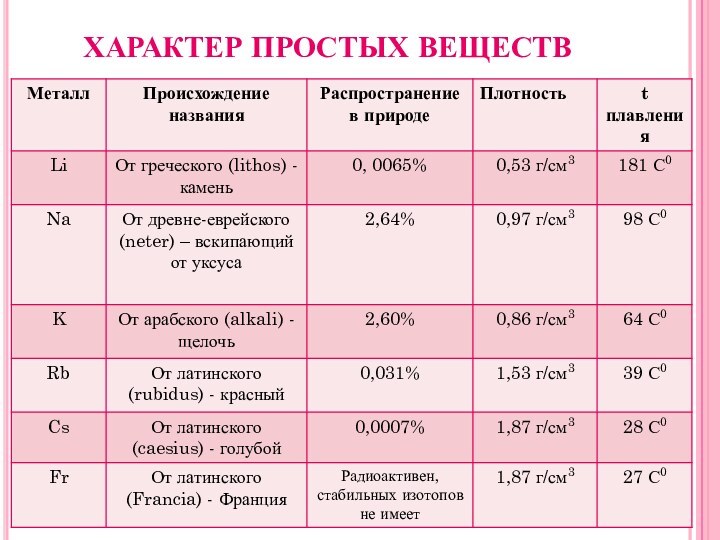
Щелочные металлы – это элементы
главной подгруппы I группы Периодической системы химических элементов Д.И.
Менделеева: литий(Li), натрий(Na), калий(K), рубидий(Rb), цезий(Cs), франций(Fr).
На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются сильными восстановителями. Во всех соединениях щелочные металлы проявляют степень окисления +1.
Слайд 3
ЭЛЕКТРОННО-ГРАФИЧЕСКАЯ ФОРМУЛА ЛИТИЯ
Li
+3
2
1
1s2
1s2
2s1
ЭГФ:
2s1
Слайд 4
ЭЛЕКТРОННО-ГРАФИЧЕСКАЯ ФОРМУЛА НАТРИЯ
Na
+11
2
8
1
ЭГФ:
1s2
1s2
2s2
2s2
2p6
2p6
3s1
3s1
Слайд 5
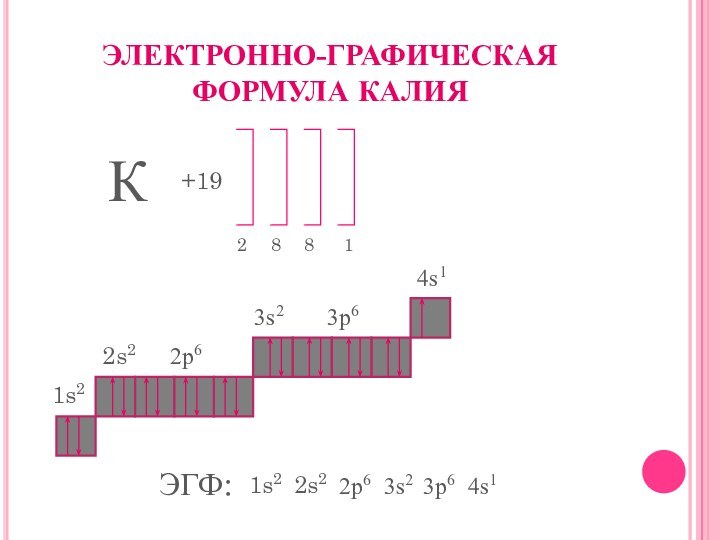
ЭЛЕКТРОННО-ГРАФИЧЕСКАЯ ФОРМУЛА КАЛИЯ
К
+19
2
8
8
1
1s2
2s2
2p6
3s2
3p6
4s1
ЭГФ:
1s2
2s2
2p6
3s2
3p6
4s1
Слайд 7
ЛИТИЙ
Литий был открыт в 1817 году шведским химиком
и минералогом А. Арфведсоном сначала в минерале петалите, а
затем в сподумене и в лепидолите. Металлический литий впервые получил Хамфри Дэви в 1825 году.
Слайд 8
НАТРИЙ
Натрий впервые был получен английским химиком Хемфри Дэви
в 1807 году электролизом твердого NaOH.
Слайд 9
КАЛИЙ
В 1807 году английский химик Дэви электролизом твёрдого
едкого кали (KOH) выделил калий и назвал его «потассий».
В 1809 году Л. В. Гильберт предложил название «калий».
Слайд 10
РУБИДИЙ
В 1861 году немецкие учёные Роберт Вильгельм Бунзен
и Густав Роберт Кирхгоф, изучая с помощью спектрального анализа
природные алюмосиликаты, обнаружили в них новый элемент, впоследствии названный рубидием по цвету наиболее сильных линий спектра.
Слайд 11
ЦЕЗИЙ
Цезий был открыт в 1860 году немецкими учёными
Р. В. Бунзеном и Г. Р. Кирхгофом в водах Дюрхгеймского минерального
источника в Германии методом оптической спектроскопии, тем самым, став первым элементом, открытым при помощи спектрального анализа. В чистом виде цезий впервые был выделен в 1882 году шведским химиком К. Сеттербергом при электролизе расплава смеси цианида цезия (CsCN) и бария.
Слайд 12
ФРАНЦИЙ
Этот элемент был предсказан Д. И. Менделеевым (как
Эка-цезий), и был открыт (по его радиоактивности) в 1939
г. Маргаритой Перей, сотрудницей Института радия в Париже. Она же дала ему в 1964 г. название в честь своей родины — Франции.
Слайд 13
ХИМИЧЕСКИЕ СВОЙСТВА
Уравнения реакций щелочных металлов с неметаллами –
водородом и серой:
2М+Н2= 2МН
0
0
t
+1
-1
2е
гидрид
2М+S= М2S
2е
0
0
t
+1
-2
сульфид
Слайд 14
ХИМИЧЕСКИЕ СВОЙСТВА
При взаимодействии с кислородом натрий образует не
оксид, а пероксид:
2Na+O2 = Na2O2
0
0
2е
t
+1
-1
пероксид
И только литий образует оксид
при взаимодействии с кислородом:
4Li+O2 = 2Li2O
0
0
+1
t
-2
2e
оксид лития
Слайд 15
ХИМИЧЕСКИЕ СВОЙСТВА
Все щелочные металлы активно взаимодействуют с водой,
образуя щелочи и восстанавливая воду до водорода:
2М+2НОН = 2МОН+Н2
+1
+1
0
0
2е
Слайд 16
СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ
ОКСИДЫ
Оксиды М2О – твердые вещества. Имеют
ярко выраженные основные свойства: взаимодействуют с водой, кислотами и
кислотными оксидами. Оксиды натрия Na2O и калия K2O получают, прокаливая пероксиды с соответствующими металлами, например:
2Na + Na2O2 = 2Na2O
+1
2e
-2
t
-1
+1
0
Слайд 17
СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ
ГИДРОКСИДЫ
Гидроксиды МОН – твердые белые вещества.
Очень гидроскопичны. Хорошо растворяются в воде, с выделением большого
количества теплоты. Их относят к щелочам. Гидроксид натрия NaOH в технике известен как едкий натр, каустическая сода, каустик. Техническое название гидроксида калия KOH – едкое кали. Едкий натр применяют для очистки нефтепродуктов, в бумажной и текстильной промышленности, для производства жидкого мыла. Едкое кали применяют для производства жидкого мыла.
Слайд 18
СОЛИ ЩЕЛОЧНЫХ МЕТАЛЛОВ
КАРБОНАТ НАТРИЯ (NA2CO3)
Карбонат натрия образует кристаллогидрат
Na2CO3*10H2O, известный под названием кристаллическая сода, которую применяют в
производстве стекла, бумаги, мыла.
Слайд 19
СОЛИ ЩЕЛОЧНЫХ МЕТАЛЛОВ
ГИДРОКАРБОНАТ НАТРИЯ (NAHCO3)
Гидрокарбонат натрия применяют
в пищевой промышленности (пищевая сода) и в медицине (питьевая
сода)
Слайд 20
СОЛИ ЩЕЛОЧНЫХ МЕТАЛЛОВ
КАРБОНАТ КАЛИЯ (K2CO3)
Карбонат калия (техническое название
поташ) применяют в производстве жидкого мыла и для приготовления
тугоплавкого стекла, а также в качестве удобрения.
Слайд 21
СОЛИ ЩЕЛОЧНЫХ МЕТАЛЛОВ
КРИСТАЛЛОГИДРАТ СУЛЬФАТА НАТРИЯ (NA2SO4*10H2O)
Кристаллогидрат сульфата натрия
(техническое название глауберова соль) применяют для производства соды и
стекла и в качестве слабительного.
Слайд 22
СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ
ХЛОРИД НАТРИЯ (NACL)
Хлорид натрия, или поваренная
соль является важнейшим сырьем в химической промышленности, его широко
применяют и в быту.