- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Технология подготовки учащихся ЕГЭ по химии
Содержание
- 2. www.fipi.ru
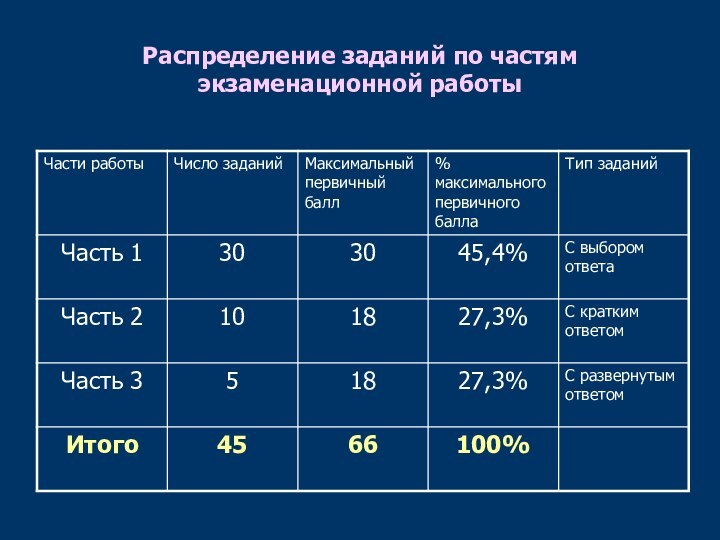
- 4. Распределение заданий по частям экзаменационной работы
- 6. Структура КИМ ЕГЭA1 Строение атомаA2 Периодический закон и ПСХЭA3
- 7. A6 Электроотрицательность. Степени окисленияA7 Кристаллические решеткиA8 Классификация
- 8. A14 Изомеры и гомологи σ- и π-Связи.
- 9. A21 Классификация химических реакцийА22 Скорость химических реакцийA23
- 10. A27 ОВРA28 Вещества в нашей
- 11. Часть BB1 Классификация и номенклатура веществB2
- 12. Часть BB6 УглеводородыB7 Кислородсодержащие орг.веществаB8 Азотсодержащие орг.веществаB9 ЗадачаB10 Задача
- 13. С1Используя метод электронного баланса, составьте уравнение реакции:Si
- 14. C2Даны вещества:серасероводородазотная кислота (конц.) серная кислота (конц.)Приведите уравнения четырех возможных реакций между этими веществами.
- 15. С3Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: H2O, KOH, t °пропилацетатX1X2кат.1200 °изб. Br2X3CH4винилацетилен
- 16. C4Какой объем хлора (н.у.) выделится, если к
- 17. С5При взаимодействии одного и того же количества
- 18. Скачать презентацию
- 19. Похожие презентации
www.fipi.ru

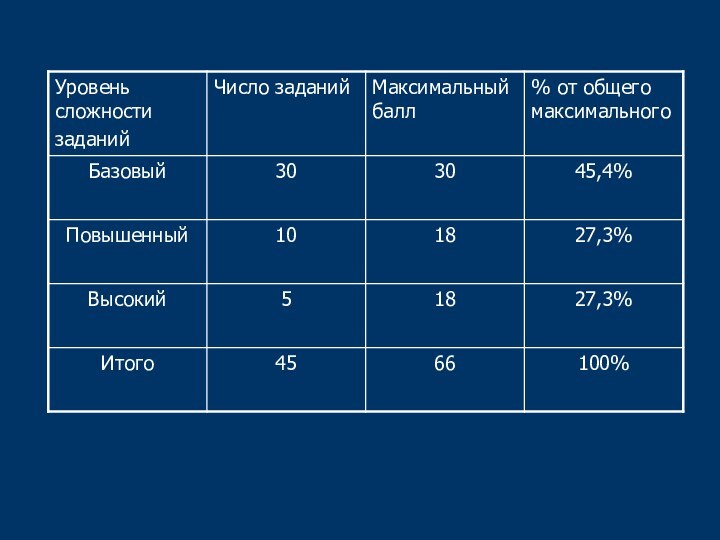













Слайд 6
Структура КИМ ЕГЭ
A1 Строение атома
A2 Периодический закон и ПСХЭ
A3 Металлы
главных и побочных подгрупп
Слайд 7
A6 Электроотрицательность. Степени окисления
A7 Кристаллические решетки
A8 Классификация веществ,
номенклатура
A9 - A12 Химические свойства простых веществ и классов
неорганических соединенийA13 Генетическая связь между классами неорганических веществ
Слайд 8
A14 Изомеры и гомологи
σ- и π-Связи. Типы
гибридизации
A15-A17 Химические свойства классов органических веществ
A18 -20 Способы получения
органических веществ, генетическая связь между углеводородами и кислородсодержащими
Слайд 9
A21 Классификация химических реакций
А22 Скорость химических реакций
A23 Обратимые
и необратимые реакции
A24 Электролитическая диссоциация
A25 Реакции ионного обмена
A26
Гидролиз солей
Слайд 10
A27 ОВР
A28 Вещества в нашей жизни.
Применение веществ. Распознавание веществ
A29 Химия в промышленности и в
экологииA30 Термохимический расчет или расчет объемных отношений
Слайд 11
Часть B
B1 Классификация и номенклатура веществ
B2
Степени окисления. ОВР
B3 Электролиз
B4 Гидролиз
B5 Химические
свойства классов неорганических веществ
Слайд 12
Часть B
B6 Углеводороды
B7 Кислородсодержащие орг.вещества
B8
Азотсодержащие орг.вещества
B9 Задача
B10 Задача
Слайд 13
С1
Используя метод электронного баланса, составьте уравнение реакции:
Si +
HNO3 + HF =
= H2SiF6 + NO
+ … Определите окислитель и восстановитель.
Слайд 14
C2
Даны вещества:
сера
сероводород
азотная кислота (конц.)
серная кислота (конц.)
Приведите уравнения
четырех возможных реакций между этими веществами.
Слайд 15
С3
Напишите уравнения реакций, с помощью которых можно осуществить
следующие превращения:
H2O, KOH, t °
пропилацетат
X1
X2
кат.
1200 °
изб. Br2
X3
CH4
винилацетилен
Слайд 16
C4
Какой объем хлора (н.у.) выделится, если к 200
мл 35%-ной соляной кислоты (плотность 1,17 г/мл) добавить при
нагревании 26,1 г оксида марганца(IV)?Какая масса гидроксида натрия в холодном растворе прореагирует с таким количеством хлора?
Слайд 17
С5
При взаимодействии одного и того же количества алкена
с различными галогеноводородами образуется соответственно 7,85 г хлорпроизводного или
12,3 г бромпроизводного.Определите молекулярную формулу алкена.