- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Типы химической связи
Содержание
- 2. Ковалентная связь1916 г. – теория Льюиса Химическая
- 3. Валентный уголугол, образованный линиями, соединяющими центры атомовСтруктура молекулы = Длины связей + Валентные углы
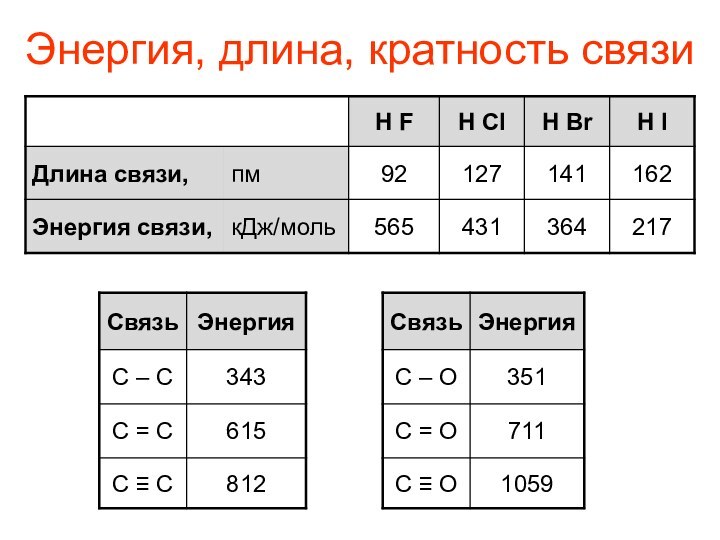
- 4. Энергия, длина, кратность связи
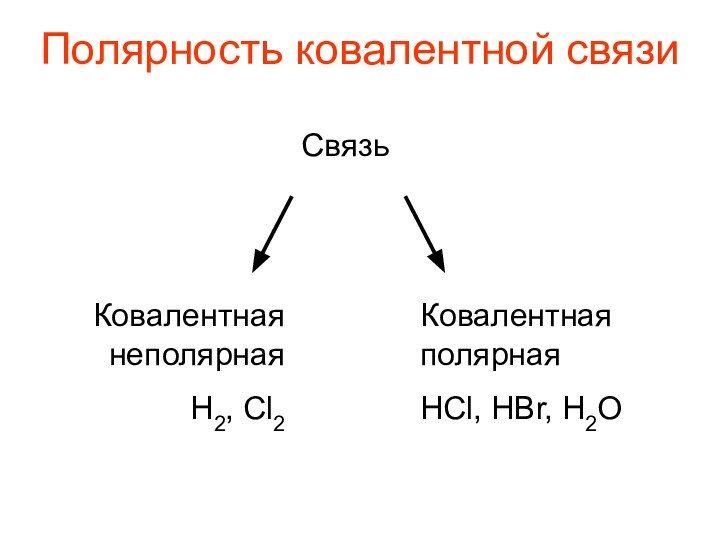
- 5. Полярность ковалентной связиСвязьКовалентная неполярнаяН2, Cl2Ковалентная полярнаяHCl, HBr, H2O
- 6. Дипольный моментДиполь – электронейтральная система, в которой
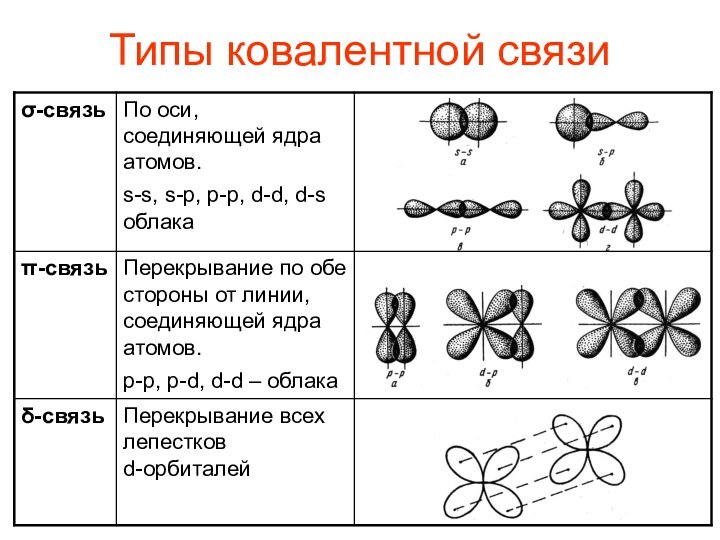
- 7. Типы ковалентной связи
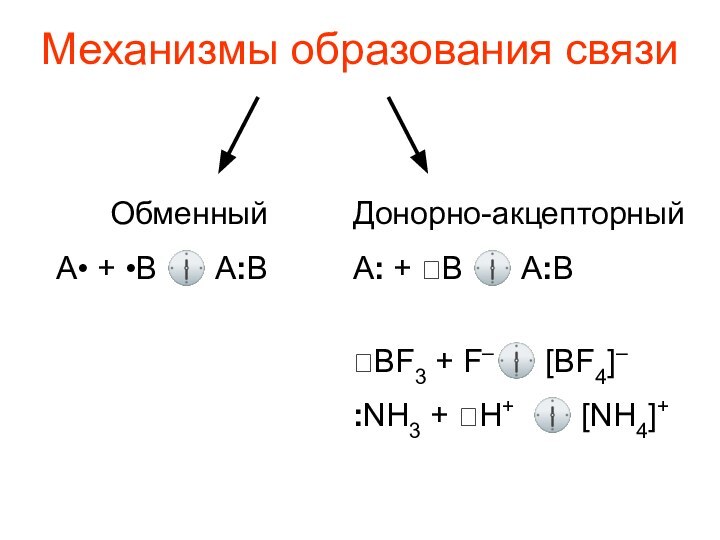
- 8. Механизмы образования связи
- 9. Гибридизациявыравнивание электронных облаков по форме и энергии с образованием гибридных орбиталей
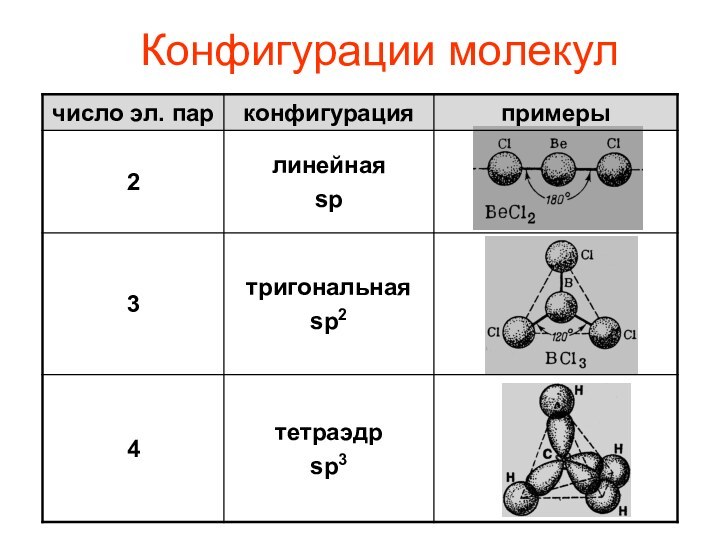
- 10. Конфигурации молекул
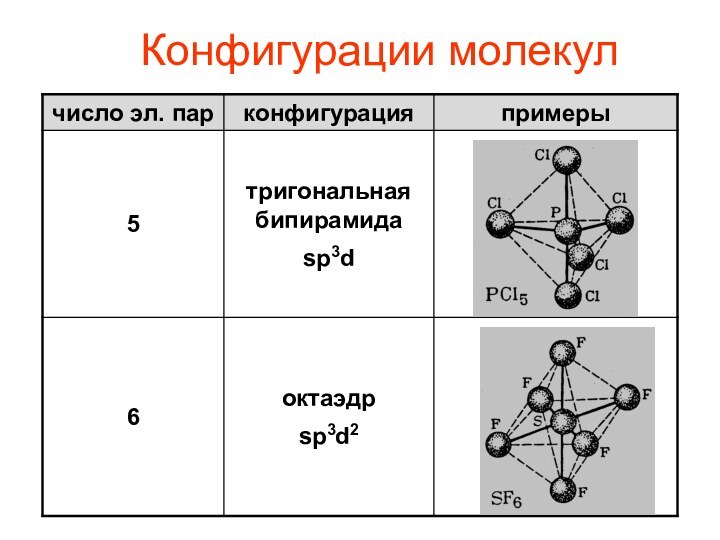
- 11. Конфигурации молекул
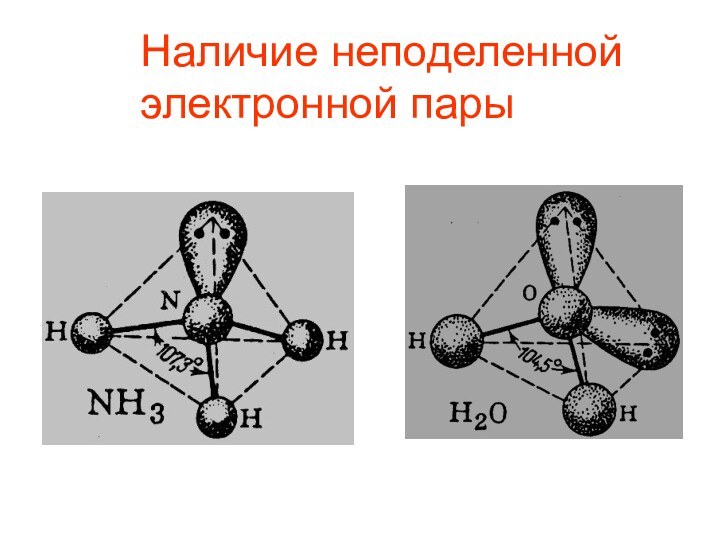
- 12. Наличие неподеленной электронной пары
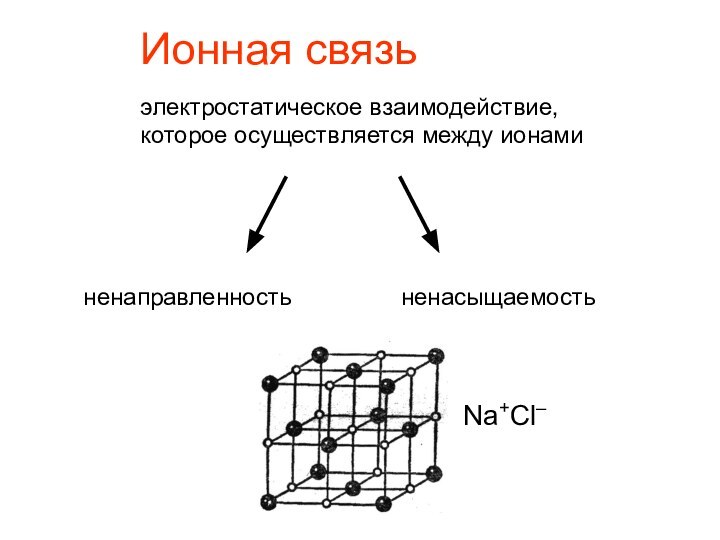
- 13. Ионная связьэлектростатическое взаимодействие, которое осуществляется между ионаминенаправленностьненасыщаемостьNa+Cl–
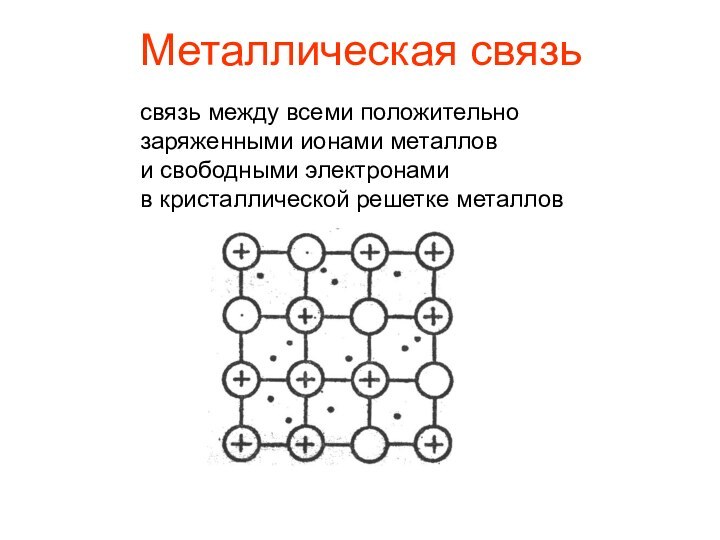
- 14. Металлическая связьсвязь между всеми положительно заряженными ионами металлов и свободными электронами в кристаллической решетке металлов
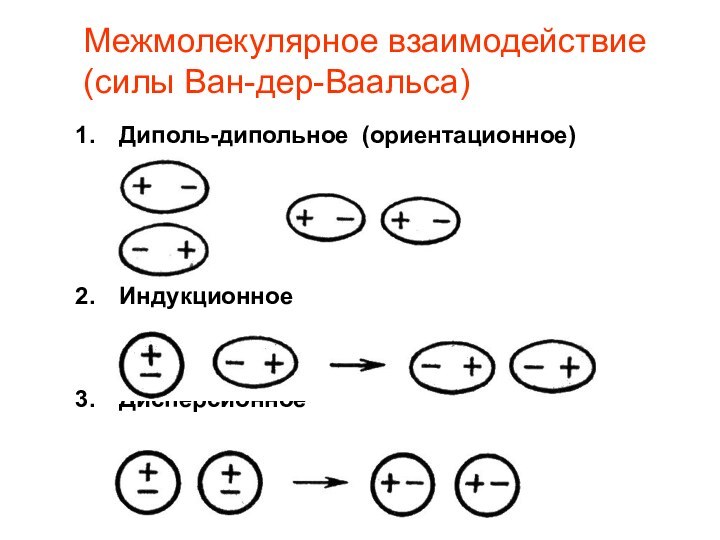
- 15. Межмолекулярное взаимодействие (силы Ван-дер-Ваальса)Диполь-дипольное (ориентационное) ИндукционноеДисперсионное
- 16. Скачать презентацию
- 17. Похожие презентации
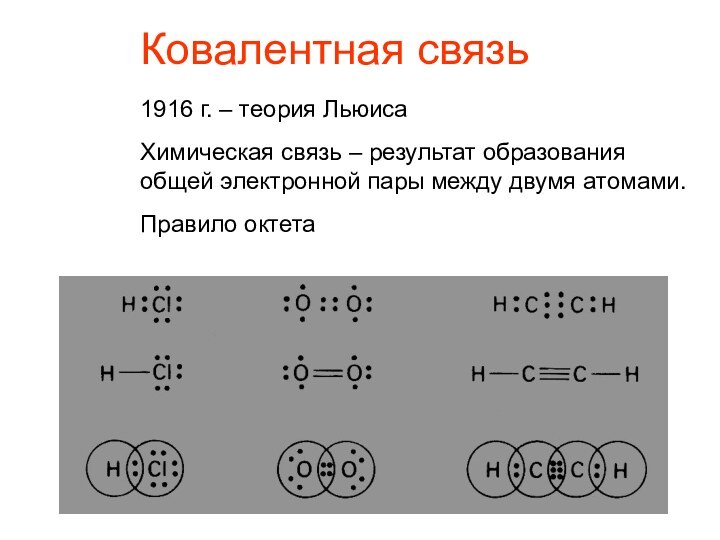
Ковалентная связь1916 г. – теория Льюиса Химическая связь – результат образования общей электронной пары между двумя атомами.Правило октета

Слайд 2
Ковалентная связь
1916 г. – теория Льюиса
Химическая связь
– результат образования
общей электронной пары между двумя атомами.
Слайд 3
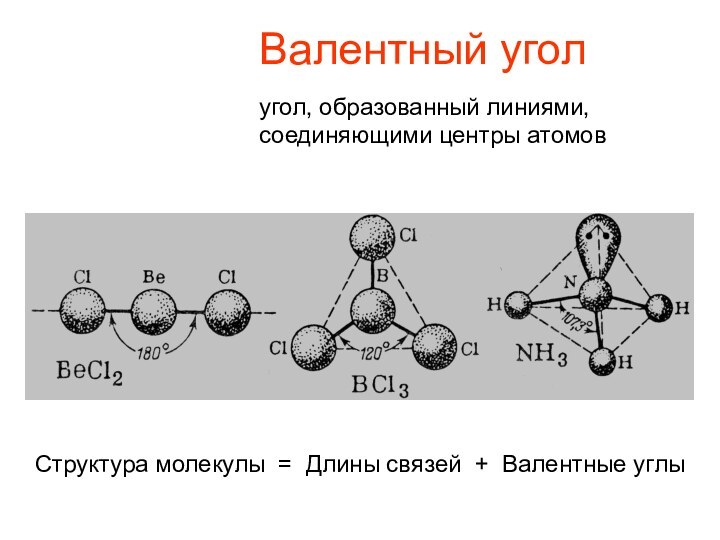
Валентный угол
угол, образованный линиями,
соединяющими центры атомов
Структура молекулы =
Длины связей + Валентные углы
Слайд 5
Полярность ковалентной связи
Связь
Ковалентная
неполярная
Н2, Cl2
Ковалентная
полярная
HCl, HBr, H2O
Слайд 6
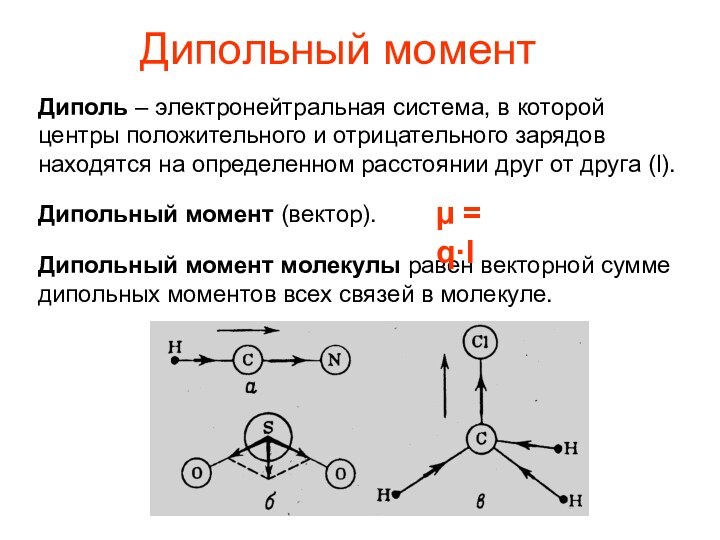
Дипольный момент
Диполь – электронейтральная система, в которой
центры положительного
и отрицательного зарядов находятся на определенном расстоянии друг от друга
(l).Дипольный момент (вектор).
Дипольный момент молекулы равен векторной сумме дипольных моментов всех связей в молекуле.
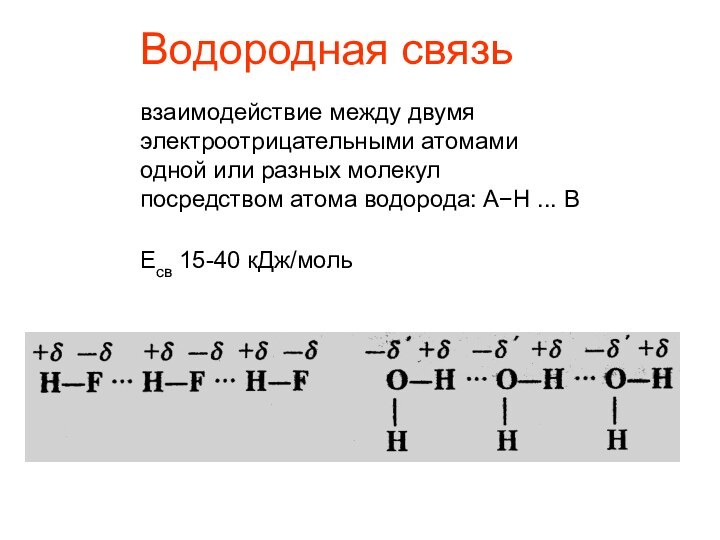
µ = q·l