- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Типы и характеристики химических связей
Содержание
- 2. Ковалентная связьИонная связьМеталлическая связьВодородная связьсодержание
- 3. Ковалентная связь –связь , образованная общей электронной
- 4. Свойства веществ с ковалентной неполярной связью: При
- 5. Вещества с молекулярной кристаллической решеткой: водород, фтор,
- 6. Ковалентная полярнаяКоллигация (обобществление электронов)HCI NH3
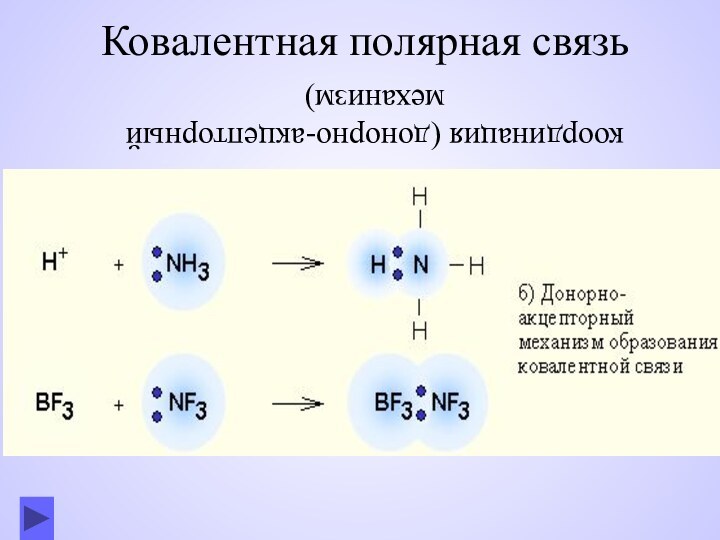
- 7. Ковалентная полярная связь координация (донорно-акцепторный механизм)
- 8. Свойства веществ с ковалентной полярной связью: При
- 9. Ионная связьХимическая связь,возникающая между ионами, называется ионной,
- 10. Ионные кристаллические решетки.Свойства веществ с ионной связью:
- 11. Металлическая связь Образуется между атомами и ионами
- 12. Свойства веществ с металлической связью: высокая, электрическая
- 13. : Pb, K, Na, Li, β-Ti, β-Zr,
- 14. ВОДОРОДНАЯ СВЯЗЬХимическая связь между положительно поляризованными атомами
- 17. Скачать презентацию
- 18. Похожие презентации

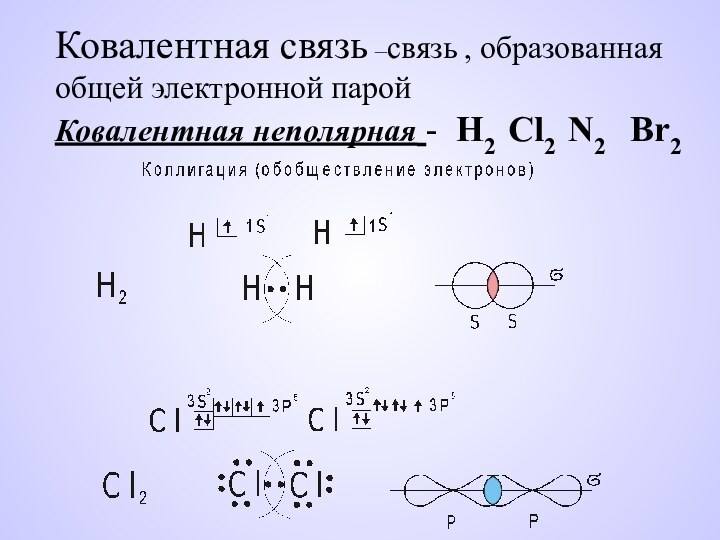



Слайд 3 Ковалентная связь –связь , образованная общей электронной парой Ковалентная
неполярная - H2 Cl2 N2 Br2
Слайд 4
Свойства веществ с ковалентной неполярной связью:
При обычных условиях
вещества газообразные (водород, кислород), жидкие (бром), твердые (иод, фосфор).
Большинство веществ сильнолетучие, т.е. имеют очень низкие температуры плавления и кипения.
Растворы и расплавы веществ электрического тока не проводят.
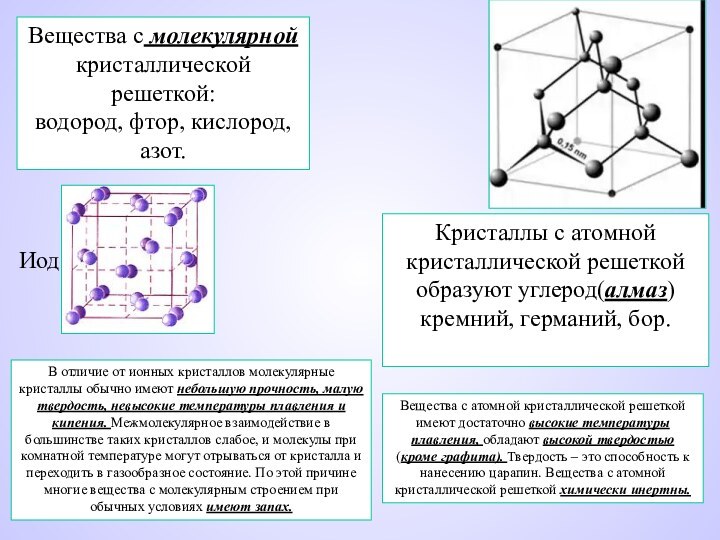
Вещества с молекулярной кристаллической решеткой:
водород, фтор, кислород, азот.
Кристаллы с атомной кристаллической решеткой образуют углерод(алмаз)кремний, германий, бор.
Слайд 5
Вещества с молекулярной кристаллической решеткой:
водород, фтор, кислород,
азот.
Иод
Кристаллы с атомной кристаллической решеткой образуют углерод(алмаз)кремний, германий, бор.
Вещества
с атомной кристаллической решеткой имеют достаточно высокие температуры плавления, обладают высокой твердостью (кроме графита). Твердость – это способность к нанесению царапин. Вещества с атомной кристаллической решеткой химически инертны.В отличие от ионных кристаллов молекулярные кристаллы обычно имеют небольшую прочность, малую твердость, невысокие температуры плавления и кипения. Межмолекулярное взаимодействие в большинстве таких кристаллов слабое, и молекулы при комнатной температуре могут отрываться от кристалла и переходить в газообразное состояние. По этой причине многие вещества с молекулярным строением при обычных условиях имеют запах.
Слайд 6
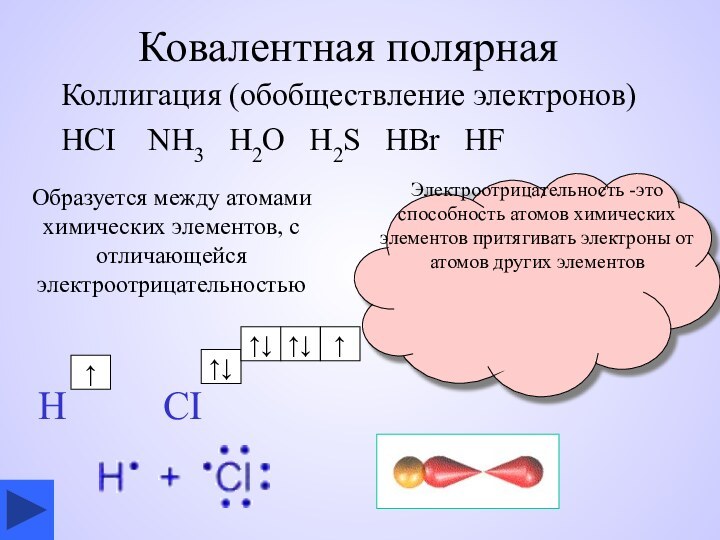
Ковалентная полярная
Коллигация (обобществление электронов)
HCI NH3 H2O
H2S HBr HF
Образуется между атомами химических
элементов, с отличающейся электроотрицательностьюЭлектроотрицательность -это способность атомов химических элементов притягивать электроны от атомов других элементов
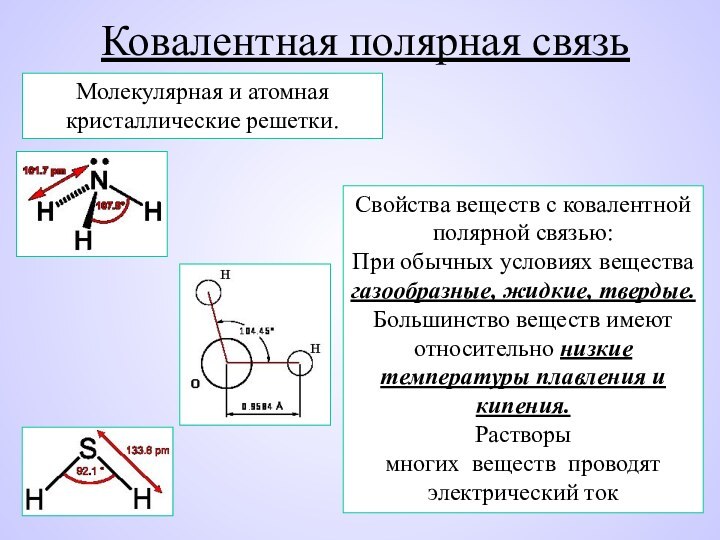
Слайд 8 Свойства веществ с ковалентной полярной связью: При обычных условиях
вещества газообразные, жидкие, твердые.
Большинство веществ имеют относительно низкие температуры
плавления и кипения.Растворы многих веществ проводят электрический ток
Молекулярная и атомная кристаллические решетки.
Ковалентная полярная связь
Слайд 9
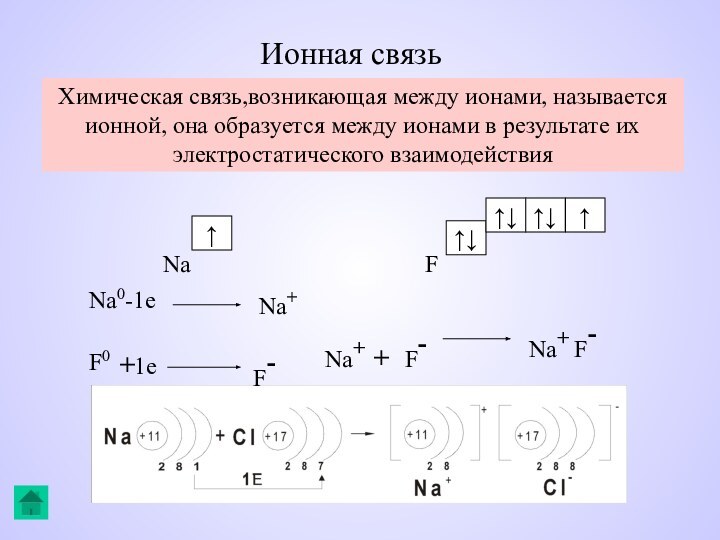
Ионная связь
Химическая связь,возникающая между ионами, называется ионной, она
образуется между ионами в результате их электростатического взаимодействия
Na
F↑
↑↓
↑↓
↑↓
↑
Na0-1e
Na+
F0
+1e
F-
Na+ + F-
Na+ F-
Слайд 10
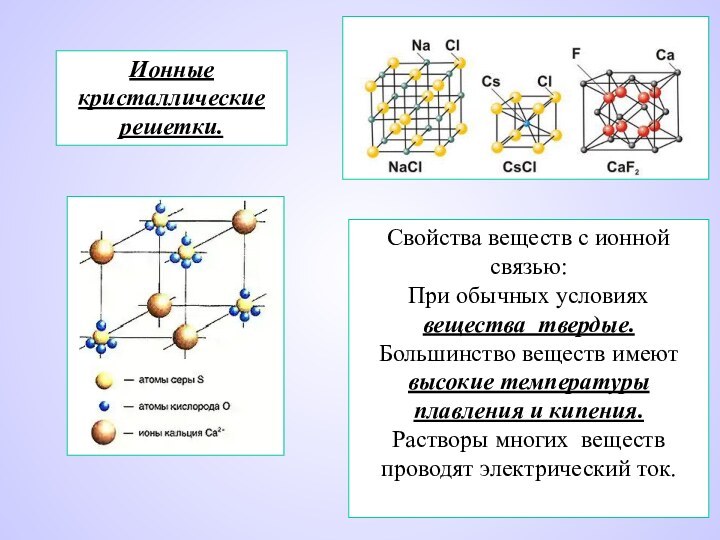
Ионные кристаллические решетки.
Свойства веществ с ионной связью:
При обычных
условиях вещества твердые.
Большинство веществ имеют высокие температуры плавления и
кипения.Растворы многих веществ проводят электрический ток.
Слайд 11
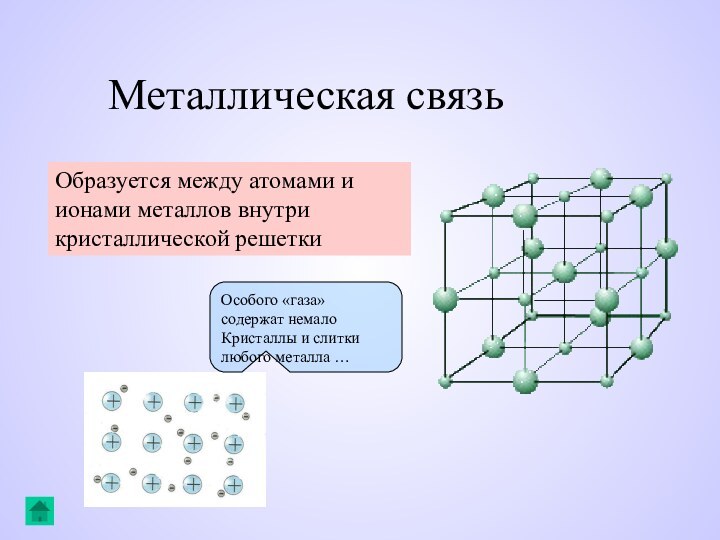
Металлическая связь
Образуется между атомами и ионами металлов
внутри кристаллической решетки
Особого «газа» содержат немало
Кристаллы и слитки
любого металла …
Слайд 12 Свойства веществ с металлической связью: высокая, электрическая проводимость, уменьшается
с повышением температуры металла.
высокая теплопроводность;
пластичность, ковкость;
характерный «металлический» блеск;
широкие пределы
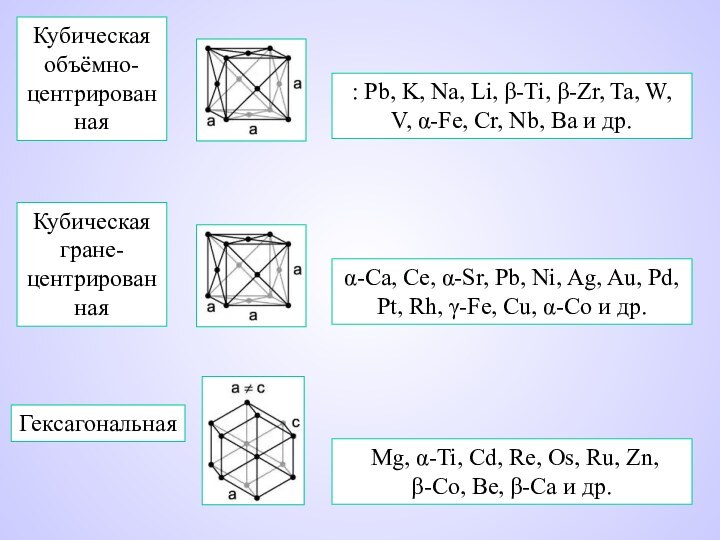
изменения плотности, прочности, твердости, температуры плавления.Слайд 13 : Pb, K, Na, Li, β-Ti, β-Zr, Ta,
W, V, α-Fe, Cr, Nb, Ba и др.
Кубическая объёмно-центрированная
Кубическая
гране-центрированнаяα-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co и др.
Гексагональная
Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
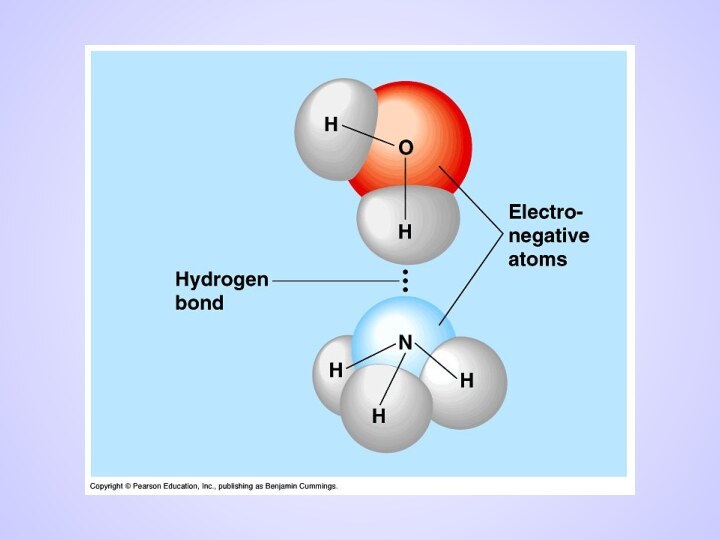
Слайд 14
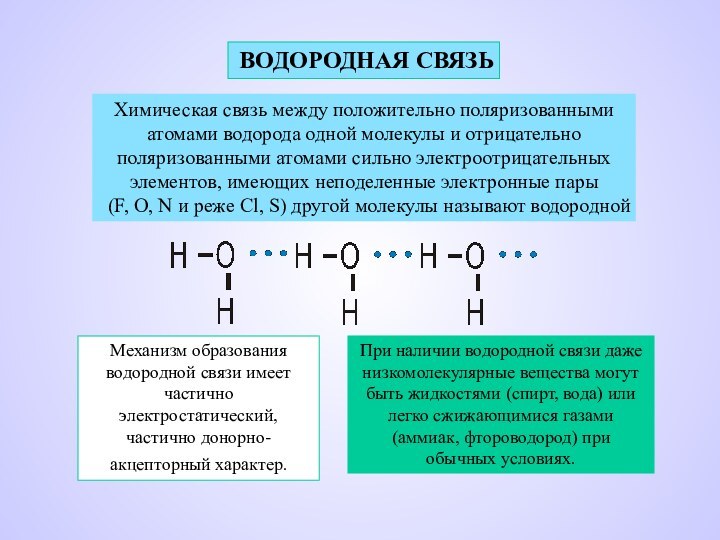
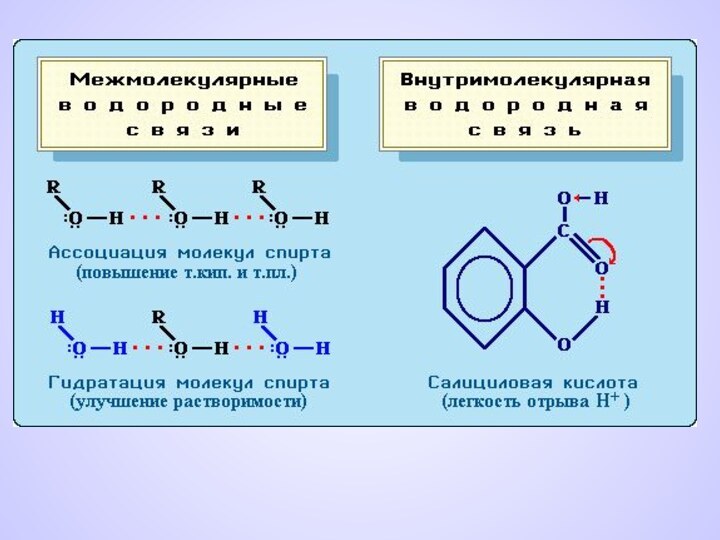
ВОДОРОДНАЯ СВЯЗЬ
Химическая связь между положительно поляризованными
атомами водорода
одной молекулы и отрицательно
поляризованными атомами сильно электроотрицательных
элементов,
имеющих неподеленные электронные пары(F, O, N и реже Cl, S) другой молекулы называют водородной
Механизм образования водородной связи имеет частично электростатический, частично донорно-акцепторный характер.
При наличии водородной связи даже низкомолекулярные вещества могут быть жидкостями (спирт, вода) или легко сжижающимися газами (аммиак, фтороводород) при обычных условиях.





























