вещества
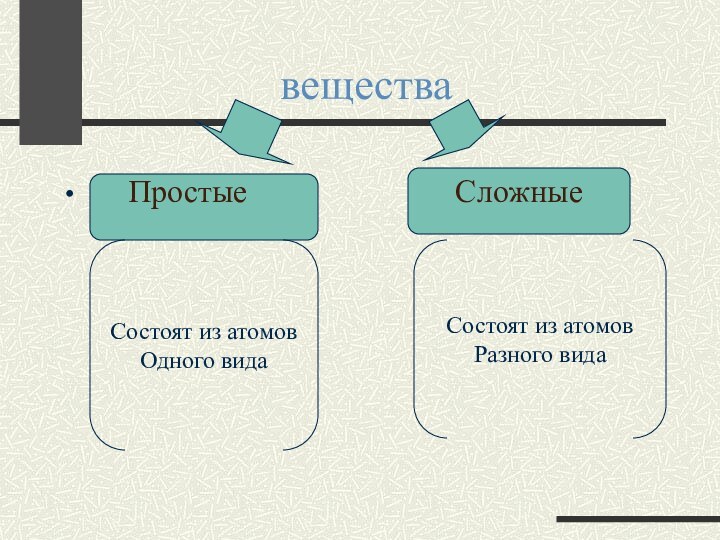
Простые
Сложные
Состоят из атомов
Одного вида
Состоят из атомов
Разного вида
Слайд 3
Простые вещества
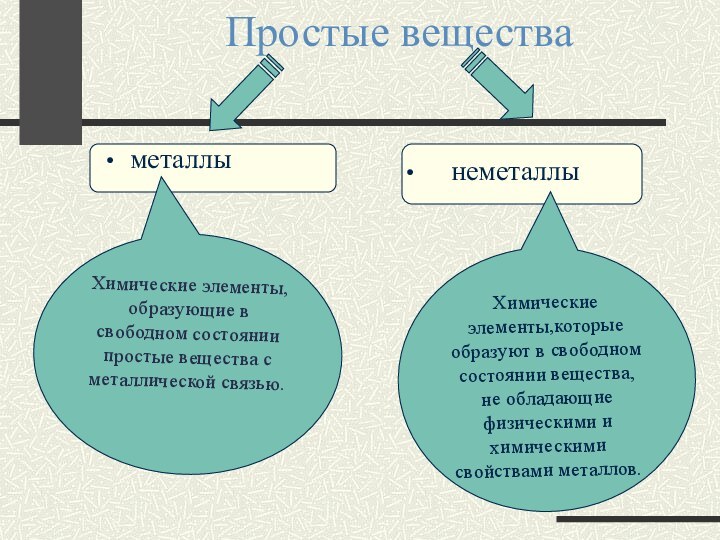
металлы
неметаллы
Химические элементы, образующие в свободном состоянии простые вещества с
металлической связью.
Химические элементы,которые образуют в свободном состоянии вещества, не обладающие физическими и химическими свойствами металлов.
Слайд 4
Древние века и средние века – 7 металлов
(Au, Ag, Cu,Pb, Fe, Hg)
М.В. Ломоносов - металлы «светлое
тело, которое ковать можно»
А. Лавуазье – 1789 – описал 17 металлов
Д.И. Менделеев – предсказание металлов
ХIХ век – открытие платиновых, щелочных, щелочноземельных металлов.
ХХ – открытие транcурановых элементов.
Слайд 5
Нахождение металлов в природе
В виде соединений
В самородном состоянии
(Au, Pt, Ag)
В виде солей (галогенидов, карбонатов, нитратов, фосфатов)
В
виде оксидов и сульфидов
Слайд 6
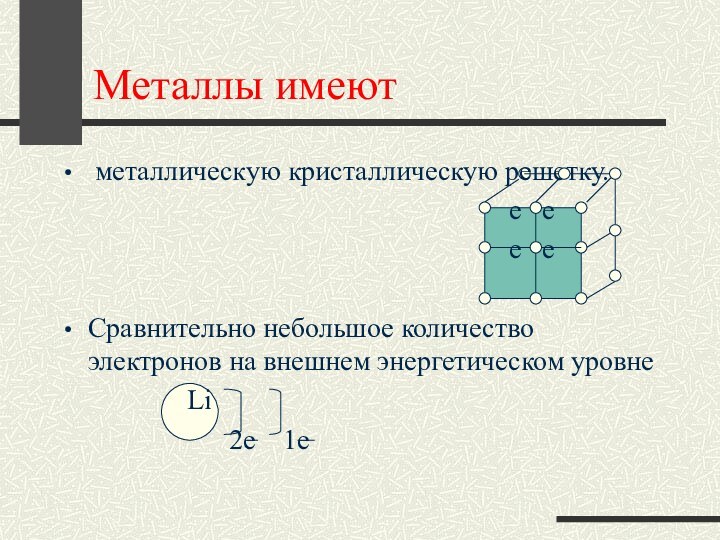
Металлы имеют
металлическую кристаллическую решетку.
е е
е е
Сравнительно небольшое количество электронов на внешнем энергетическом уровне
Li
2е 1е
Слайд 7
Имеют свободные валентные электроны
Металлическая связь не обладает направленностью
и насыщенностью.
Подвижные электроны компенсируют электрическое отталкивание между положительно заряженными
ионами и тем самым связывают их в твердые тела
Слайд 8
Физические свойства металлов
Твердые вещества, кроме ртути.
(самый
мягкий – калий,
самый твердый – хром)
Слайд 9
Пластичные
Au, Ag, Cu, Sn, Pb,Zn, Fe
уменьшается
Слайд 10
Теплопроводность
Hg, Cu, Ag, Al, Fe
уменьшается
Электропроводность
Ag
Mn
уменьшается
плавления
Легкоплавкие
тугоплавкие
Hg, Ga, Cs, In, Bi W, Mo, V, Cr
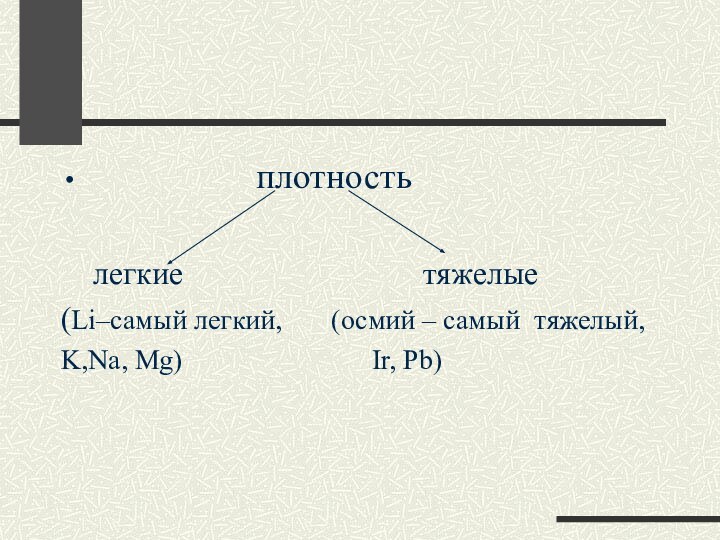
плотность
легкие
тяжелые
(Li–самый легкий, (осмий – самый тяжелый,
K,Na, Mg) Ir, Pb)
Слайд 14
Причины, приводящие к различию в физических свойств металлов
Атомы металлов образуют разные типы кристаллических решеток
Слайд 15
Причины, приводящие к различию физических свойств
Атомы металлов имеют
разное число валентных электронов, участвующих в образовании металлической связи
Атомы
(ионы) имеют разные радиусы
Атомы металлов побочных подгрупп могут образовывать и ковалентную связь с помощью неспаренных d-электронов.
Слайд 16
положение металлов в периодической системе Д. И.Менделеева
Слайд 17
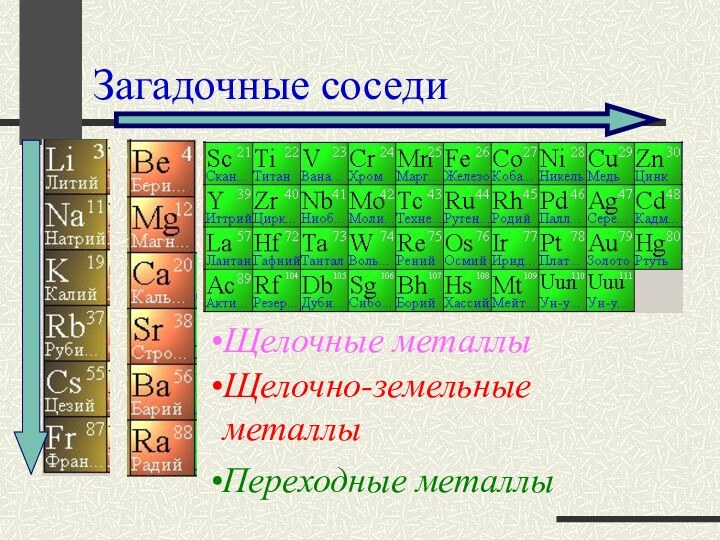
Загадочные соседи
Щелочно-земельные металлы
Переходные металлы
Щелочные металлы
Слайд 18
Химические свойства металлов
Металлы в химических реакциях являются восстановителями,
при этом они окисляются
Mo – ne =Mn+
Al, Be, Mg, Ca, Li, Na, K, Rb, Cs
Восстановительная способность возрастает
Слайд 19
Металлы вытесняются из их соединений другими металлами
Н.Н. Бекетов
– создал «вытеснительный ряд» (прототип электрохимического ряда напряжения металлов)
Li, K, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au.
Слайд 20
Взаимодействуют с простыми веществами
С галогенами и кислородом
2Na + Cl2 = 2 Na Cl
Mg + O2 = 2Mg O
C элементами пятой группы (труднее)
3Ca + 2P =Ca3P2
Слайд 21
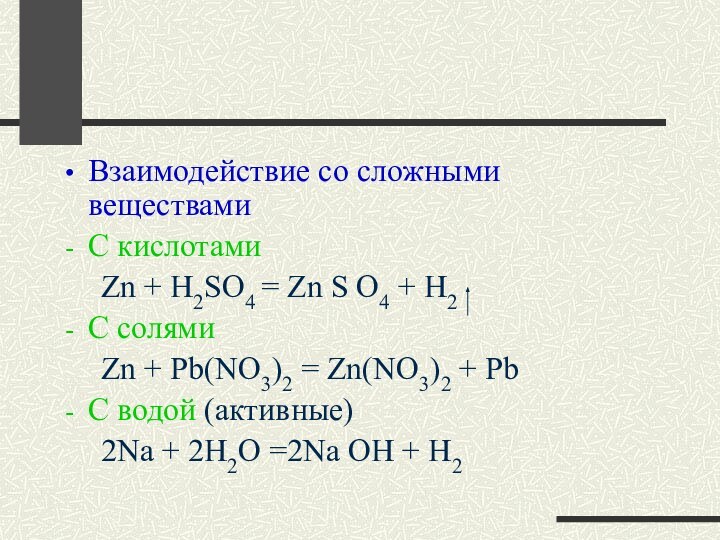
Взаимодействие со сложными веществами
С кислотами
Zn
+ H2SO4 = Zn S O4 + H2
C солями
Zn + Pb(NO3)2 = Zn(NO3)2 + Pb
C водой (активные)
2Na + 2H2O =2Na OH + H2
Слайд 22
Применение металлов
Металлургическая промыш-ленность
Станкострое-ние
медицина
Сельское хозяйство
Для получения сплавов
Домашнее хозяйство