- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Спирты
Содержание
- 2. Содержание
- 3. СПИРТЫCxHy (OH)nСпиртами называются органические вещест-ва, молекулы которых
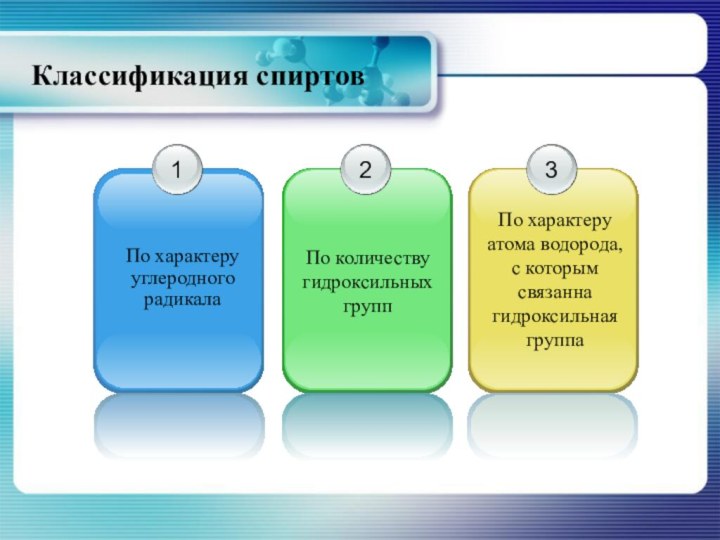
- 4. Классификация спиртов
- 5. Классификация спиртовПо характеру углеродного радикала
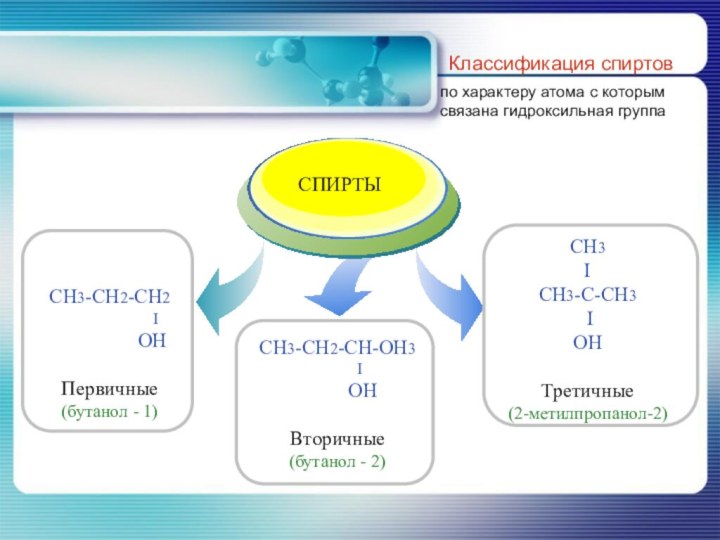
- 6. По характеру углеводородного радикала, с которым связана гидроксильная группа классификация спиртов совпадает с классификацией углеводородов.
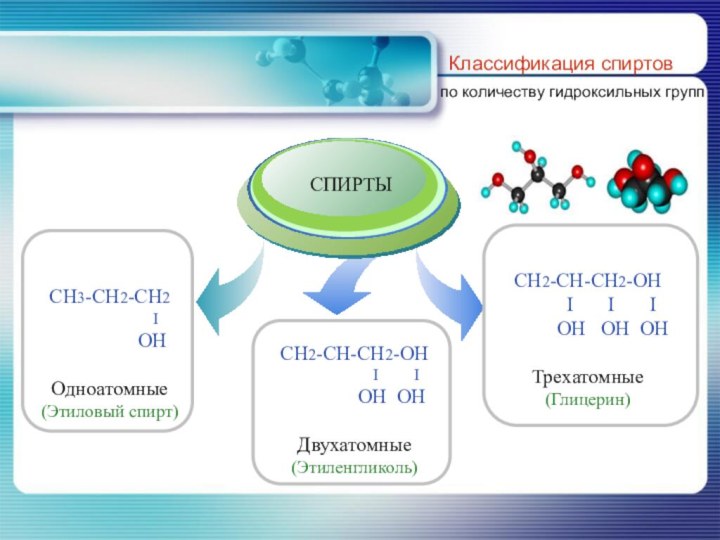
- 7. Классификация спиртовпо количеству гидроксильных групп
- 8. Классификация спиртовпо характеру атома с которым связана гидроксильная группа
- 9. Алканолы образуют гомологический ряд общей формулы CnH2n+1OH
- 10. CH3-OH - метанолC2H5-OH - этанол
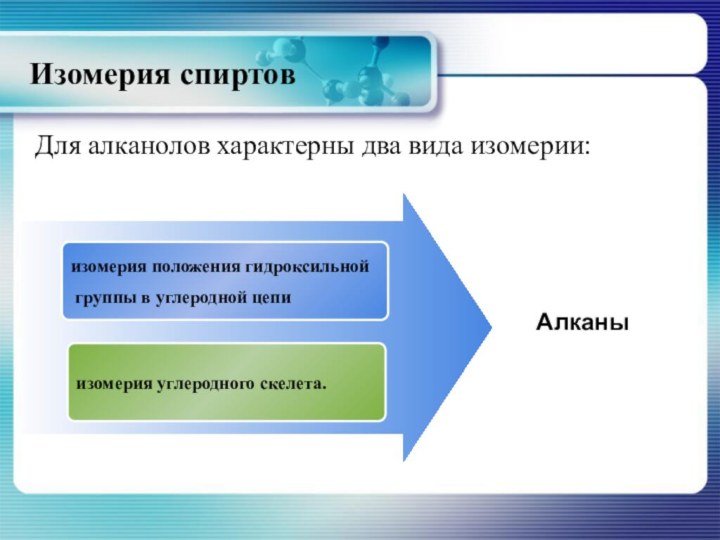
- 11. Изомерия спиртовДля алканолов характерны два вида изомерии:
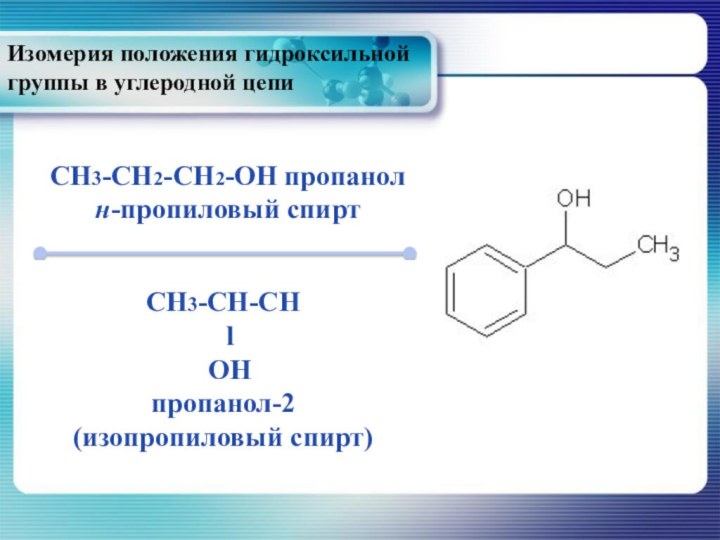
- 12. Изомерия положения гидроксильной группы в углеродной цепиCH3-CH2-CH2-OH пропанолн-пропиловый спиртCH3-CH-CH l OHпропанол-2(изопропиловый спирт)
- 13. CH3-CH2-CH2-CH2-OH бутанол-1 (н-бутиловый спирт)CH3-CH-CH2-OH l
- 14. Физические свойства спиртовАлканолы являются бесцветными жидкостями или
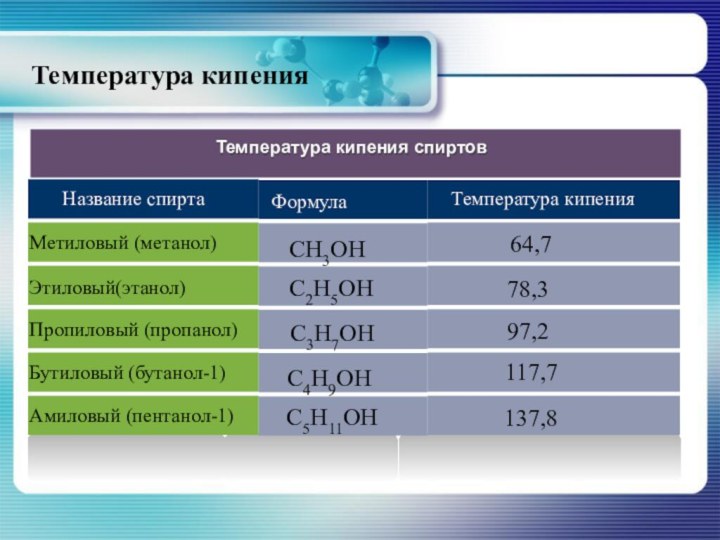
- 15. Температура кипения
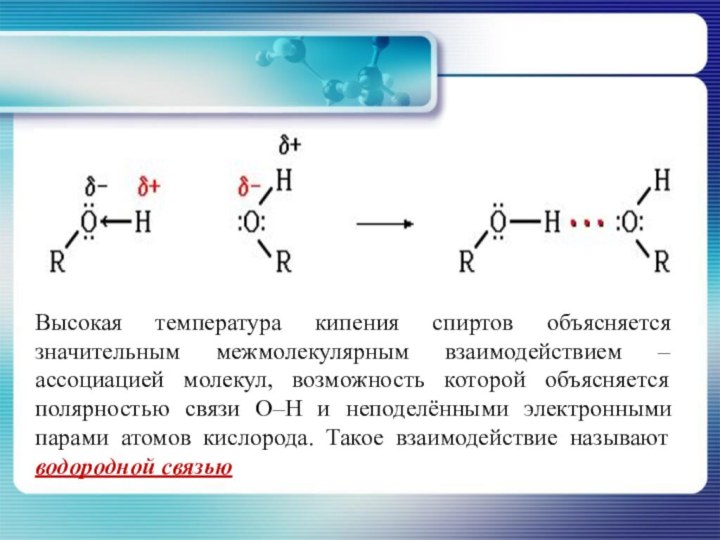
- 16. Высокая температура кипения спиртов объясняется значительным межмолекулярным
- 17. Строение молекулы этанолаВ молекуле этанола атомы углерода,
- 18. Химические свойства спиртовРеакционная способность спиртов обусловлена наличием
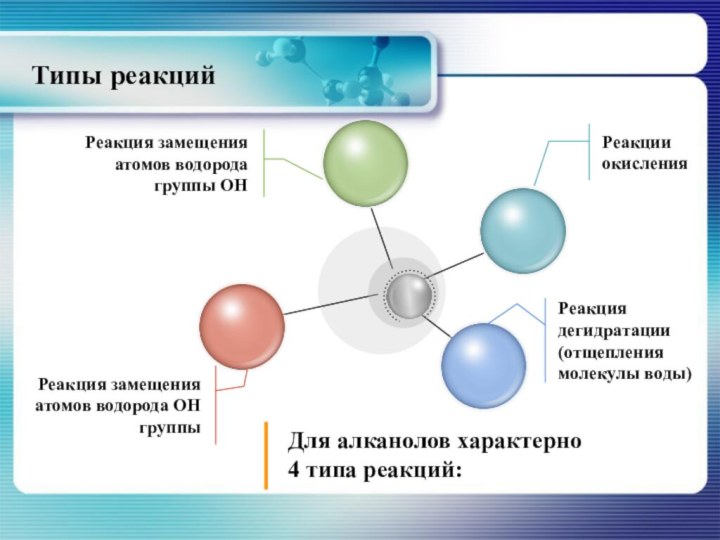
- 19. Типы реакций
- 20. Реакция замещения водорода -ОН группыС2Н5ОН + Na
- 21. Реакция замещения –ОН группы Наибольшее
- 22. R – OH + H – X
- 23. Проведение реакций опытным путем
- 24. Реакция дегидратации Для алканолов характерно
- 25. Внутримолекулярная дегидратация алканолов может
- 26. Правило Зайцева Внутримолекулярная дегидратация несимметричных
- 27. Дегидратация вторичных спиртов При дегидратации
- 28. При более слабом нагревании
- 29. Реакции окисленияОкисление спиртов проис-ходит и под действием
- 31. Окисление первичных спиртов до карбоновых кислот протекает
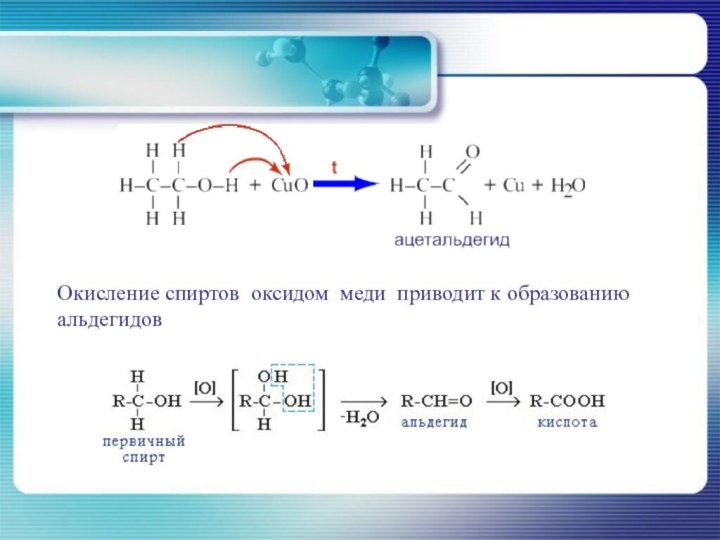
- 32. Окисление спиртов оксидом меди приводит к образованию альдегидов
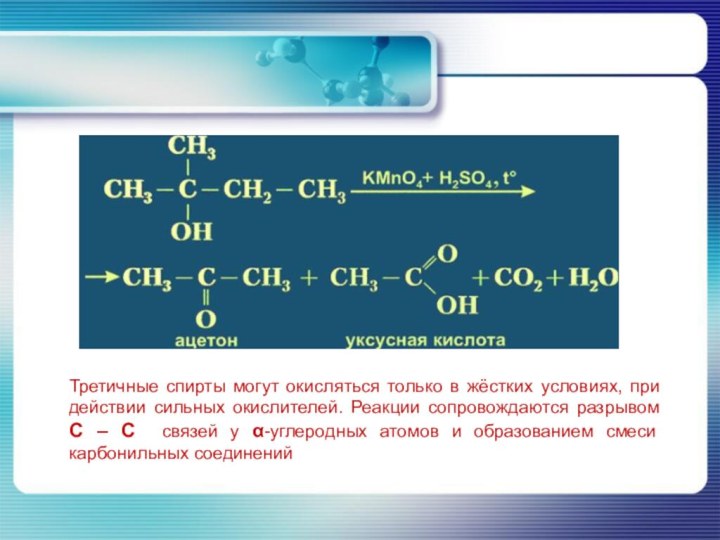
- 34. Третичные спирты могут окисляться только в жёстких
- 35. Метанол и этанолМетанол получают гидрированием оксида углерода
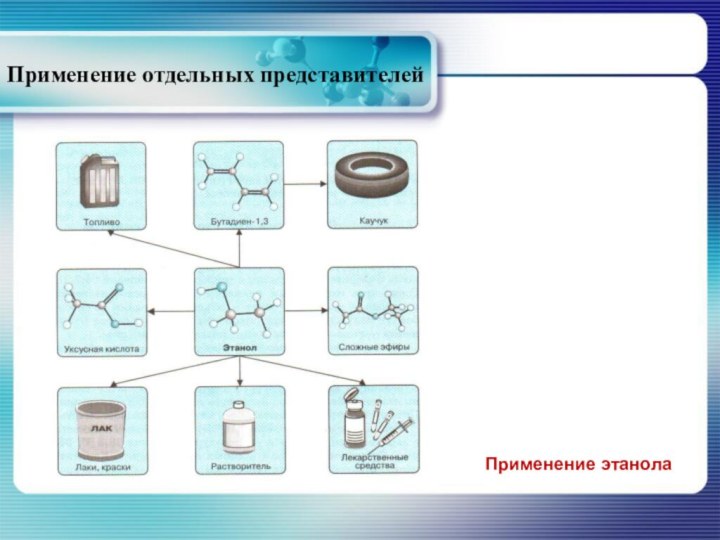
- 36. Применение отдельных представителейПрименение этанола
- 37. Наиболее распространённым методом получения этанола является ферментативное расщепление моносахаридов.
- 38. Мировое производство мета-нола составляет около 10 мил-лионов
- 39. ЗапомниВодородная связь – это связь между атомом
- 40. Скачать презентацию
- 41. Похожие презентации
Содержание























Слайд 6 По характеру углеводородного радикала, с которым связана гидроксильная
группа классификация спиртов совпадает с классификацией углеводородов.
Слайд 9 Алканолы образуют гомологический ряд общей формулы CnH2n+1OH (n=1,2,3,:N).
Названия алканолов по систематичес-кой номенклатуре строятся из названий соответствующих
ал- канов путём добавления суффикса «ол»
Слайд 12
Изомерия положения гидроксильной группы в углеродной цепи
CH3-CH2-CH2-OH пропанол
н-пропиловый
спирт
CH3-CH-CH
l
OH
пропанол-2
(изопропиловый спирт)
Слайд 13
CH3-CH2-CH2-CH2-OH
бутанол-1
(н-бутиловый спирт)
CH3-CH-CH2-OH
l
CH3
2-метилпропанол-1
(изобутиловый
спирт)
Первым из спиртов, для которого характерны оба вида изомерии,
является бутанол Изомерия углеродного скелета
Слайд 14
Физические свойства спиртов
Алканолы являются бесцветными жидкостями или кристаллическими
веществами с характерным запахом. Первые члены гомологического ряда имеют
приятный запах, для бутанолов и пентанолов запах становится неприятным и раздражающим. Высшие алканолы имеют приятный ароматный запах.Слайд 16 Высокая температура кипения спиртов объясняется значительным межмолекулярным взаимодействием
– ассоциацией молекул, возможность которой объясняется полярностью связи О–Н
и неподелёнными электронными парами атомов кислорода. Такое взаимодействие называют водородной связью
Слайд 17
Строение молекулы этанола
В молекуле этанола атомы углерода, водорода
и кислорода связаны только одинарными - связями. По-скольку
электроотрицательность кислорода больше электроотрица-тельности углерода и водорода, общие электронные пары связей С–О и О – Н смещены в сторону атома кислорода. На нём возникает частичный отрицательный, а на атомах углерода и водорода частичные положительные заряды.
Слайд 18
Химические свойства спиртов
Реакционная способность спиртов обусловлена наличием в
их молекулах полярных связей, способных разрываться по гетеролитическому механизму
.Спирты проявляют слабые кислотно – основные свойства
Слайд 20
Реакция замещения водорода -ОН группы
С2Н5ОН + Na →
C2H5ONa + H2
C2H5ONa + H2O → C2H5OH + NaOH
Как
слабые кислоты алканолы могут реагировать со щелочными металлами. Образующиеся при этом металлические производные спиртов называются алкоголятами.
Слайд 21
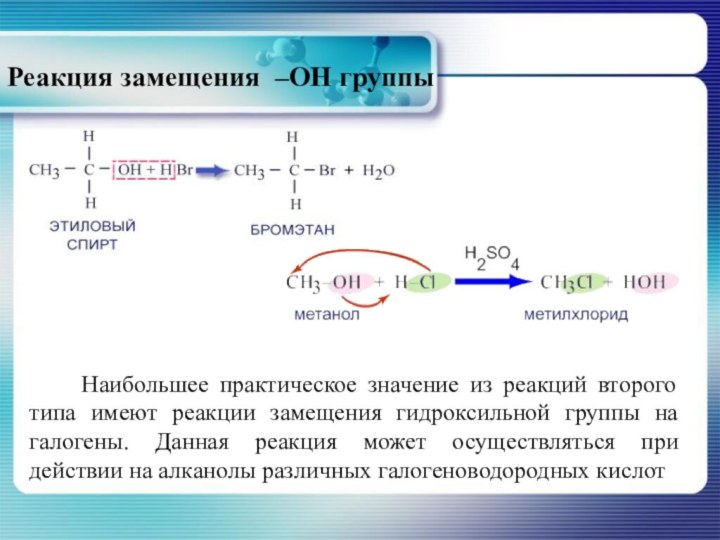
Реакция замещения –ОН группы
Наибольшее практическое
значение из реакций второго типа имеют реакции замещения гидроксильной
группы на галогены. Данная реакция может осуществляться при действии на алканолы различных галогеноводородных кислотСлайд 22 R – OH + H – X ↔
R – X + H2O
Реакционная способность алканолов
R3С – OH
> R2CH – OH > RCH2 – OH Реакционная способность HX
HI > HBr > HCl >> HF
Реакция алканолов с галогеноводородными кислотами является обратимой. Эффективность её протекания зависит от строения алканола, природы галогеноводорода и условий проведения. Наиболее активными в данной реакции являются третичные алканолы и иодоводородная кислота
Реакции алканолов
Слайд 24
Реакция дегидратации
Для алканолов характерно два
типа реакции дегидратации:
-
внутримолекулярная и
- межмолекулярная
При внутримолекулярной дегидратации обра- зуются алкены, при межмолекулярной - простые эфиры.
Слайд 25 Внутримолекулярная дегидратация алканолов может осуществляться
при нагревании их с избытком концентрированной H2SO4
при темпе- ратуре 150-200ºС или при пропускании спиртов над нагретыми твёрдыми катализаторами.
Слайд 26
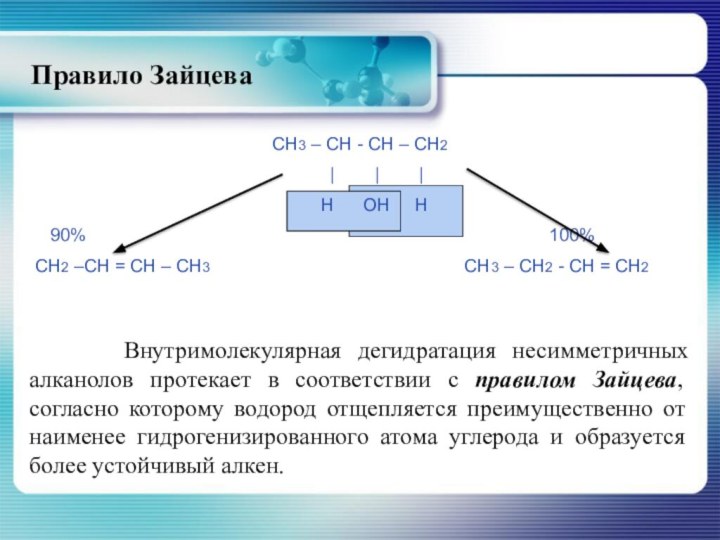
Правило Зайцева
Внутримолекулярная дегидратация несимметричных алканолов
протекает в соответствии с правилом Зайцева, согласно которому водород
отщепляется преимущественно от наименее гидрогенизированного атома углерода и образуется более устойчивый алкен.
Слайд 27
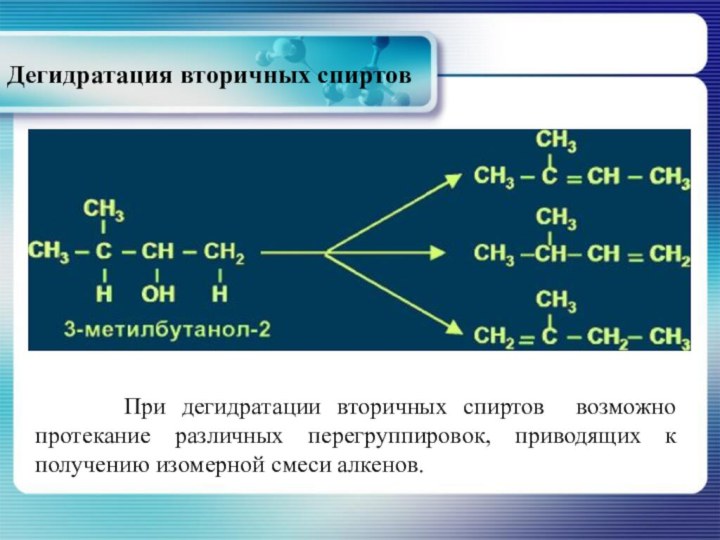
Дегидратация вторичных спиртов
При дегидратации вторичных
спиртов возможно протекание различных перегруппировок, приводящих к получению изомерной
смеси алкенов.Слайд 28 При более слабом нагревании этилового
спирта с серной кислотой образуется диэтиловый эфир. Это летучая,
легко воспламеняющаяся жидкость. Диэтиловый эфир относится к классу простых эфиров – органических веществ, молекулы которых состоят из двух углеводородных радикалов, соединённых посредством атома кислорода. Общая формула R – O - R
Слайд 29
Реакции окисления
Окисление спиртов проис-ходит и под действием силь-ных
окислителей. Характер получаемых при этом продук-тов определяется степенью замещённости
спиртов, а так-же природой применяемого окислителяСлайд 31 Окисление первичных спиртов до карбоновых кислот протекает при
действии HNO3 или перманганата калия в щелочной среде.
Окисление вторичных
спиртов приводит к образованию соответствующих кетонов.Слайд 34 Третичные спирты могут окисляться только в жёстких условиях,
при действии сильных окислителей. Реакции сопровождаются разрывом С –
С связей у α-углеродных атомов и образованием смеси карбонильных соединений
Слайд 35
Метанол и этанол
Метанол получают гидрированием оксида углерода (II)
СО. В настоящее время разработан способ получения метанола частичным
восстановлением углекислого газа. При этом используется более дешёвое углеродсодержащее сырьё, но требуется большой объём водорода.Слайд 37 Наиболее распространённым методом получения этанола является ферментативное расщепление
моносахаридов.
Слайд 38 Мировое производство мета-нола составляет около 10 мил-лионов тонн
в год, этанола производится примерно на порядок больше. Метанол
и этанол применяются в качестве растворителей и сырья в орга-ническом синтезе. Кроме того этанол используют в пищевой промышленности и в медицине.
Слайд 39
Запомни
Водородная связь – это связь между атомом водорода
одной молекулы и атомами с большой электоотрицательностью ( О,F,N,Cl)
другой моле-кулы.Реакция этерификации – взаимодействие спир-тов с органическими и неорганическими кислотами с образованием сложных эфиров.