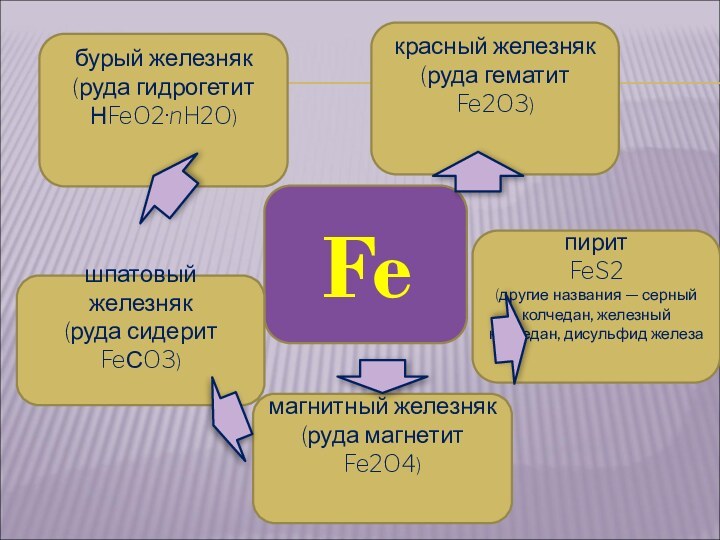
НАХОЖДЕНИЕ В ПРИРОДЕ И
ПРИМЕНЕНИЕ ЖЕЛЕЗАIII. ФИЗИЧЕСКИЕ СВОЙСТВА.
IV. ХИМИЧЕСКИЕ СВОЙСТВА
ПЛАН:
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть





















ПЛАН:
III. ФИЗИЧЕСКИЕ СЫВОЙСТВА
IV. ХИМИЧЕСКИЕ СВОЙСТВА