Слайд 2
Группы «чужеродных агентов»
Образы патогенности -РАМР (патоген-ассоциированные молекулярные патерны)
группы
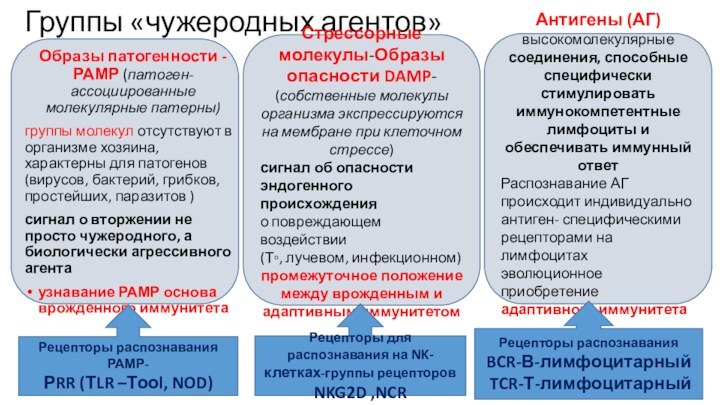
молекул отсутствуют в организме хозяина, характерны для патогенов (вирусов,
бактерий, грибков, простейших, паразитов )
сигнал о вторжении не просто чужеродного, а биологически агрессивного агента
узнавание РАМР основа врожденного иммунитета
Рецепторы распознавания РАМР-
РRR (ТLR –Тооl, NOD)
Стрессорные молекулы-Образы опасности DAMP- (собственные молекулы организма экспрессируются на мембране при клеточном стрессе)
сигнал об опасности эндогенного происхождения
о повреждающем воздействии
(Т◦, лучевом, инфекционном)
промежуточное положение между врожденным и адаптивным иммунитетом
Рецепторы для распознавания на NK-клетках-группы рецепторов NKG2D ,NCR
Антигены (АГ) высокомолекулярные соединения, способные специфически стимулировать иммунокомпетентные лимфоциты и обеспечивать иммунный ответ
Распознавание АГ происходит индивидуально антиген- специфическими рецепторами на лимфоцитах
эволюционное приобретение
адаптивного иммунитета
Рецепторы распознавания
BCR-В-лимфоцитарный
TCR-Т-лимфоцитарный
Слайд 3
АНТИГЕНЫ
вещества, несущие признаки генетически чужеродной информации, способные индуцировать
на себя ИО направленный на их удаление в виде
выработки специфических антител и/или иммунных Т-лимфоцитов.
попадание в организм АГ может вызвать:
формирование иммунитета
повышенную чувствительность
иммунологическую толерантность
иммунологическую память
Характеристика АГ осуществляется с 2 позиций:
генетически чужеродный агент- участник иммунного процесса
биологический маркер организма (АГ эритроцитов, лимфоцитов, генетические маркеры)
Слайд 4
КЛАССИФИКАЦИЯ ПО ХИМИЧЕСКОЙ ПРИРОДЕ АНТИГЕНОВ
Антигены делят на сильные,
которые вызывают выраженный И.О., и слабые, при введении которых
интенсивность И.О. невелика.
Сильные антигены, как правило, имеют белковую структуру.
Слайд 5
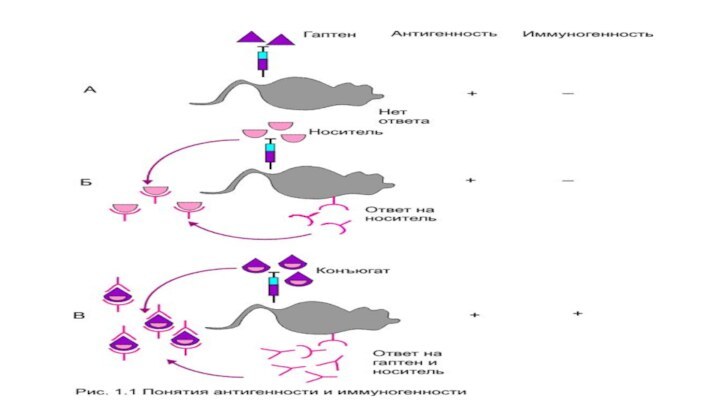
АГ должен обладать свойствами:
чужеродностью-по отношению к тому организму,
в который АГ
специфичностью- отличием от других АГ
антигенностью- способность связываться
с ВСR и ТСR
иммуногенностью-способность вызывать иммунный ответ, формировать иммунитет и/или иммунологическую память
Слайд 6
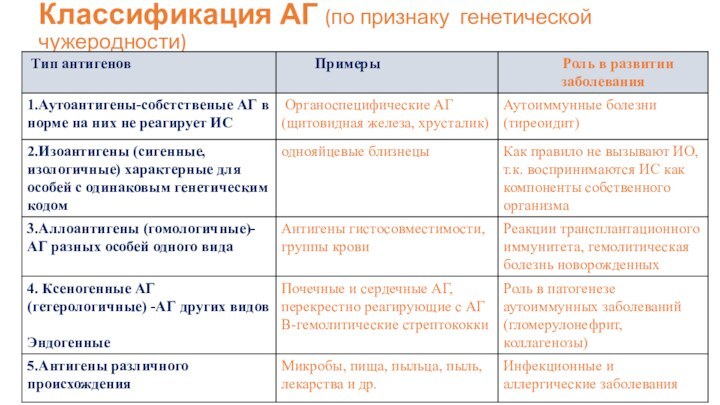
Классификация АГ (по признаку генетической чужеродности)
Слайд 7
СПЕЦИФИЧНОСТЬ-одно из наиболее важных свойств АГ
определяется структурными особенностями
АГ, отличающими его от других АГ
заключена в химической структуре
молекулы АГ(последовательности аминокислотных остатков, конформации третичной структуры белка)
эти особенности распознает иммунная система и на них будет нарабатываться иммунный ответ
Слайд 8
Строение антигена
Носитель-шлеппер
эпитопы
Растворимый АГ
Корпускулярный
АГ
высокомолекулярного носителя
низкомолекулярной антиген- детерминантной
группировки (эпитопа)
состоит из 2-х частей
Роль носителя: стабилизация стереохимической структуры
детерминанты в положении наиболее выгодном для соединения с рецепторной группой антитела
эпитоп-участок молекулы АГ, обладающий способностью связываться с активным центром АТ или АГ-распознающим Re лимфоцита
АТ специфичны именно к эпитопам, но не ко всей целостной молекуле АГ.
Слайд 9
Способность АГ запускать иммунный ответ – это
иммуногенная
активность АГ
В зависимости от иммуногенности все
АГ делят на
Полноценные
→
обеспечивают запуск
иммунного ответа
и взаимодействие с
продуктами иммунных
реакций
Неполноценные (гаптены)→
вещества не способные
вызвать иммунный ответ
самостоятельно, но могут
взаимодействовать с
продуктами иммунных
реакций
Слайд 10
Низкомолекулярные вещества , могут вызывать иммунный ответ не
сами по себе, а только образуя структурно комплексы с
биополимером носителем.
В этом качестве носителя часто выступают собственные белки или клетки организма =>
ИО на гаптен может повредить и собственные структуры
Примеры гаптенов:
-нуклеиновые кислоты (ДНК,РНК)
-лекарственные вещества (пинецилин, иод)
-некоторые неорганические вещества (бром,никель)
шлеппер
гаптен
ГАПТЕНЫ (греч.гаптейн-прикреплять).
Слайд 12
СВОЙСТВА АГ, ОПРЕДЕЛЯЮЩИЕ ЕГО ИММУНОГЕННОСТЬ :
молекулярная масса- чем
больше масса молекулы, тем более она иммуногеннна.
структура АГ
–конформационные особенности, пространственное расположение различных структур одной молекулы
доза введения АГ
малые дозы вызывают слабый ИО, средние – нормальный, большие – способствуют формированию толерантности
толерогенность – свойство АГ не воспроизводить ИО
альтернатива индукции ИО при ответе на АГ —развитие неотвечаемости. Это не просто отсутствие ответа, а активное и избирательное его подавление в отношении данного конкретного антигена.
на уровне клетки эту реакцию называют анергией, а на уровне организма —
иммунологической толерантностью
Иммунногенность можно усилить адъювантами (adiuvare –помогать ) Пример: усиление иммуногенности вакцин.
Слайд 13
В формировании ИО необходимо участие Т- и В-лимфоцитов
Активируют
непосредственно
В-л без участия Т-л (синтез IgM, и IgG2,
не формируют клетки памяти)
Классификация АГ
по способности включать в ИО разные популяции Лф
Тимусзависимые АГ
Тимуснезависимые АГ (2типа)
1 тип АГ
вызывает поликлональную активацию В-л
(липополисахарид клеточной стенки Гр(-) бактерий)
2 тип АГ
вызывает сшивание BCR, для
активации В-л требуются цитокины
(крупные полисахаридные молекулы с повторяющимися АГ-детерминантами → флагелин бактерий, декстран,фиколл)
Слайд 14
Аллергены- АГ, вызывающие выработку IgE, опосредующего аллергические реакции
Слайд 16
Главный комплекс гистосовместимости
(ГКГС,МНС, HLA)
представляет собой комплекс генов
гены
основных локусов имеют свое представительство на поверхности клетки в
виде антигена HLA.
Гены сами по себе и через кодируемые ими продукты (антигены) выполняют важные биологические функции:
генетический контроль силы иммунного ответа
взаимодействие различных клеток в динамике формирования иммунного ответа
регуляцию эмбриогенеза
Структурно гены МНС (HLA) расположены на коротком плече 6 пары хромосом человека.
Слайд 17
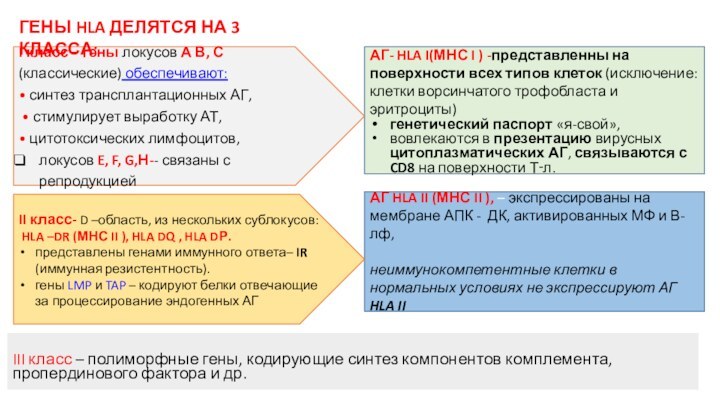
АГ HLA II (МНС II ), – экспрессированы
на мембране АПК - ДК, активированных МФ и В-лф,
неиммунокомпетентные клетки в нормальных условиях не экспрессируют АГ HLA II
II класс- D –область, из нескольких сублокусов:
HLA –DR (МНС II ), HLA DQ , HLA DР.
представлены генами иммунного ответа– IR (иммунная резистентность).
гены LMP и TAP – кодируют белки отвечающие за процессирование эндогенных АГ
АГ- HLA I(МНС I ) -представленны на поверхности всех типов клеток (исключение: клетки ворсинчатого трофобласта и эритроциты)
генетический паспорт «я-свой»,
вовлекаются в презентацию вирусных цитоплазматических АГ, связываются с CD8 на поверхности Т‑л.
I класс – гены локусов А В, С (классические) обеспечивают:
• синтез трансплантационных АГ,
• стимулирует выработку АТ,
• цитотоксических лимфоцитов,
локусов E, F, G,Н-- связаны с репродукцией
III класс – полиморфные гены, кодирующие синтез компонентов комплемента, пропердинового фактора и др.
ГЕНЫ HLA ДЕЛЯТСЯ НА 3 КЛАССА:
Слайд 18
Молекулы МНС-1 представлены двумя цепями (α и β2-микроглобулином)
Основная
функциональная - α –цепь (трансмембранный гликопротеин)
Молекулы МСН-II также представлены
двумя цепями (α и β), но в отличие от МНС-1 обе цепи трансмембранные
Слайд 19
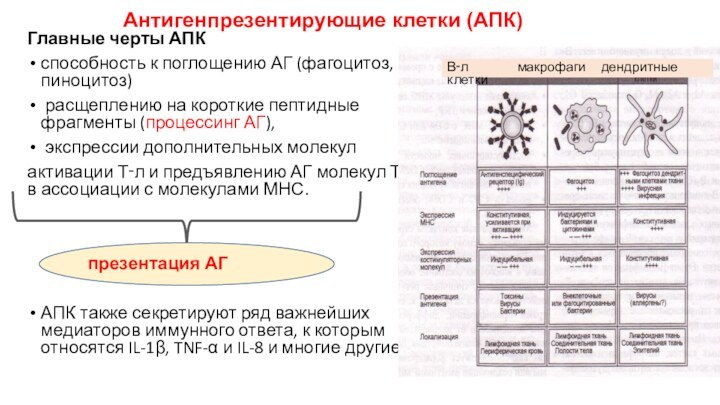
Антигенпрезентирующие клетки (АПК)
Главные черты АПК
способность к
поглощению АГ (фагоцитоз, пиноцитоз)
расщеплению на короткие пептидные фрагменты
(процессинг АГ),
экспрессии дополнительных молекул
активации Т‑л и предъявлению АГ молекул Т‑л в ассоциации с молекулами МНС.
АПК также секретируют ряд важнейших медиаторов иммунного ответа, к которым относятся IL-1β, TNF-α и IL-8 и многие другие.
В‑л макрофаги дендритные клетки
презентация АГ
Слайд 21
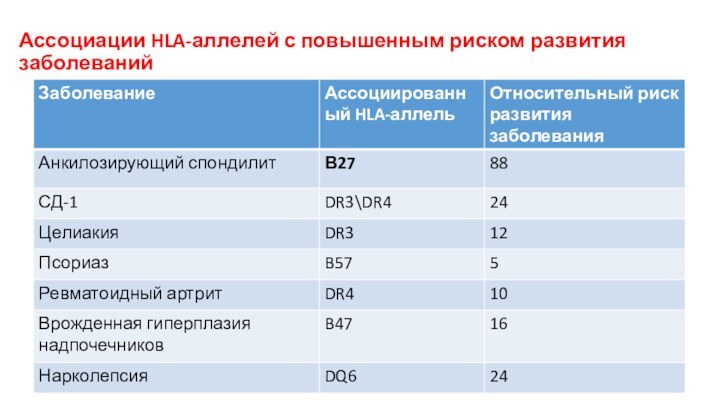
Ассоциации HLA-аллелей с повышенным риском развития заболеваний
Слайд 22
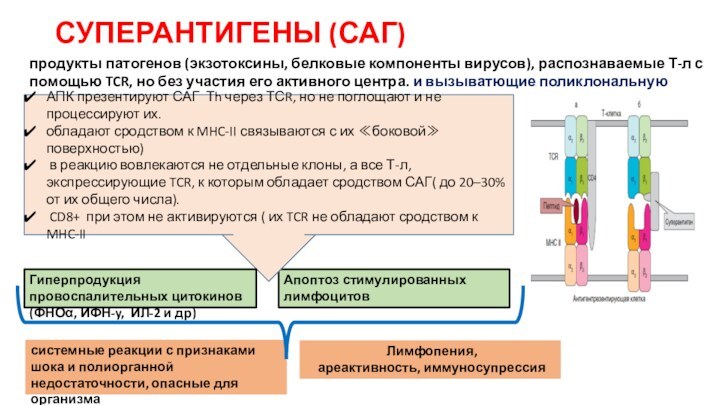
СУПЕРАНТИГЕНЫ (САГ)
продукты патогенов (экзотоксины, белковые компоненты вирусов), распознаваемые
Т-л с помощью TCR, но без участия его активного
центра. и вызыватющие поликлональную активацию этих клеток.
Апоптоз стимулированных лимфоцитов
АПК презентируют САГ Тh через ТСR, но не поглощают и не процессируют их.
обладают сродством к MHC-II связываются с их ≪боковой≫ поверхностью)
в реакцию вовлекаются не отдельные клоны, а все Т-л, экспрессирующие TCR, к которым обладает сродством САГ( до 20–30% от их общего числа).
CD8+ при этом не активируются ( их TCR не обладают сродством к MHC-II
Гиперпродукция провоспалительных цитокинов(ФНОα, ИФН-y, ИЛ-2 и др)
системные реакции с признаками шока и полиорганной недостаточности, опасные для организма
Лимфопения,
ареактивность, иммуносупрессия
Слайд 23
Идентификация лимфоидных и нелимфоидных клеток
Клетки могут быть
идентифицированы по морфологическим и функциональным критериям.
Они могут быть
опознаны (а иногда разделены) по молекулам клеточной поверхности (маркерам), против которых можно получить моноклональные антитела (Г.Кёлер, Ц.Мильстейн, 1975, 1982).
Термин "маркер" применяется для обозначения клеточных АГ, которые способны реагировать со специфическими антителами.
Сокращение CD рекомендовано ВОЗ –кластер дифференцировки
Слайд 24
АГ клеточной поверхности, выявляемые с помощью МонАТ →
называют кластерами дифференцировки (CD).
CD→ номируют по мере выявления новых
АГ
Слайд 25
Антитела
(иммуноглобулины) -
это y- глобулины, способные специфически соединяться
с антигеном.
Слайд 26
Все иммуноглобулины являются иммунными, т. е. образуются в
результате контакта с АГ
По происхождению они делятся:
• на нормальные
(анамнестические) АТ, которые обнаруживаются в любом организме как результат бытовой иммунизации;
• инфекционные АТ, которые накапливаются в организме в период инфекционной болезни;
• постинфекционные АТ, которые обнаруживаются в организме после перенесенного инфекционного заболевания;
• поствакцинальные АТ, которые возникают после искусственной иммунизации.
Слайд 27
Биологические функции антител направлены на элиминацию чужеродного антигена
из организма
распознают и связывают антиген;
представляют антиген макрофагам и лимфоцитам;
обусловливают
повреждение тканевых базофилов (тучных клеток);
лизируют клетки, содержащие чужеродные субстанции;
опсонирующее влияние;
активирует систему комплемента.
Слайд 28
Свойства антител
специфичность - способность взаимодействовать только с комплементарным
антигеном.
валентность - это количество антидетерминант в молекуле антитела; как
правило они бивалентны, хотя существуют 5- и 10-валентные антитела.
Аффинность (сродство) - прочность связи между детерминантами антигена и антидетерминантами антитела.
Авидность (жадность) характеризует прочность связи антигена с антителом в реакции антиген-антитело (определяется аффиннитетом и валентностью антигена).
Слайд 29
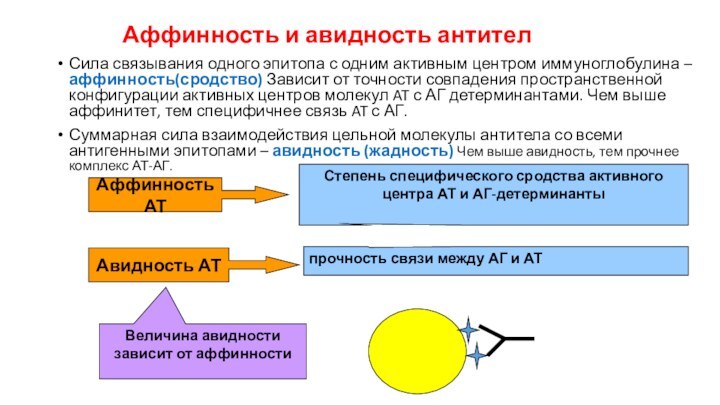
Аффинность и авидность антител
Сила связывания одного эпитопа с
одним активным центром иммуноглобулина – аффинность(сродство) Зависит от точности
совпадения пространственной конфигурации активных центров молекул AT с АГ детерминантами. Чем выше аффинитет, тем специфичнее связь AT с АГ.
Суммарная сила взаимодействия цельной молекулы антитела со всеми антигенными эпитопами – авидность (жадность) Чем выше авидность, тем прочнее комплекс АТ-АГ.
Аффинность АТ
Степень специфического сродства активного центра АТ и АГ-детерминанты
Авидность АТ
прочность связи между АГ и АТ
Величина авидности зависит от аффинности
Слайд 30
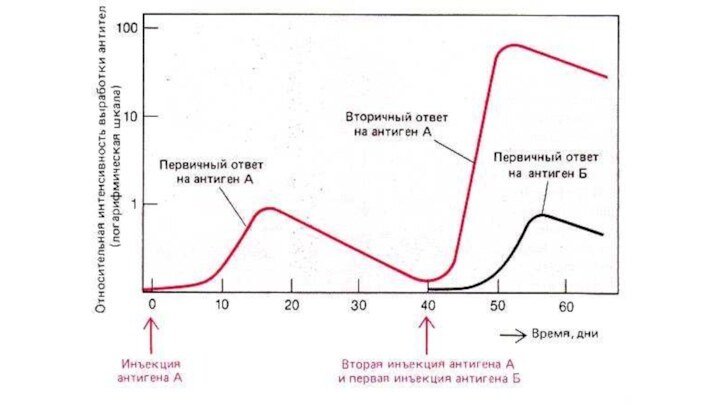
Иммунный ответ на АГ каждый раз изменяет ИС
Повторное
попадание АГ приводит к развертыванию вторичного ответа - проявление
иммунологической памяти.
При первичном ИО АТ определяются через 1-2 недели после контакта с АГ.
Их титр достигает максимума через 1-2 месяца, а затем уровень их концентрации падает (преобладают Ig М).
Повторный контакт с АГ ведет к более быстрому и мощному ответу:
АТ определяются через несколько дней, их титры достигают более высоких уровней, а падения концентрации не происходит в течение многих месяцев (преобладают IgG).
Слайд 32
Строение иммуноглобулинов
гликопротеины состоят из :
2 идентичных тяжелых цепей
(H-цепи, состоящие из доменов VH, CH1, шарнира, CH2 и
CH3 )
2 лёгких цепей (L-цепей, состоящих из доменов VL и CL).
Домены АТ - компактные структуры, скрепленные дисульфидной связью.
Виды и функции доменов:
VL-VH – связывание антигена
CL-CH1 – нековалентное соединение легкой и тяжелой цепей
Шарнирная область – обеспечение подвижности Fab фрагмента, влияние на функциональное состояние Fc фрагмента, связь тяжелых цепей.
CH2 – активация комплемента
CH3 – цитотропная активность (фиксация на клетках-мишенях)
Слайд 33
АТ можно расщепить(папаином) :
на 2 Fab -
АГ-связывающих фрагмента
Fc (фрагмент, способный к кристаллизации).
Активный центр АТ
– АГ-связывающий участок Fab-фрагмента Ig, образованный гипервариабельными участками Н- и L-цепей, связывает эпитопы АГ.
В активном центре имеются специфичные комплементарные участки к определенным АГ эпитопам
Fc-фрагмент может связывать комплемент, взаимодействует с мембранами клеток и участвует в переносе IgG через плаценту.
Слайд 34
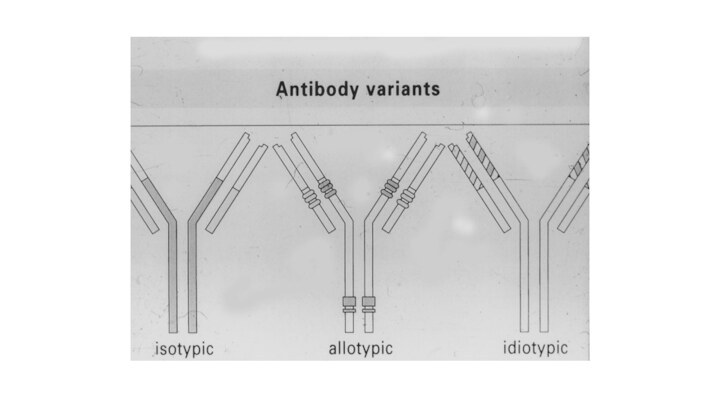
Виды антигенных детерминант иммуноглобулинов
Изотипические – отражают разнообразие
антител на уровне биологического вида (изотипы IgA, IgM, IgG,
IgD, IgE).Изотип определяется типом Н-цепи(9 изотипов:5 классов и 4 субкласса)
Аллотипические – обусловлены генетическим разнообразием внутри вида (аллотипы IgG1, IgG2, IgG3, IgG4).Обусловлены внутривидовой вариабильностью константных доменов или каркасных участков вариабельных доменов
Идиотипические – участки в антигенсвязывающем центре молекулы Ig, которые являются антигенными детерминантами.В зависимости от идиотипа АТ отличаются по специфичности,т.е имеют разное строение вариабельных доменов .Антитела против таких антигенных детерминант называются антиидиотипическими.
Слайд 35
Классификация по тяжелым цепям
Различают пять классов (изотипов) иммуноглобулинов
IgG, IgM, IgA, IgD, IgE, различающихся:
величиной
зарядом
последовательностью аминокислот
содержанием углеводов
Класс IgG классифицируют на четыре подкласса (IgG1, IgG2, IgG3, IgG4),
класс IgA — на два подкласса (IgA1, IgA2).
Все классы и подклассы составляют девять изотипов, которые присутствуют в норме у всех индивидов.
Каждый изотип определяется последовательностью аминокислот константной области тяжелой цепи.
Слайд 37
Классы иммуноглобулинов
Ig A,
Ig M,
Ig G,
Ig D,
Ig E
Слайд 38
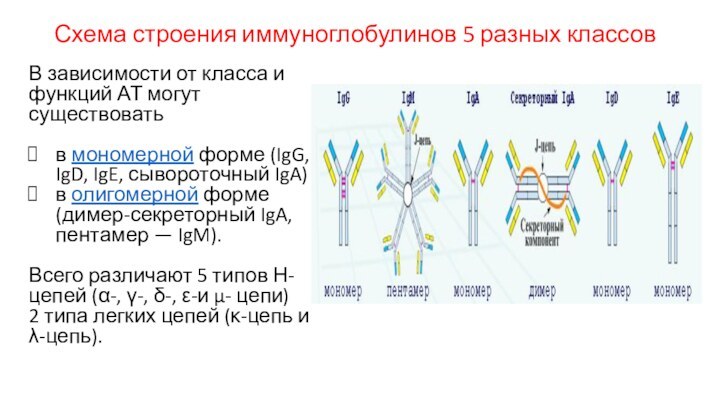
Схема строения иммуноглобулинов 5 разных классов
В зависимости от
класса и функций АТ могут существовать
в мономерной форме (IgG,
IgD, IgE, сывороточный IgA)
в олигомерной форме (димер-секреторный IgA, пентамер — IgM).
Всего различают 5 типов Н- цепей (α-, γ-, δ-, ε-и μ- цепи)
2 типа легких цепей (κ-цепь и λ-цепь).
Слайд 39
Ig М (иммуноглобулин М) –
макроглобулин, пентамер,
на В-лимфоците -мономер
период полураспада 5-8 дней,
синтезируется на ранних стадиях иммунного ответа
(первичный ИО)
эффективно агглютинирует антигены: бактерии, нейтрализует вирусы
активатор классического пути комплемента
эффективный опсонин
относятся специальные АТ : холодовые агглютинины, гетерофильные АТ и изогемагглютинины.
ИО на Т-независимые АГ , по преимуществу, проявляется в синтезе IgM
составляет 10% от всех Ig ( 0,5- 2,0 г/л).
Слайд 40
Иммуноглобулин М
IgM- наиболее ранний класс антител, образующихся при
первичном попадании антигена в организм
Наличие IgM- антител к соответствующему
возбудителю свидетельствует о свежем инфицировании (текущем инфекционном процессе)
Антитела к антигенам грамотрицательных бактерий, жгутиковым антигенам- преимущественно IgM- антитела.
IgM- основной класс иммуноглобулинов, синтезируемых у новорожденных и младенцев.
IgM у новорожденных- это показатель внутриутробного заражения (краснуха, ЦМВ, токсоплазмоз и другие внутриутробные инфекции), поскольку материнские IgM через плаценту не проходят.
Слайд 41
Ig G (иммуноглобулин G) –
имеет 4 подкласса: IgG1,
IgG2, IgG3, IgG4,
период полураспада 24 дня
обеспечивает защиту от микроорганизмов
и токсинов
единственный класс АТ- нейтрализатор токсинов.
важный противовирусный и противобактериальный фактор
потенциальный опсонин
главный участник вторичного ИО
активирует компоненты комплемента
проникает через плаценту(пассивный иммунитет новорожденным от 3 до 6 месяцев.)
составляет 75% от всех Ig( от 8 до 17 г/л)
Слайд 42
Подклассы IgG
В зависимости от типа тяжёлой цепи,
IgG подразделяются на 4 подкласса: IgG1–IgG4
IgG1 (70%) > IgG2
(20%) > IgG3 (6%) і IgG4 (4%)
Структура шарнирного участка заметно отличается у представителей различных подклассов иммуноглобулина G (наиболее длинный – у IgG3, самый короткий – у IgG2.
В целом, гибкость и подвижность частей молекулы относительно друг друга у подклассов иммуноглобулина G снижается в ряду:
IgG3 > IgG1 > IgG4 > IgG2
Слайд 43
Функции подклассов IgG
наиболее активен подкласс IgG3, шарнирная область
которого обеспечивает молекуле антител максимальное число степеней свободы
По
способности взаимодействовать с С1q на первом месте стоит подкласс IgG3
У человека подклассы IgG 1,3,4 способны активно проникать через плаценту в организм плода, создавая пассивный иммунитет
IgG2 человека играет ключевую роль в инактивации инкапсулированных бактерий
Слайд 44
Трансплацентарный перенос различных подклассов IgG
Единственный Ig, проникающий через
плаценту с помощью плацентарного FcRn-Re для IgG (защищает от
катаболима IgG) в III-триместре беременности
Обеспечивает ребенка противоинфекционной защитой в течение нескольких месяцев после рождения (до наступления момента достаточного синтеза собственных IgG)
Недоношенные дети имеют высокий риск развития инфекций в постнатальном периоде
За исключением IgG-2 все подклассы IgG эффективно транспортируются к плоду
Материнский IgG-2 содержит преимущественно АТ к бактериальным полисахаридам, поэтому ребенок недополучает антиполисахаридные антитела во время беременности и не синтезирует их на протяжении 2-х лет
Слайд 45
Ig A(иммуноглобулин А) –
Существует в двух формах: сывороточной
и секреторной. Период полураспада 6 суток.
Обеспечивает защиту слизистых оболочек
от инфекции.
Составляет 10-15% от всех иммуноглобулинов.
неэффективный опсонин и слабый активатор комплемента, но активный нейтрализатор бактериальных токсинов
Взаимодействие IgA с рецепторами на эозинофилах ведет к их дегрануляции - важный элемент противогельминтной защиты!
(SIgA) -содержит 2 IgA молекулы, соединенные специальной полипептидной цепью, и этот участок и называется секреторным.
Слайд 46
Понижение уровня IgA:
Приобретенная недостаточность:
Новообразования лимфатической системы,
лимфопролиферативные заболевания;
Состояние после спленэктомии;
Потери белка при энтеро-
и нефропатиях;
Лечение иммунодепрессантами, цитостатиками;
Облучение ионизирующей радиацией;
Злокачественные анемии, гемоглобинопатии;
Атопический дерматит
Врожденная недостаточность:
Агаммаглобулинемия (болезнь Брутона);
атаксия-телеангиэктазия (синдром Луи -Бар);
Другие причины:
Длительная экспозиция с бензолом, толуолом, ксилолом;
Прием декстрана, метилпреднизолона, эстрогенов, карбамазепина, вальпроевой кислоты, препаратов золота
Слайд 47
Повышение уровня IgA:
Синдром Вискотта - Олдрича
Хронические
гнойные инфекции, особенно желудочно-кишечного тракта и дыхательных путей (астма,
туберкулез);
Аутоиммунные заболевания, например, ревматоидный артрит (ранние стадии);
Множественная миелома (IgA - тип);
Муковисцидоз;
Бессимптомная моноклональная (IgA) гаммапатия;
Хронические поражения печени (гепатит, цирроз);
Энтеропатии;
Алкоголизм;
Слайд 48
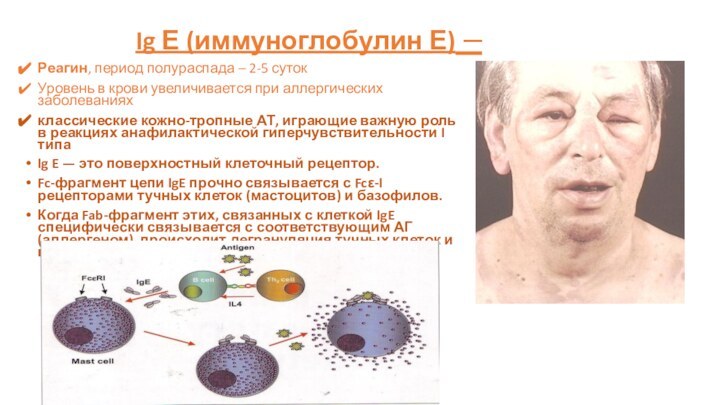
Ig Е (иммуноглобулин Е) –
Реагин, период полураспада –
2-5 суток
Уровень в крови увеличивается при аллергических заболеваниях
классические кожно-тропные
АТ, играющие важную роль в реакциях анафилактической гиперчувствительности I типа
Ig E — это поверхностный клеточный рецептор.
Fc-фрагмент цепи IgE прочно связывается с Fcε-I рецепторами тучных клеток (мастоцитов) и базофилов.
Когда Fab-фрагмент этих, связанных с клеткой IgE специфически связывается с соответствующим АГ(аллергеном), происходит дегрануляция тучных клеток и высвобождение медиаторов анафилаксии.
Слайд 49
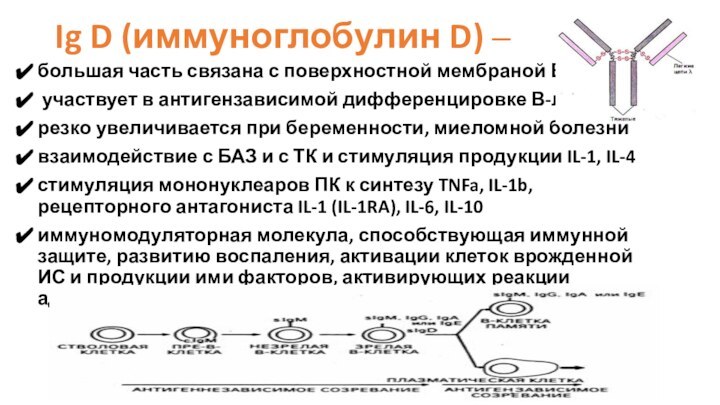
Ig D (иммуноглобулин D) –
большая часть связана с
поверхностной мембраной В-л,
участвует в антигензависимой дифференцировке В-л
резко увеличивается
при беременности, миеломной болезни
взаимодействие с БАЗ и с ТК и стимуляция продукции IL-1, IL-4
стимуляция мононуклеаров ПК к синтезу TNFa, IL-1b, рецепторного антагониста IL-1 (IL-1RA), IL-6, IL-10
иммуномодуляторная молекула, способствующая иммунной защите, развитию воспаления, активации клеток врожденной ИС и продукции ими факторов, активирующих реакции адаптивного иммунитета.
Слайд 50
Моноклональные антитела и их использование в медицине
В 1975
году Георгом Кёлером и Цезарем Мильштейном разработална методика получения
клеточных гибридов - гибридом. Гибридомы (гибридные опухолевые клетки) образуются в результате слияния лимфоцитов, взятых от иммунизированных животных, с клетками миеломы костного мозга, культивируемыми in vitro.
Слайд 51
МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА
настоящее время методами биотехнологии и/или генной инженерии
получают иммуноглобулины-антитела, продуцируемые одним клоном клеток- моноклональные антитела
Их
продуценты — клетки-гибридомы, являющиеся потомками, полученными при скрещивании В-лимфоцита (ПК) с опухолевой клеткой.
От плазматической клетки-гибридома наследуется способность к синтезу АТ, а от опухолевой клетки — способность длительно культивироваться вне организма.
Слайд 52
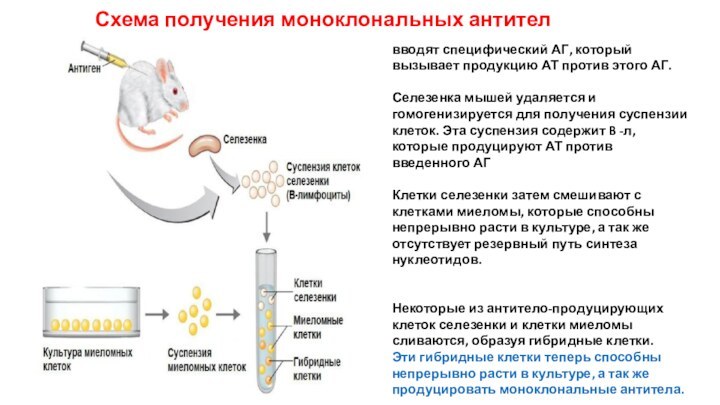
Схема получения моноклональных антител
вводят специфический АГ, который вызывает
продукцию АТ против этого АГ.
Селезенка мышей удаляется и гомогенизируется
для получения суспензии клеток. Эта суспензия содержит B -л, которые продуцируют АТ против введенного АГ
Клетки селезенки затем смешивают с клетками миеломы, которые способны непрерывно расти в культуре, а так же отсутствует резервный путь синтеза нуклеотидов.
Некоторые из антитело-продуцирующих клеток селезенки и клетки миеломы сливаются, образуя гибридные клетки.
Эти гибридные клетки теперь способны непрерывно расти в культуре, а так же продуцировать моноклональные антитела.
Слайд 53
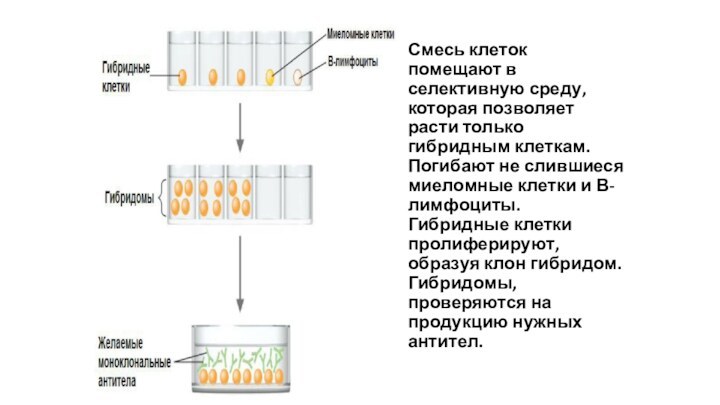
Смесь клеток помещают в селективную среду, которая позволяет
расти только гибридным клеткам.
Погибают не слившиеся миеломные клетки
и В-лимфоциты.
Гибридные клетки пролиферируют, образуя клон гибридом. Гибридомы, проверяются на продукцию нужных антител.
Слайд 54
Области применения моноклональных антител
идентификация субпопуляций лимфоцитов человека
выделение клеток
установление
функций молекул клеточной поверхности
определение группы крови
диагностика опухолей и локализация
опухолей
иммунорадиометрический анализ
анализ сложных смесей антигенов (диагностика вирусных , бактериальных, паразитарных инфекций)
анализ эмбрионального развития
анализ иммунного ответа
искусственные ферменты.
Слайд 55
Идентификация субпопуляций лимфоцитов человека
На определении CD антигенов
на клетках основана идентификация различных и их клеток субпопуляций
(Проточная цитометрия).
Диагностика опухолей и локализация опухолей
Можно обнаружить АГ, характерные для опухолей определенных тканей, получить к ним антитела и использовать их для диагностики и типирования опухолей.
С помощью моноклональных антител в опухоль и ее метастазы можно доставить радиоактивные вещества, позволяющие обнаружить небольшие узелки опухоли по локализации в них радиоактивности если их связать с изотопом.
Слайд 56
Применение моноклональных антител в диагностике (рекции АГ-АТ)
Реакция
агглютинации
Моноклональные антитела (цоликлоны анти-А и анти-В) - применяют для
определения агглютиногенов эритроцитов групповой и резус принадлежности ЭР.
Они обладают высокой чувствительностью, характеризуются быстротой наступления и четкостью агглютинации.
Обеспечивают достоверный результат даже при слабой экспрессии антигенов.
Циклоны применяются для типирования эритроцитов всех специфичностей, включая редкие.
Иммуноферментный анализ (ИФА)
ИФА- лабораторный иммунологический метод качественного определения и количественного измерения антигенов и антител (диагностика инфекций).
В основе ИФА лежит принцип специфического взаимодействия между антигеном и соответствующим ему мон-АТ.
Слайд 57
Терапевтические моноклональные антитела
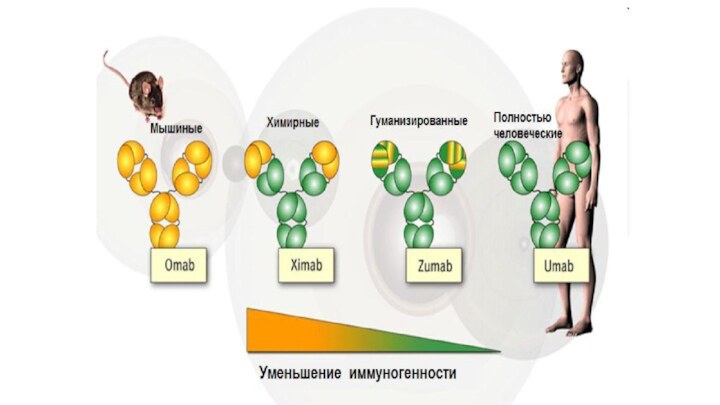
Ученые сумели принудить клетки грызунов к
выработке АТ с человеческими Fc-фрагментами (химерные АТ)
Константная часть мышиных
АТ замещена соответствующей константной областью Ig человека и в своей структуре имеют более 65% человеческого Ig.
Гуманизированные моноклональные антитела – до 95% состоят из человеческого иммуноглобулина.
Трансгенные технологии (фаговый дисплей) были использованы для создания полностью человеческих моноклональных антител
Моноклональные антитела -высокоспецифичны к определенным мишеням -АГ
Использование моноклональных антител в качестве терапевтических агентов стало для медицины стратегическим этапом в смене концепции лечения – от неспецифической к специфической (таргетной) терапии.
Слайд 58
Препараты на основе мон-АТ
оканчиваются на
«–mab» (от monoclonal
antibody).
Химерные антитела получили окончание
«-ximab»
Гуманизированные антитела имеют
окончание
«-zumab»
Полностью человеческие антитела имеют окончание
– «-umab».
Слайд 60
1975
1986
1985
1990
1995
2000
2005
1994
1997
2005
1975
Гибридомная технология
(Kohler & Milstein)
MuromabCD3,
Orthoclone
(Johnson & Johnson)
Химерные рекомбинантные
(Morrison et
al.)
Гуманизиро-ванные
(Jones et al.)
Трансгенные человеческие
(Lonberg et al.)
ЭВОЛЮЦИЯ ТЕРАПЕВТИЧЕСКИХ МКАТ
ELISA
IFA
2006
Слайд 61
Наиболее изученными являются следующие противоопухолевые препараты на основе
Мон-АТ:
Трастузумаб (Trastuzumab, Герцептин) -избирательно связывается с рецептором HER2
на поверхности опухолевых клеток многих солидных опухолей, радикально изменило лечение рака молочной железы;
Ритуксимаб (Ритуксан, Мабтера) - это химерное моноклональное антитело, имеющее вариабельный мышиный и константный человеческий регион, специфически связанное с антигеном CD20 на В-лимфоцитах и инициирующее иммунологические реакции, которые опосредуют лизис В-клеток. В последние годы препарат зарегистрирован еще для лечения широкого круга аутоиммунных заболеваний с гиперфункцией В-клеток.
Слайд 62
Алемтузумаб (Кампат, Кэмпас, Campath) – гуманизированное МКА, связывающееся
с CD52 на мембране большинства зрелых нормальных и опухолевых
Т- и В-лимфоцитов
Отмечена высокая активность алемтузумаба в отношении хронического лимфолейкоза и Т-клеточных лимфом.
В последние годы Кэмпас используется для уменьшения реакции «трансплантат против хозяина» при аллогенной трансплантации стволовых кроветворных клеток (им предварительно очищают трансплантат).
Слайд 63
Другой подход использования МкАТ - конъюгаты МкАТ к
опухолевым антигенам с токсинами, которые получили название – иммунотоксины.
К мон-АТ пришиваются (конъюгируются) токсины бактериального или растительного происхождения.
Получается конструкция из специфичного к опухолевому антигену Мон-АТ) и вещества способного убить клетку самой опухоли и ее метастазов.
Мон-АТ стали применяться для доставки цитотоксических веществ непосредственно к опухолевым клеткам, что позволяет избежать повреждения здоровых тканей.
Слайд 64
Терапевтические мон-АТ, действие которых направлено на воспалительный процесс
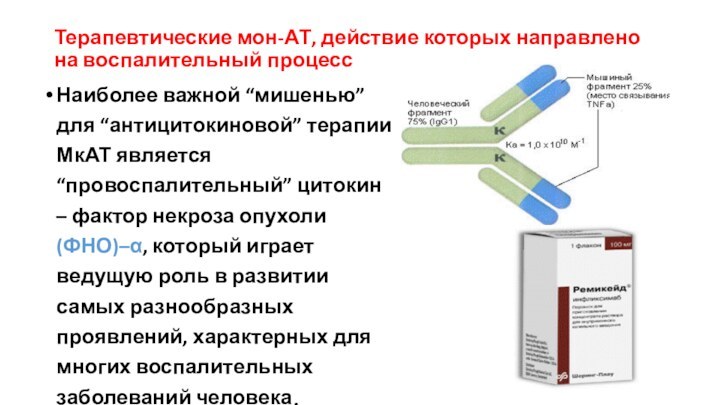
Наиболее
важной “мишенью” для “антицитокиновой” терапии МкАТ является “провоспалительный” цитокин
– фактор некроза опухоли (ФНО)–α, который играет ведущую роль в развитии самых разнообразных проявлений, характерных для многих воспалительных заболеваний человека.
Слайд 65
МКАТ – НОВАЯ ЭРА В ТЕРАПИИ
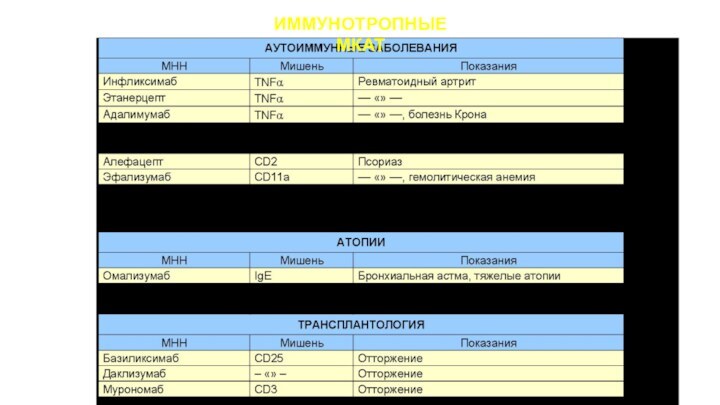
ПОКАЗАНИЯ:
Онкологические
заболевания
Аутоиммунные заболевания и атопии
Отторжение трансплантата
Инфекции
Воспаление
различного генеза (анти-TNFa, анти-CXCL10, анти-PDGF-D,
анти-С’5)
Системный склероз (анти-TGFb1), идиопатический фиброз легких (анти-TGFb), пневмосклероз (анти-CTGF)
Сердечно-сосудистая патология (анти-gp IIb/IIIa)
Остеопороз (анти-RANKL)
Гиперпаратиреоидизм (анти-PtH)
Мышечная дистрофия (анти-GDF-8)
Болезнь Альцгеймера (AZD3102)