- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Электрохимия. Гальванические цепи. (Лекция 6.2)
Содержание
- 2. Потенциометрический метод анализа основан на использовании зависимости ЭДС электрохимической цепи от активности анализируемого иона.Потенциометрический метод анализа
- 3. Потенциометрический метод анализаЭлектрод сравненияИндикаторный электродК потенциометруЭлектрохимические цепи
- 4. Потенциометрический метод анализаAgAgClKCl(нас.) Хлорсеребряный электрод – электрод сравненияСхема электрода:Ag, AgCl KCl(нас.)
- 5. Потенциометрический метод анализаСтеклянная мембранаХлорсеребряный электродБуферный раствор
- 6. Потенциометрический метод анализа
- 7. Потенциометрический метод анализа Виды потенциометрического
- 8. Потенциометрический метод анализа Техника титрования: заполнение
- 9. Потенциометрический метод анализаТехника титрования
- 10. Потенциометрическое титрованиеVT, мл Интегральная кривая
- 11. Потенциометрическое титрованиеpH pH щелочного раствораpH т.э.
- 12. Потенциометрическое титрованиеПостроение интегральной кривой
- 13. Потенциометрическое титрование В этом диапазоне pH изменяется незначительно из-за незначительного изменения H+ ионов.
- 14. Потенциометрическое титрование В этом диапазоне pH изменяется незначительно из-за незначительного изменения концентрации OH--ионов.
- 15. Потенциометрическое титрование
- 16. Потенциометрическое титрование
- 17. Потенциометрическое титрование18.2 мл 9,1 мл 5.2
- 18. Потенциометрический метод анализа Дифференциальная кривая
- 19. Потенциометрический метод анализа Количественные расчеты
- 20. Направление окислительно-восстановительных процессовОкислительно-восстановительный процесс будет протекать в
- 21. Направление окислительно-восстановительных процессов Оx(1) + Red(2)
- 22. Часто вместо таких полупар рассматривают
- 23. Направление окислительно-восстановительных процессов Потенциал электрода, измеренный
- 24. Направление окислительно-восстановительных процессовОx + Н2
- 25. Направление окислительно-восстановительных процессов Окислительно-восстановительный процесс протекает
- 26. Направление окислительно-восстановительных процессовЧем выше значение стандартного электродного
- 27. Ряд red-ox потенциалов: Полуреакция
- 28. Направление окислительно-восстановительных процессовНапример:Сd2+ + 2e-
- 29. Направление окислительно-восстановительных процессовПервая система является системой восстановителя.
- 30. Направление окислительно-восстановительных процессовСуммарное уравнение реакции:Cd0 - 2e-
- 31. Направление окислительно-восстановительных процессовГальваническая цепь:Cd0 Сd2+
- 32. Направление окислительно-восстановительных процессовCd2+ (р) + 2e-
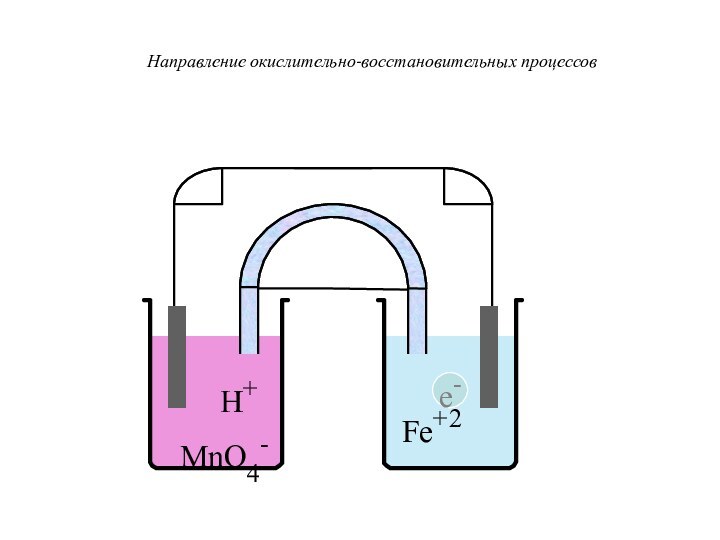
- 33. Направление окислительно-восстановительных процессов Например:MnO4- +
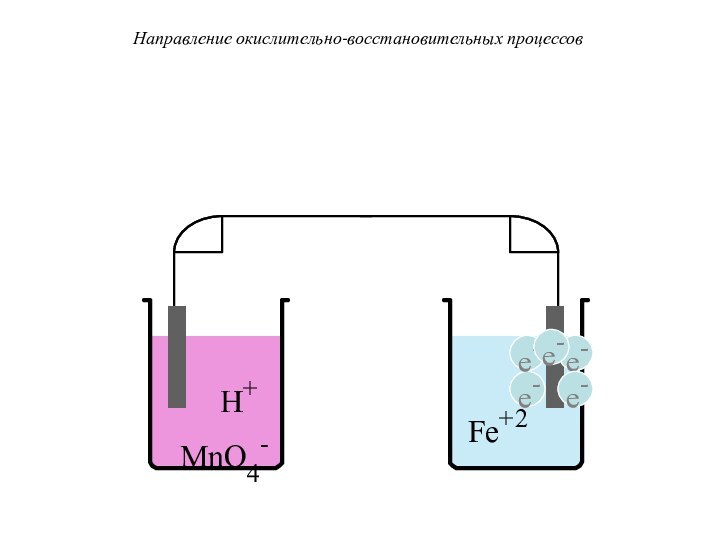
- 34. H+MnO4-Fe+2Направление окислительно-восстановительных процессов
- 35. H+MnO4-Fe+2Направление окислительно-восстановительных процессов Солевой мостик
- 36. H+MnO4-Fe+2Направление окислительно-восстановительных процессов
- 37. H+MnO4-Fe+2Пористый дискНаправление окислительно-восстановительных процессов
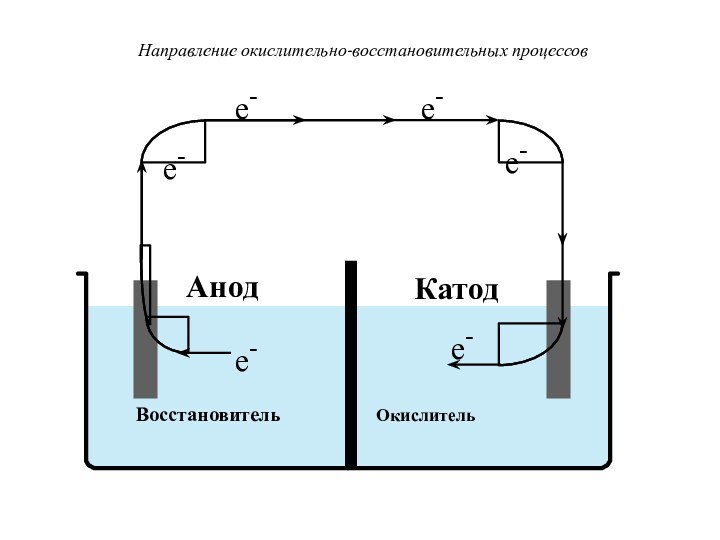
- 38. ВосстановительОкислительe-e-e-e-e-e-АнодКатодНаправление окислительно-восстановительных процессов
- 39. Направление окислительно-восстановительных процессовПервая система является системой окислителя.
- 40. Направление окислительно-восстановительных процессов Суммарное уравнение
- 41. Направление окислительно-восстановительных процессов
- 42. В гальванических элементах протекают необратимые реакции: их
- 43. К: 2Н2 + ОН– + 4е– =
- 44. Практическое использование гальванических элементов батарейкааккумуляторКатодАнодСепараторАнодЭлект-ролитКатод
- 45. Источник тока+-Инертные электродыe-e-Батарейка(-)(+)
- 46. Химические процессы при электролизе расплава хлорида натрия, NaCl?Na+Cl-
- 47. +-Источник токаNa (l)Электродная полуреакцияЭлектродная полуреакцияЭлектролиз NaClNa+Cl-Cl-Na+Na+Na+ +
- 48. +-Источник токаe-e-NaCl (l)(-)(+)Катод:Анод:Электролиз NaClNa+Cl-Cl-Cl-Na+Na+Na+ + e- ? Na2Cl- ? Cl2 + 2e-
- 49. Электродные процессыКатод (-) ВОССТАНОВЛЕНИЕ Na+ +
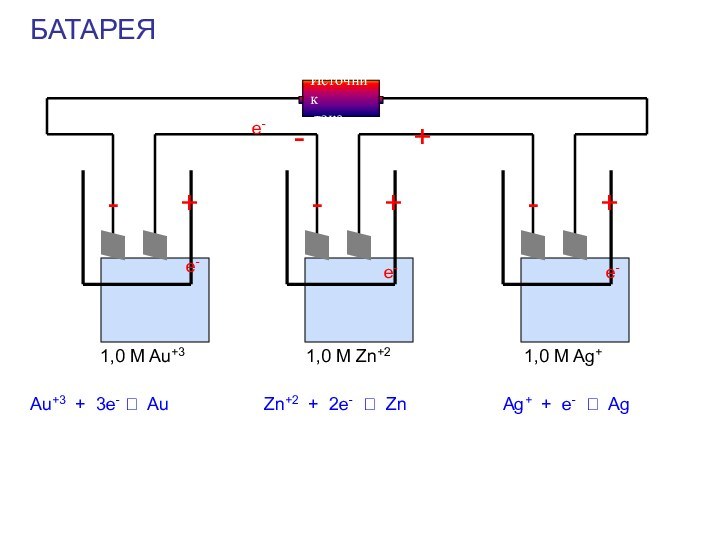
- 50. БАТАРЕЯ-++++---1,0 M Au+31,0 M Zn+21,0 M Ag+Au+3
- 51. Вопросы для самоконтроляСформулируйте правило «правого плюса».Укажите области
- 52. Скачать презентацию
- 53. Похожие презентации










































Слайд 2
Потенциометрический метод анализа
основан на использовании зависимости
ЭДС
электрохимической цепи
Слайд 3
Потенциометрический метод анализа
Электрод сравнения
Индикаторный электрод
К потенциометру
Электрохимические цепи содержат
два электрода:
электрод определения
(индикаторный) и электрод
сравнения.
Слайд 4
Потенциометрический метод анализа
Ag
AgCl
KCl(нас.)
Хлорсеребряный электрод –
электрод сравнения
Схема
электрода:
Ag, AgCl KCl(нас.)
Слайд 7
Потенциометрический метод анализа
Виды потенциометрического анализа:
-
прямая потенциометрия, или ионометрия;
- потенциометрическое титрование.
Метод
прямой потенциометрии основан на определении концентрации иона непосредственно по измеренной ЭДС электрохимической цепи.
Слайд 8
Потенциометрический метод анализа
Техника титрования:
заполнение кончика
бюретки
Потенциометрическое титрование основано на определении точки
эквивалентности по резкому изменению в ней ЭДС электрохимической цепи.
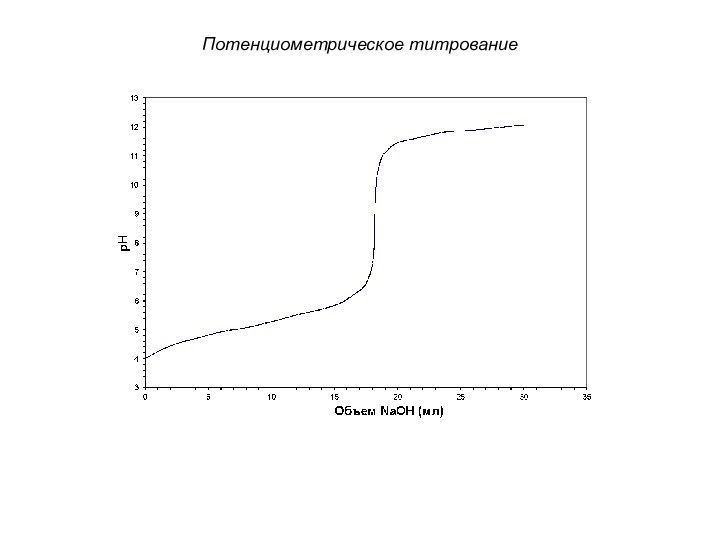
Слайд 10
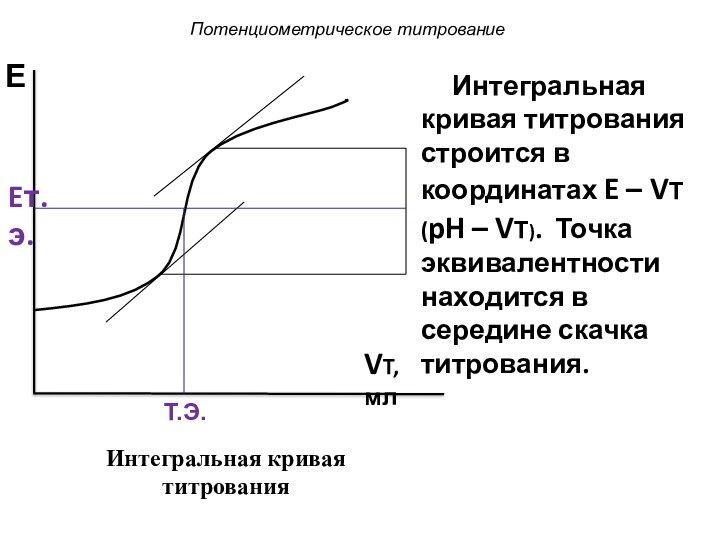
Потенциометрическое титрование
VT, мл
Интегральная кривая титрования
строится в координатах E – VТ (pH
– VТ). Точка эквивалентности находится в середине скачка титрования.E
Eт.э.
Т.Э.
Интегральная кривая титрования
Слайд 11
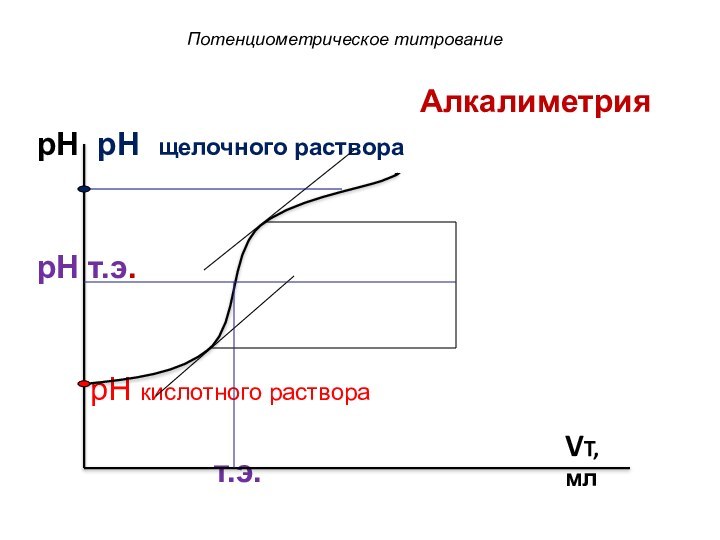
Потенциометрическое титрование
pH pH щелочного раствора
pH т.э.
pH кислотного раствора
т.э.
VT, мл
Алкалиметрия
Слайд 13
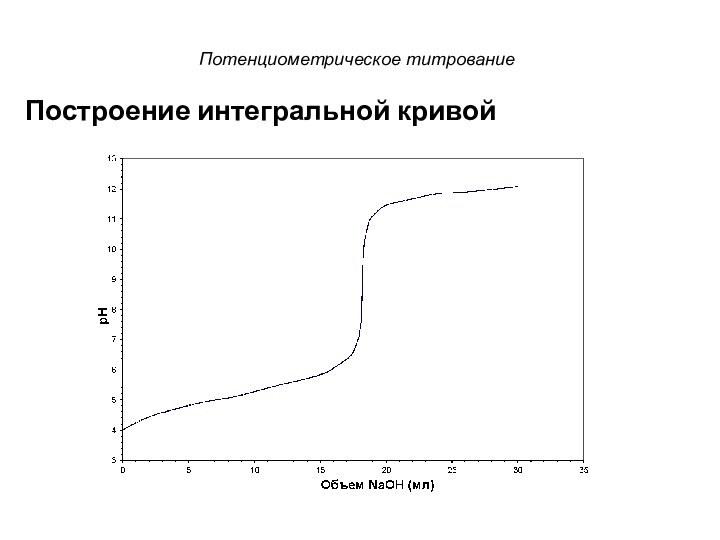
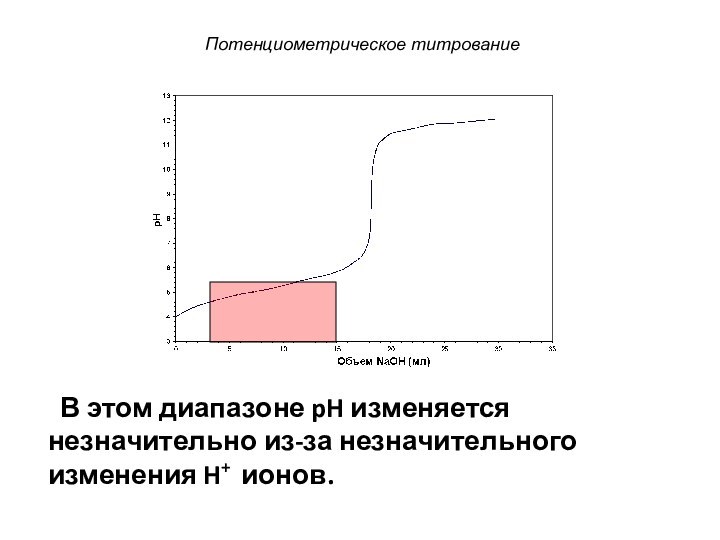
Потенциометрическое титрование
В этом диапазоне pH изменяется незначительно
из-за незначительного изменения H+ ионов.
Слайд 14
Потенциометрическое титрование
В этом диапазоне pH изменяется
незначительно из-за незначительного изменения концентрации OH--ионов.
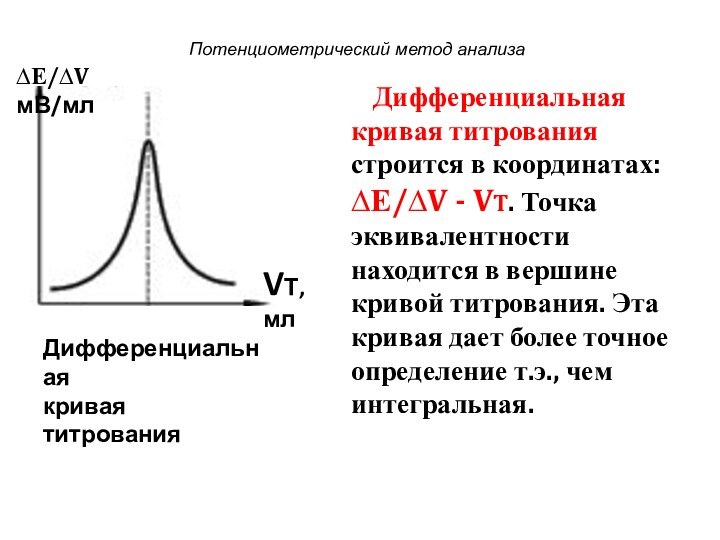
Слайд 18
Потенциометрический метод анализа
Дифференциальная кривая титрования
строится в координатах: ∆Е/∆V - VT. Точка эквивалентности находится
в вершине кривой титрования. Эта кривая дает более точное определение т.э., чем интегральная.Дифференциальная
кривая титрования
VТ, мл
∆Е/∆V мВ/мл
Слайд 19
Потенциометрический метод анализа
Количественные расчеты производят
по закону эквивалентов:
Метод потенциометрического титрования
применяют при анализе мутных, загрязненных и окрашенных растворов в смешанных и неводных растворителях.
Слайд 20
Направление окислительно-восстановительных процессов
Окислительно-восстановительный процесс будет протекать в нужном
направлении при условии, что разность электродных потенциалов будет положительной.
Слайд 21
Направление окислительно-восстановительных процессов
Оx(1) + Red(2)
Red(1) + Оx(2)
Оx(1) + n1e–
Red(1) Red(2) – n2e– Оx(2)
Ox(1)/Red(1) Оx(2)/Red(2)
φ1 φ 2
Е = φ1 – φ2
Е > 0 →
Е < 0 ←
φ1 - окислительная полупара
φ2 - восстановительная полупара
Окислительно-восстановительную систему можно расчленить на две полупары:
Слайд 22 Часто вместо таких полупар рассматривают две
полуреакции, в которые включают не только атомы, изменяющие свою
степень окисления, но и взаимодействующие с ними ионы Н+ и ОН-. Любая полупара, играющая в одной о/в реакции роль окислительной, может в другой реакции играть роль восстановительной.Направление окислительно-восстановительных процессов
Слайд 23
Направление окислительно-восстановительных процессов
Потенциал электрода, измеренный в
стандартных условиях (T= 298K, P= 1 атм, ап.о.и. =1M)
по отношению к стандартному водородному электроду, называется стандартным или окислительно-восстановительным (φ°).H+ Pt (H2)
Нормальный
водородный электрод
Слайд 24
Направление окислительно-восстановительных процессов
Оx + Н2
Red + 2Н+
Е° = φ°(Оx/Red) – φ°(Н+/1/2Н2)
= φ°(Оx/Red) Данные стандартного потенциала полуреакции восстановления φ° приведены в справочниках.
Слайд 25
Направление окислительно-восстановительных процессов
Окислительно-восстановительный процесс протекает в
прямом направлении до конца при любых начальных условиях, если
Е > 0,4 В.
Слайд 26
Направление окислительно-восстановительных процессов
Чем выше значение стандартного электродного потенциала
φ0, тем выше у данной полупары окислительная способность, т.е.
на этом электроде будет протекать процесс восстановления (+ е-). На электроде с более отрицательным значением φ0 протекает процесс окисления (- е-). У такой полупары выше восстановительная способность.
Слайд 27
Ряд red-ox потенциалов:
Полуреакция
BrO3− + 5H+ + 4e HBrO + 2H2O 1,45 HBrO + H+ + 2e Br− + H2O 1,33
ClO4− + 8H+ + 8e Cl− + 4H2O 1,3
ClO4− + 4H2O + 8e Cl− + 8OH− 0,56
Повышение восст. способности
Повышение окисл. способности
φ°, В
Направление окислительно-восстановительных процессов
Слайд 28
Направление окислительно-восстановительных процессов
Например:
Сd2+ + 2e-
Cd0,
IO3- + 6H+ + 6e-
I- + 3Н2О,
Слайд 29
Направление окислительно-восстановительных процессов
Первая система является системой восстановителя. На
этом электроде будет протекать процесс отдачи электронов (процесс окисления):
Cd0 - 2e- Сd2+Вторая система – система окислителя. На этом электроде будет протекать процесс присоединения электронов (процесс восстановления): IO3- + 6H+ + 6e- I- + 3Н2О
Слайд 30
Направление окислительно-восстановительных процессов
Суммарное уравнение реакции:
Cd0 - 2e-
Сd2+
3IO3- + 6H+ + 6e- I- + 3Н2О 1
3Cd0 + IO3- + 6H+ 3Сd2+ + I- + 3Н2О
Слайд 31
Направление окислительно-восстановительных процессов
Гальваническая цепь:
Cd0 Сd2+
IO3-, H+ Pt
I-
Е = φ° IO3-/I- - φ° Сd2+/Cd0 = 1,085 – (-0,4) = 1,485 В
Е ˃ 0, процесс возможен.
Слайд 32
Направление окислительно-восстановительных процессов
Cd2+ (р) + 2e-
Cd (т) φ0 = -0,40
ВCd2+ - окислитель,
Cr - восстановитель
Aнод (окисление):
Катод (восстановление):
x 2
x 3
Е = -0,40 – (-0,74)
Е = 0,34 В
Cr3+ (р) + 3e- Cr (т) φ0 = -0,74 В
Например:
Слайд 33
Направление окислительно-восстановительных процессов
Например:
MnO4- + 8H+ + 5e-
Mn+2 + 4H2O,
φ0 MnO4-, H+/Mn+2 = 1,51
В Fe+3 + e- Fe+2, φ0 Fe+3/Fe+2 = 0,77 В
Слайд 38
Восстановитель
Окислитель
e-
e-
e-
e-
e-
e-
Анод
Катод
Направление окислительно-восстановительных процессов
Слайд 39
Направление окислительно-восстановительных процессов
Первая система является системой окислителя. На
этом электроде будет протекать процесс присоединения электронов (процесс восстановления):
MnO4- + 8H+ + 5e- Mn+2 + 4H2O
Вторая система – система восстановителя. На этом электроде будет протекать процесс электронов (процесс окисления):
Fe+2 - e- Fe+3
Слайд 40
Направление окислительно-восстановительных процессов
Суммарное уравнение реакции:
MnO4- + 8H+
+ 5e- → Mn+2 + 4H2O 1
Fe+2
- e- → Fe+3 5MnO4-+ 8H++ 5Fe+2 → Mn+2 +5Fe+3+4H2O
Слайд 42 В гальванических элементах протекают необратимые реакции: их нельзя
перезаряжать и можно использовать однократно.
Химические источники тока, в
которых протекают обратимые реакции, называют аккумуляторами: их можно перезаряжать и использовать многократно. Практическое приложение ГЭ
Слайд 43
К: 2Н2 + ОН– + 4е– = 4Н2О
А:
О2 + 2Н2О = 4ОН–+ 4е–
Топливные элементы
е–
Етеор
= 1,229 ВЕпракт = 0,7 – 0,9 В
Слайд 44
Практическое использование гальванических элементов
батарейка
аккумулятор
Катод
Анод
Сепаратор
Анод
Элект-ролит
Катод
Слайд 47
+
-
Источник
тока
Na (l)
Электродная полуреакция
Электродная полуреакция
Электролиз NaCl
Na+
Cl-
Cl-
Na+
Na+
Na+ + e-
? Na
2Cl- ? Cl2 + 2e-
Cl2 (г) выделяется
NaCl (l)
(-)
Cl-
(+)
Слайд 48
+
-
Источник
тока
e-
e-
NaCl (l)
(-)
(+)
Катод:
Анод:
Электролиз NaCl
Na+
Cl-
Cl-
Cl-
Na+
Na+
Na+ + e- ? Na
2Cl-
? Cl2 + 2e-
Слайд 49
Электродные процессы
Катод (-)
ВОССТАНОВЛЕНИЕ Na+ + e-
? Na
Анод (+)
ОКИСЛЕНИЕ 2Cl- ? Cl2 + 2e-
Суммарная реакция:
2Na+
+ 2Cl- ? 2Na + Cl2
Слайд 50
БАТАРЕЯ
-
+
+
+
+
-
-
-
1,0 M Au+3
1,0 M Zn+2
1,0 M Ag+
Au+3 +
3e- ? Au
Zn+2 + 2e- ? Zn
Ag+ + e-
? Age-
e-
e-
e-