- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Секвенирование ДНК по Сэнгеру. Курс 3 ЦИОП Медицина будущего
Содержание
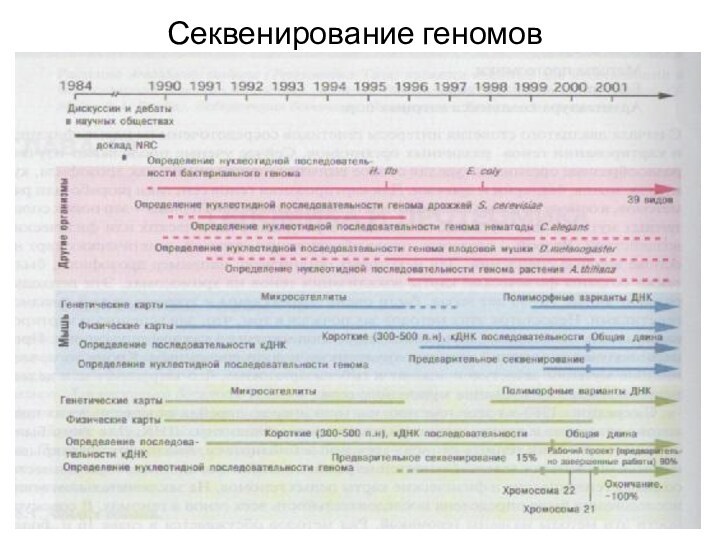
- 2. Секвенирование геномов
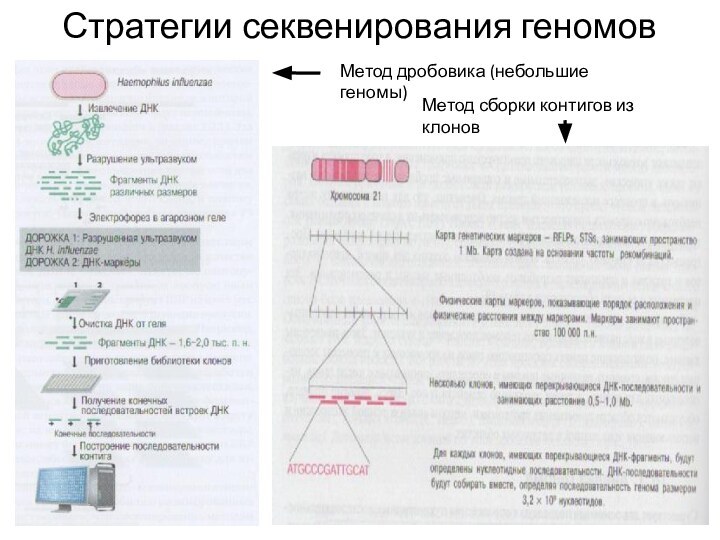
- 3. Стратегии секвенирования геномовМетод дробовика (небольшие геномы)Метод сборки контигов из клонов
- 4. Клонирование в векторную последовательность
- 5. Задачи, решаемые методом секвенирования ДНКСеквенирование – это
- 6. Кто и когда разработал методы секвенирования ДНК1953
- 7. Плюс-минус метод Сэнгера-КоулсонаРазработан к 1975 г. Сэнгером
- 8. Метод химической деградации Максама-ГилбертаМетод основан на химической деградации ДНК.
- 9. Метод основан на химической деградации ДНК. Суть
- 10. Оригинальный ферментативный метод СэнгераВ основе метода лежало
- 11. Развитие метода дидезокситерминаторовЭволюция метода СэнгераЧтение нуклеотидной последовательности
- 12. Автоматическое секвенированиеПреимущества флуоресцентных меток над изотопными: Отсутствует
- 13. Пиросеквенирование Принцип метода довольно прост и основан
- 14. Развитие сопутствующих технологий для автоматизации метода Сэнегра:
- 15. Развитие сопутствующих технологий для автоматизации метода Сэнегра:
- 16. Рутинные задачи, решаемые на капиллярных секвенаторахВысокоразрешающий капиллярный
- 17. Обзор современных капиллярных секвенаторов310 Genetic Analyzer (1
- 18. Прямая ДНК-диагностика наследственных заболеванийACA CTG CCA GTG
- 19. Последовательность действий при секвенировании по СэнгеруПолучение матрицы
- 20. Очистка ПЦР-продукта перед секвенированием
- 21. Очистка ПЦР-продукта перед секвенированием в отсутствие неспецифических
- 22. Очистка целевого ПЦР-продукта от неспецифических фрагментов с
- 23. Методы эллюции и очистки ПЦР-продукта
- 24. Проведение реакции наработки меченых фрагментов Требования
- 25. Очистка образцов после реакции секвенирования Необходимо
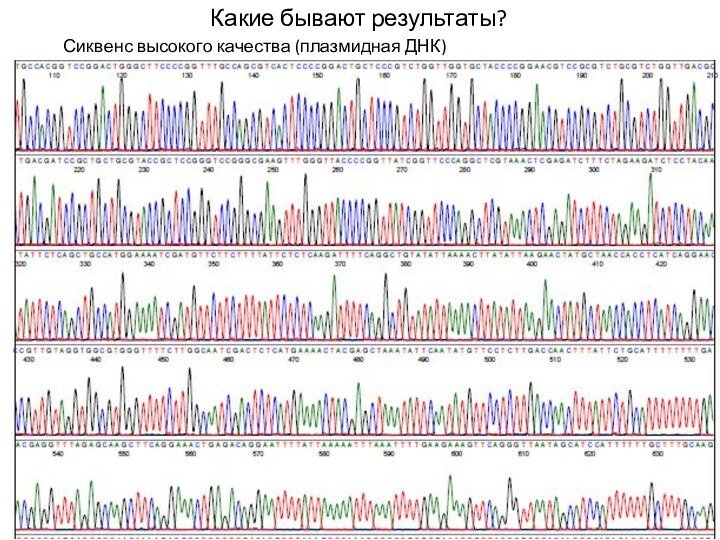
- 26. Какие бывают результаты? Сиквенс высокого качества (плазмидная ДНК)
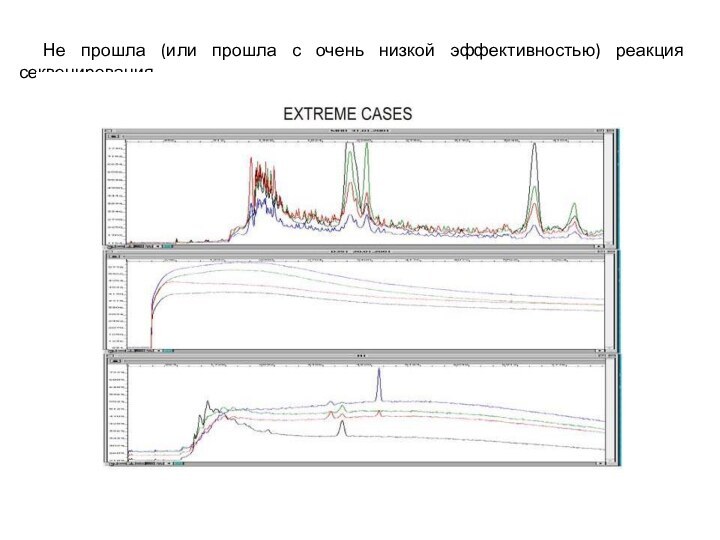
- 27. Не прошла (или прошла с очень низкой эффективностью) реакция секвенирования
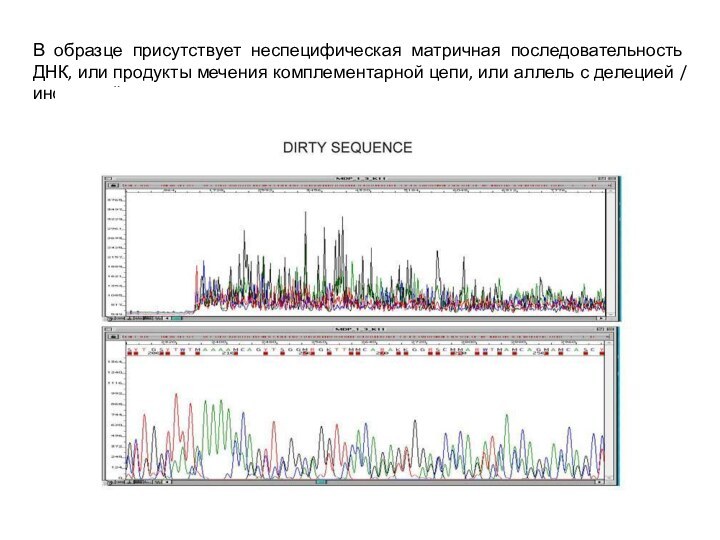
- 28. В образце присутствует неспецифическая матричная последовательность ДНК,
- 29. 1. Мало ДНК в образце, 2 и 3 – недостаточная очистка от ddNTPs после реакции секвенирования
- 30. Димеры праймеров или короткая неспецифика в образце
- 31. ABI Prizm® Sequencing Analysis Software – коммерческая
- 32. Скачать презентацию
- 33. Похожие презентации
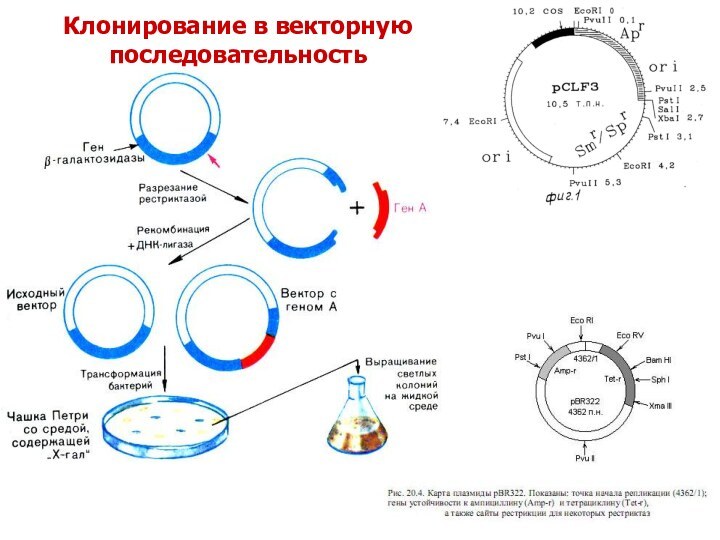

















Слайд 3
Стратегии секвенирования геномов
Метод дробовика (небольшие геномы)
Метод сборки контигов
из клонов
Слайд 5
Задачи, решаемые методом секвенирования ДНК
Секвенирование – это определение
последовательности нуклеотидов в молекуле ДНК
Зачем нужно секвенировать ДНК?
Расшифровка
генома человека- картирование генов
-выявление регуляторных элементов
-идентификация новых генетических маркеров
-эволюция человека и млекопитающих
-популяционные исследования
-дизайн праймеров для ДНК-диагностики
В повседневной практике научных и диагностических лабораторий
- идентификация патологических мутаций
-определение полиморфных вариантов
-построение карт метилирования генов-супрессоров
-проверка на различных этапах создания генно-инженерных конструкций,
при разработке контролей для тест-систем
Слайд 6
Кто и когда разработал методы секвенирования ДНК
1953 г.
– двойная спираль ДНК Д. Уотсона и Ф. Крика
(нобелевская премия в 1962 г.)1959 г. – нобелевская премия А. Корнбергу и С. Очоа за открытие механизма биосинтеза нуклеиновых кислот
1977 г. – У. Гилберт и Ф. Сэнгер опубликовали разработанные ими методы секвенирования (нобелевская премия в 1980 г.)
1978 г. – нобелевская премия В. Арберу, Г. Смиту и Д. Натансону за открытие эндонуклеаз рестрикции
1993 г. – нобелевская премия К. Мюллису за ПЦР и М. Смиту за направленный мутагенез
Слайд 7
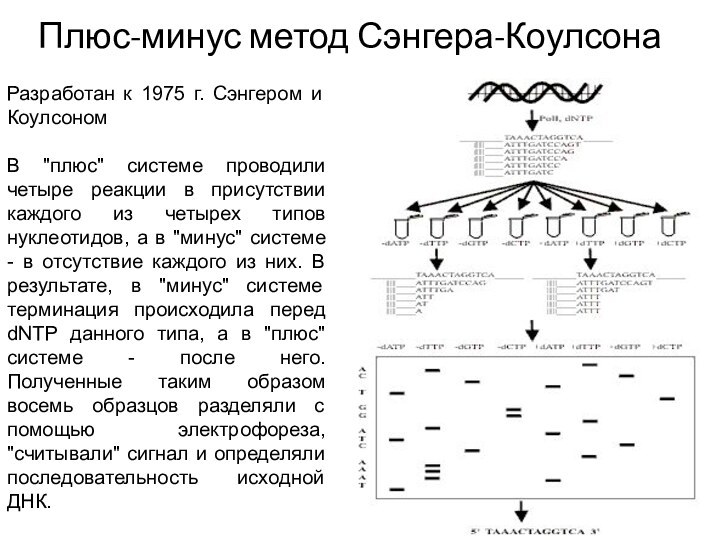
Плюс-минус метод Сэнгера-Коулсона
Разработан к 1975 г. Сэнгером и
Коулсоном
В "плюс" системе проводили четыре реакции в присутствии каждого
из четырех типов нуклеотидов, а в "минус" системе - в отсутствие каждого из них. В результате, в "минус" системе терминация происходила перед dNTP данного типа, а в "плюс" системе - после него. Полученные таким образом восемь образцов разделяли с помощью электрофореза, "считывали" сигнал и определяли последовательность исходной ДНК.
Слайд 9
Метод основан на химической деградации ДНК.
Суть метода
сводится к следующему: один из концов фрагмента ДНК метят
с помощью изотопа фосфора 32Р. В последнее время вместо радиоактивной вводят флюоресцирующую метку. Препарат меченой ДНК делят на четыре порции и каждую из них обрабатывают реагентом, специфически разрушающим одно или два из четырех оснований, причем условия реакции подбирают таким образом, чтобы на каждую молекулу ДНК приходилось лишь несколько повреждений.Разрушение идет в 2 этапа. На первом этапе происходит модификация азотистого основания и последующее выщепление его. На втором этапе производят гидролиз ДНК в местах выщепления оснований. Пуриновые основания модифицируются диметилсульфатом. Адениновые остатки метилируются по третьему атому азота, гуаниновые – по положению N7. Если такую модификацию обработать 0,1 М HCl при 0оС, то выщепляется метиладенин. При последующей инкубации в щелочной среде (0,1 М NaOH) при температуре +90оС происходит разрушение сахаро-фосфатной связи в местах выщепления оснований. Обработка поврежденных молекул пиперидином приводит к гидролизу ДНК по остаткам метилгуанина. Пиримидиновые основания модифицируются гидразином. В бессолевой среде модифицируется и цитозин, и тимин, в присутствии 2 М NaCl модифицируется только цитозин. При дальнейшей обработке пиперидином происходит расщепление ДНК по точкам модификации. В результате получается набор меченых фрагментов, длины которых определяются расстоянием от разрушенного основания до конца молекулы. Фрагменты, образовавшиеся во всех четырех реакциях, подвергают электрофорезу в четырех соседних дорожках; затем проводят радиоавтографию, и те фрагменты, которые содержат радиоактивную метку, оставляют "отпечатки" на рентгеновской пленке. По положению отпечатков можно определить, на каком расстоянии от меченого конца находилось разрушенное основание, а зная это основание - его положение. Так набор полос на рентгеновской пленке определяет нуклеотидную последовательность ДНК. Аналогично наблюдают флюоресцентное окрашивание. Если для каждого из четырех нуклеотидов был подобран свой цвет флюоресцентной метки, то при электрофорезе их наносят на 1 дорожку. Тогда расположение нуклеотидов отмечено штрихами разного цвета, а процедуру считывания легко автоматизировать.
Слайд 10
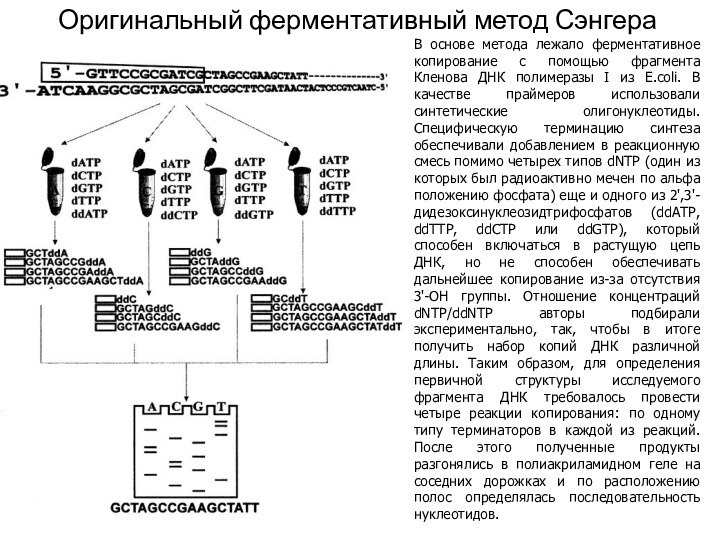
Оригинальный ферментативный метод Сэнгера
В основе метода лежало ферментативное
копирование с помощью фрагмента Кленова ДНК полимеразы I из
E.coli. В качестве праймеров использовали синтетические олигонуклеотиды. Специфическую терминацию синтеза обеспечивали добавлением в реакционную смесь помимо четырех типов dNTP (один из которых был радиоактивно мечен по альфа положению фосфата) еще и одного из 2',3'-дидезоксинуклеозидтрифосфатов (ddATP, ddTTP, ddCTP или ddGTP), который способен включаться в растущую цепь ДНК, но не способен обеспечивать дальнейшее копирование из-за отсутствия 3'-ОН группы. Отношение концентраций dNTP/ddNTP авторы подбирали экспериментально, так, чтобы в итоге получить набор копий ДНК различной длины. Таким образом, для определения первичной структуры исследуемого фрагмента ДНК требовалось провести четыре реакции копирования: по одному типу терминаторов в каждой из реакций. После этого полученные продукты разгонялись в полиакриламидном геле на соседних дорожках и по расположению полос определялась последовательность нуклеотидов.
Слайд 11
Развитие метода дидезокситерминаторов
Эволюция метода Сэнгера
Чтение нуклеотидной последовательности
Слайд 12
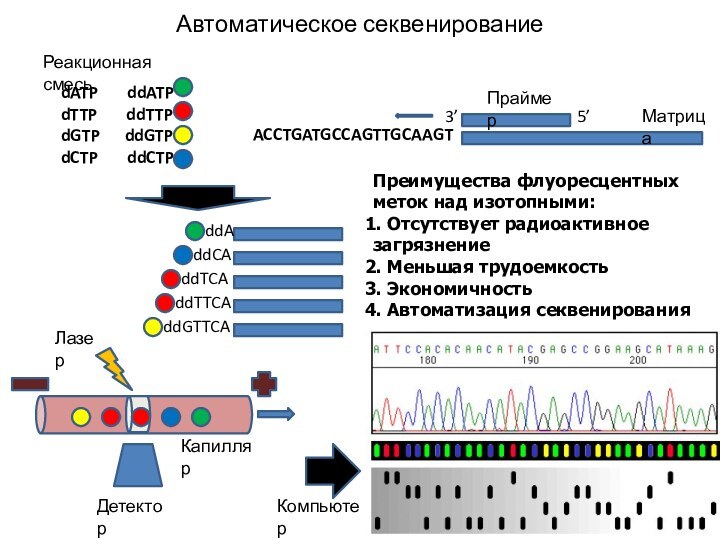
Автоматическое секвенирование
Преимущества флуоресцентных меток над изотопными:
Отсутствует радиоактивное
загрязнение
Меньшая трудоемкость
Экономичность
Автоматизация секвенирования
ACCTGATGCCAGTTGCAAGT
5’
3’
dATP
ddATPdTTP ddTTP
dGTP ddGTP
dCTP ddCTP
ddA
ddCA
ddTCA
ddTTCA
ddGTTCA
Лазер
Детектор
Компьютер
Капилляр
Праймер
Матрица
Реакционная смесь
Слайд 13
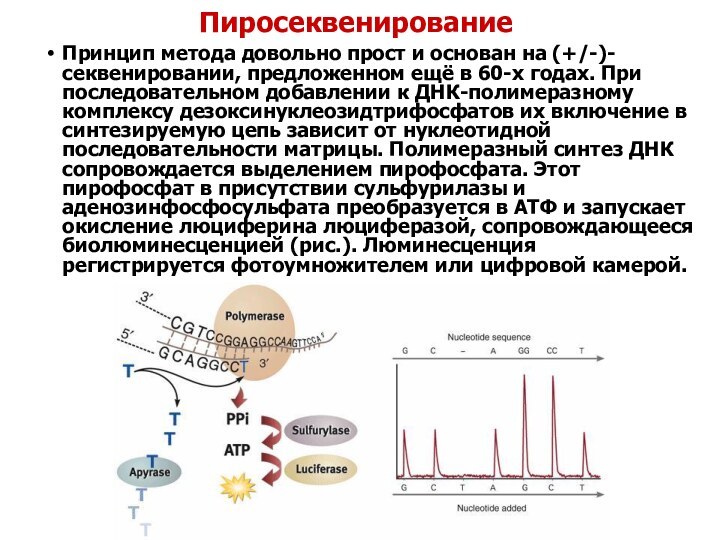
Пиросеквенирование
Принцип метода довольно прост и основан на
(+/-)-секвенировании, предложенном ещё в 60-х годах. При последовательном добавлении
к ДНК-полимеразному комплексу дезоксинуклеозидтрифосфатов их включение в синтезируемую цепь зависит от нуклеотидной последовательности матрицы. Полимеразный синтез ДНК сопровождается выделением пирофосфата. Этот пирофосфат в присутствии сульфурилазы и аденозинфосфосульфата преобразуется в АТФ и запускает окисление люциферина люциферазой, сопровождающееся биолюминесценцией (рис.). Люминесценция регистрируется фотоумножителем или цифровой камерой.Слайд 14 Развитие сопутствующих технологий для автоматизации метода Сэнегра: флуоресцентные
красители
Флуоресценция – излучение, возникающее при переходе электрона из возбужденного
состояния в основное.спектр эмиссии не зависит от длины волны возбуждения (он зависит от строения молекулы флуорофора и условий, в которых он находится – рН и т.п.)
длина волны испускания больше длины волны возбуждения из-за энергетических потерь (в секвенаторах Applied Biosystems возбуждающий и испускаемый свет находится в видимой части спектра 450-650 нм)
квантовый выход флуоресценции – важен для секвенирования (отношение числа испускаемых фотонов к числу поглощенных)
Первыми флуорофорами, адаптированными к нуждам секвенирования, стали соединения из семейства флуоресцеиновых (FAM, JOE) и родаминовых (TAMRA, ROX, R110, R6G) красителей. Следующее поколение флуорофоров этого семейства - dTAMRA, dROX, dR110, dR6G - получило довесок из двух остатков хлора. Это позволило несколько снизить перекрывание спектров испускания и значительно повысить интенсивность флуоресценции, а значит и чувствительность. Еще более высоким выходом флуоресценции характеризуются "трехкомпонентные" красители класса BigDye™ (Applied Biosystems), при конструировании которых был использован принцип переноса энергии. Под переносом энергии понимают явление безизлучательного переноса энергии возбужденного состояния от донора к акцептору. Донором в BigDye™ является 4'-аминометил-5(или 6)-карбоксифлуоресцеин, который связан с акцептором (представителем семейства d-родаминов) через остаток 4-аминометилбензойной кислоты.
Слайд 15 Развитие сопутствующих технологий для автоматизации метода Сэнегра: полимераза
и электрофорез
Полимеразы для автоматического секвенирования ДНК
В оригинальной работе Ф.
Сэнгера для проведения сиквенсовых реакций был использован Кленовский фрагмент ДНК-полимеразы I из E.Coli. В настоящее время для секвенирования используют рекомбинантные ДНК-полимеразы, отвечающие следующим требованиям: отсутствие 3'- и 5'-экзонуклеазной активности, отсутствие дискриминации по включению в растущую цепь как обычных, так и модифицированных (меченных) ddNTP. Всего существует два разных подхода. В первом случае (сейчас практически не используется) копирование осуществляется при 37°С высокопроцессивными термолабильными полимеразами (например, T7 DNA polymerase). Однако наиболее распространен второй способ - циклический процесс, который включает денатурацию, Biosystems).Гель для автоматического секвенирования и условия электрофореза
Полученные в реакции секвенирования флуоресцентно меченные одноцепочные фрагменты ДНК разделяют с помощью электрофореза в полиакриламидном геле. Гели, используемые в секвенировании должны уметь разделять фрагменты, отличающиеся друг от друга на один нуклеотид в широком диапазоне длин. Разделение должно проходить в денатурирующих условиях, препятствующих ренатурации и возникновению вторичных структур у разделяемых фрагментов. В общем случае этим требованиям удовлетворяют 5-8% полиакриламидные гели, содержащие 7М мочевину. В автоматическом секвенировании используют капиллярный электрофорез в линейном полиакриламиде. Капилляры представляют собой стеклянную трубку длинной 30-100 см, закатанную в полимерный пластификатор. Небольшой диаметр капилляра (50-100 мкм) позволяет проводить разделение значительно быстрее, чем в обычных гелях. Кроме того, капиллярные секвенаторы позволяют обеспечивать гораздо более высокую чувствительность за счет отсутствия горизонтальной диффузии.
Слайд 16
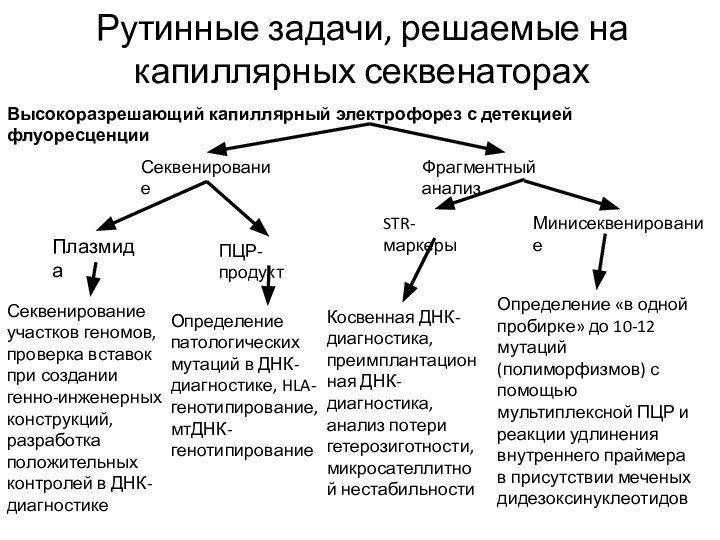
Рутинные задачи, решаемые на капиллярных секвенаторах
Высокоразрешающий капиллярный электрофорез
с детекцией флуоресценции
Секвенирование
Фрагментный анализ
Плазмида
ПЦР-продукт
STR-маркеры
Минисеквенирование
Секвенирование участков геномов, проверка вставок при
создании генно-инженерных конструкций, разработка положительных контролей в ДНК-диагностикеОпределение патологических мутаций в ДНК-диагностике, HLA-генотипирование, мтДНК-генотипирование
Определение «в одной пробирке» до 10-12 мутаций (полиморфизмов) с помощью мультиплексной ПЦР и реакции удлинения внутреннего праймера в присутствии меченых дидезоксинуклеотидов
Косвенная ДНК-диагностика, преимплантационная ДНК-диагностика, анализ потери гетерозиготности, микросателлитной нестабильности
Слайд 17
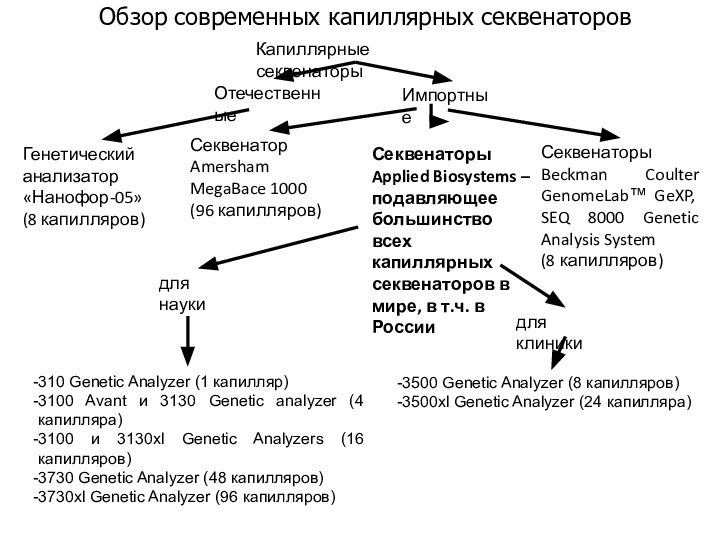
Обзор современных капиллярных секвенаторов
310 Genetic Analyzer (1 капилляр)
3100
Avant и 3130 Genetic analyzer (4 капилляра)
3100 и 3130xl
Genetic Analyzers (16 капилляров)3730 Genetic Analyzer (48 капилляров)
3730xl Genetic Analyzer (96 капилляров)
Капиллярные секвенаторы
Отечественные
Импортные
Генетический анализатор «Нанофор-05»
(8 капилляров)
Секвенатор Amersham MegaBace 1000
(96 капилляров)
Секвенаторы Beckman Coulter GenomeLab™ GeXP, SEQ 8000 Genetic Analysis System
(8 капилляров)
Секвенаторы Applied Biosystems – подавляющее большинство всех капиллярных секвенаторов в мире, в т.ч. в России
для науки
для клиники
3500 Genetic Analyzer (8 капилляров)
3500xl Genetic Analyzer (24 капилляра)
Слайд 18
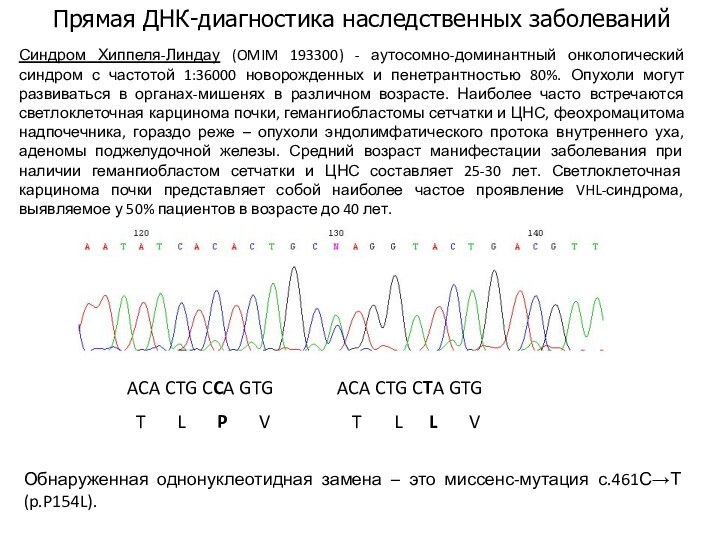
Прямая ДНК-диагностика наследственных заболеваний
ACA CTG CCA GTG
ACA CTG CTA GTG
T L P V T L L V Обнаруженная однонуклеотидная замена – это миссенс-мутация с.461С→Т(p.P154L).
Синдром Хиппеля-Линдау (OMIM 193300) - аутосомно-доминантный онкологический синдром с частотой 1:36000 новорожденных и пенетрантностью 80%. Опухоли могут развиваться в органах-мишенях в различном возрасте. Наиболее часто встречаются светлоклеточная карцинома почки, гемангиобластомы сетчатки и ЦНС, феохромацитома надпочечника, гораздо реже – опухоли эндолимфатического протока внутреннего уха, аденомы поджелудочной железы. Средний возраст манифестации заболевания при наличии гемангиобластом сетчатки и ЦНС составляет 25-30 лет. Светлоклеточная карцинома почки представляет собой наиболее частое проявление VHL-синдрома, выявляемое у 50% пациентов в возрасте до 40 лет.
Слайд 19
Последовательность действий при секвенировании по Сэнгеру
Получение матрицы для
секвенирования (ПЦР-продукт, плазмида)
Очистка матрицы от невключившихся праймеров, dNTPs и
других примесейПроведение реакции секвенирования (наработка пула фрагментов различной длины, комплементарных матричной молекуле и заканчивающихся меченым ddNTP)
Очистка продуктов реакции от невключившихся меченых ddNTPs и других примесей, которые могут влиять на подвижность и/или флуоресценцию полученных продуктов
Электрофорез меченых фрагментов в денатурирующих условиях при высоком разрешении в капиллярных генетических анализаторах и автоматическая детекция флуоресцентных сигналов
Анализ первичных данных и построение хроматограммы , идентификация мутаций или полиморфизмов.
Слайд 20
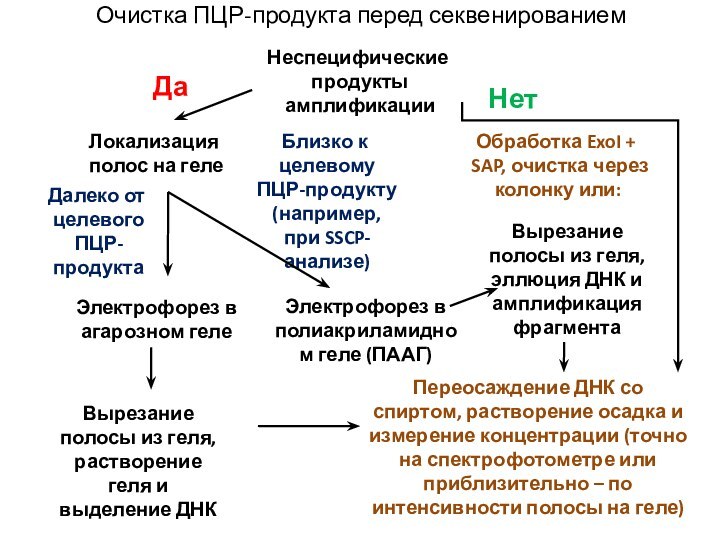
Очистка ПЦР-продукта перед секвенированием
Неспецифические
продукты амплификации
Да
Нет
Далеко от целевого ПЦР-продукта
Близко к целевому ПЦР-продукту (например, при SSCP-анализе) Электрофорез в агарозном геле
Электрофорез в полиакриламидном геле (ПААГ)
Вырезание полосы из геля, растворение геля и выделение ДНК
Вырезание полосы из геля, эллюция ДНК и амплификация фрагмента
Переосаждение ДНК со спиртом, растворение осадка и измерение концентрации (точно на спектрофотометре или приблизительно – по интенсивности полосы на геле)
Локализация полос на геле
Обработка ExoI + SAP, очистка через колонку или:
Слайд 21 Очистка ПЦР-продукта перед секвенированием в отсутствие неспецифических продуктов
амплификации
Обработка аликвоты ПЦР-продуктов смесью экзонуклеазы I
из E.coli и щелочной фосфатазыПереосаждение ПЦР-продуктов спиртом
1. После проведения ПЦР к 7 мкл реакционной смеси добавить:
0,5 мкл 10х-буфера О («СибЭнзим»)
0,5 мкл деионизованной воды
1 мкл ExoI (20 ед./мкл)
1 мкл SAP (1 ед./мкл)
Лучше заранее смешивать реактивы, вносить в пробирки, а затем добавлять к ним ПЦР-продукты и перемешивать пипетированием.
2. Инкубировать полученную смесь (объем смеси – 10 мкл) при 37°С в течение 45 мин, затем инактивировать ферменты при 85°С в течение 15 мин.
1. После проведения ПЦР к реакционной смеси добавить:
10М ацетат аммония в количестве ¼ объема исходной смеси
2-кратный объем 96%-ого этанола или 1,5-кратный объем изопропанола
Перемешать на вортексе, затем инкубировать 20 мин при -20°С.
2. Центрифугировать полученную смесь 15 мин при 12 тыс. об./мин. Удалить супернатант, не задевая осадка.
3. Высушить осадок, затем растворить его в 20-30 мкл деионизованной воды.
Слайд 22 Очистка целевого ПЦР-продукта от неспецифических фрагментов с помощью
электрофореза
Агарозный гель-электрофорез
(1,5% агарозы, 0,5х-буфер ТВЕ, 150-200
В)1. После электрофореза вырезать в проходящем УФ полосу геля с целевым ПЦР-продуктом, затем добавить связывающий буфер в соотношении 1 мкл буфера на 1 мг геля.
2. Инкубировать пробирку при 55°С в течение, примерно, 10 мин до полного растворения геля. Если длина фрагмента < 500 п.н., то добавить изопропанол в соотношении 1/3 от исходной массы полосы геля и перемешать.
3. Нанести полученную смесь (до 800 мкл) на колонку для сорбции и центрифугировать 1 мин при 12 тыс. об./мин. Еще раз нанести 100 мкл буфера и центрифугировать. Поместить колонку в новую пробирку.
4. Добавить 700 мкл отмывочного буфера и центрифугировать 1 мин при 12 тыс. об./мин.
5. Нанести в центр колонки 50 мкл отмывочного буфера, подождать 1-2 мин и центрифугировать1 мин при 12 тыс. об./мин. Отфильтрованный раствор ДНК можно использовать для секвенирования.
1. После завершения электрофореза и окраски геля вырезать скальпелем или иглой от шприца полосу с целевым ПЦР-продуктом.
2. Измельчить вырезанную полосу геля на дне пробирки 1,5 мл, затем добавить 0,5 мл буфера ТЕ (10 мМ Трис-HCl, 10 мМ ЭДТА, рН 8,0), перемешать на вортексе.
3. Инкубировать при 37°С в течение ночи (overnight), затем центрифугировать 5 мин при 12 тыс. об./мин. Перенести супернатант в новую пробирку, добавить 1/10 объема 3М ацетата натрия и 2 объема 96%-го этанола или 1,5 объема изопропанола, перемешать на вортексе и инкубировать 20 мин при -20°С.
4. Центрифугировать полученную смесь 15 мин при 12 тыс. об./мин. Удалить супернатант, не задевая осадка.
4. Высушить осадок, затем растворить его в 20-25 мкл деионизованной воды или ТЕ.
ПААГ-электрофорез
(8% ПААГ – АА:бис-АА как 19:1, 1х-буфер ТВЕ, 300-400 В)
Слайд 23
Методы эллюции и очистки ПЦР-продукта
1.
Растворение LMP-агарозы
1. Вырезать полосу геля, содержащую анализируемый ПЦР-продукт, взвесить.
Затем добавить буфер ТЕ, чтобы итоговая концентрация агарозы стала < 0,5%.2. Довести полученную смесь сухим NaCl до концентрации соли 0,1М. Далее инкубировать при 65°С в течение 10 мин, несколько раз перемешивая (пока гель полностью растворится).
3. Охладить до комнатной температуры и экстрагировать фенол-хлороформным методом.
4. Добавить 10М ацетат аммония в количестве ¼ объема исходной смеси и 2-кратный объем 96%-ого этанола или 1,5-кратный объем изопропанола. Перемешать на вортексе, затем инкубировать 20 мин при -20°С.
5. Центрифугировать полученную смесь 15 мин при 12 тыс. об./мин. Удалить супернатант, не задевая осадка. Осадок сполоснуть 70%-ым этанолом, высушить.
6. Растворить осадок в деионизованной воде или буфере ТЕ.
2. Выделение ПЦР-продукта из лунки с помощью полиэтиленгликоля.
3. Эллюция ПЦР-продукта из полосы геля с помощью диализного мешка.
и др…
График эффективности очистки на silica spin-колонках
Слайд 24
Проведение реакции наработки меченых фрагментов
Требования некоторых
лабораторий к образцам для секвенирования
«Синтол»: не менее 10 нг
матрицы (очищенный ПЦР-продукт до 500 п.н.), 10 мкл праймера в концентрации 3,2 пмоль/мкл.Центр коллективного пользования в ИМБ: очищенный ПЦР-продукт, праймер в количестве 3,2 пмоль на реакцию.
«СибЭнзим»: не менее 2 мкг очищенного ПЦР-продукта, 20 пмоль праймера (для растворов определены минимальные концентрации).
Постановка реакции:
К 3 мкл очищенного ПЦР-продукта добавить 3 мкл деионизованной воды, 2 мкл праймера для секвенирования (концентрация 5 пмоль/мкл) и 3 мкл BigDye™ Terminator v. 3.1 Kit.
Поместить образцы в термоциклер и запустить программу:
96°С – 1 мин
96°С – 10 с
55°С – 5 с
60°С – 4 мин
Охлаждение до 4°С
25 циклов
Праймера – 3,2 пмоль на реакцию, матрицы – в соответствии с таблицей
Слайд 25
Очистка образцов после реакции секвенирования
Необходимо избавиться
от:
невключившихся меченых ddNTPs
ионов, которые могут влиять на подвижность меченных
фрагментов в капилляре1. BigDye Xterminator® Purification Kit
Добавить к 10 мкл реакционной смеси 45 мкл реактива SAM, а затем 10 мкл реактива BigDye, перемешивать 30 мин при комнатной температуре.
Центрифугировать плашку 2 мин при 4 тыс. об. мин. Образцы готовы для постановки в генетический анализатор.
2. Centri-Sep™ Columns
Добавить в колонку 800 мкл деионизованной воды и оставить при комнатной температуре на 30 мин.
Центрифугировать колонку 2 мин со скоростью 3 тыс. об. мин., затем поместить колонку в новую пробирку на 1,5 мл.
Нанести на сефадекс сверху 10 мкл реакционной смеси, центрифугировать 2 мин со скоростью 3 тыс. об. мин. Отфильтрованный раствор ДНК смешать с 20 мкл HiDi-формамида (деионизованного).
3. Осаждение со спиртом
Добавить по 2 мкл 125мМ раствора ЭДТА в лунки с реакционной смесью, после того, как раствор ЭДТА достигнет дна лунок, добавить по 2 мкл 3М раствора ацетата натрия, который тоже должен достигнуть дна лунок.
Нанести в лунки по 50 мкл 100%-го этанола, перемешать, затем инкубировать при комнатной температуре 15 мин.
Центрифугировать при 4°С со скоростью 13 тыс. об. мин. в течение 30 мин.
Промыть осадок 70%-ым спиртом, подсушить.
Растворить осадок в 10 мкл деионизованной воды.
Слайд 28 В образце присутствует неспецифическая матричная последовательность ДНК, или
продукты мечения комплементарной цепи, или аллель с делецией /
инсерциейСлайд 29 1. Мало ДНК в образце, 2 и 3
– недостаточная очистка от ddNTPs после реакции секвенирования
Слайд 31 ABI Prizm® Sequencing Analysis Software – коммерческая программа
для получения и редактирования хроматограмм секвенирования, поставляется вместе с
оборудованием.Sequence Scanner. Бесплатно на сайте Applied Biosystems (www.appliedbiosystems.com)
Chromas v. 2.01. Бесплатная бета-версия на сайте разработчика www.technelysium.com.au, полная – на файлообменниках.
Chromas – старая версия, есть как файл .exe во многих лабораториях (практически бесплатно).
SeqScape – коммерческая программа Applied Biosystems для расширенного анализа полученных последовательностей.
Программы для анализа данных при секвенировании по Сэнгеру