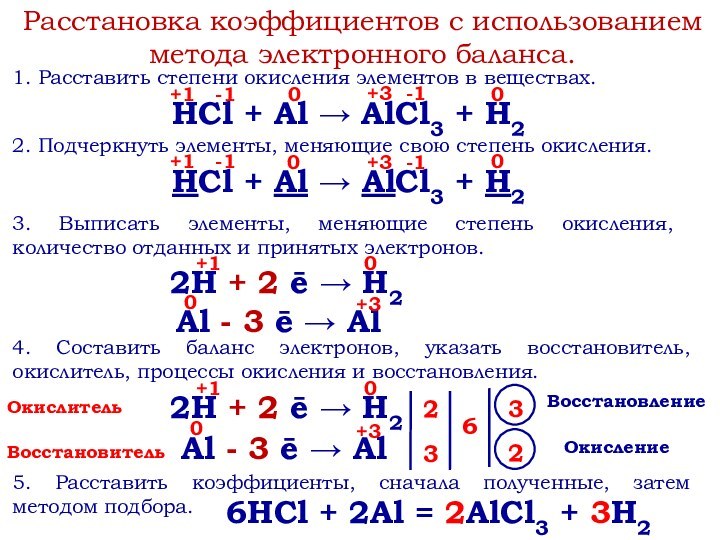
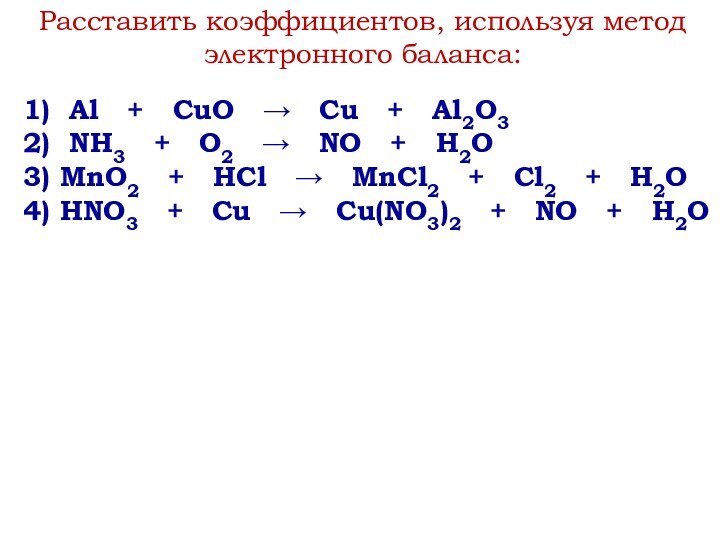
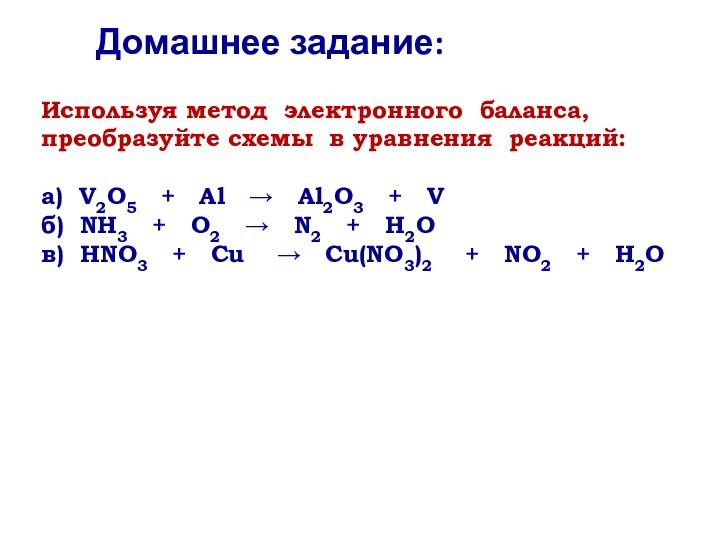
степени окисления.
ОВР – реакции, в результате которых происходят два
взаимопротивоположных процесса: отдачи электронов (окисления) и их принятия (восстановления).Окислитель – вещество, содержащее атомы или ионы, принимающие электроны.
Восстановитель – вещество, содержащее атомы или ионы, отдающие электроны.