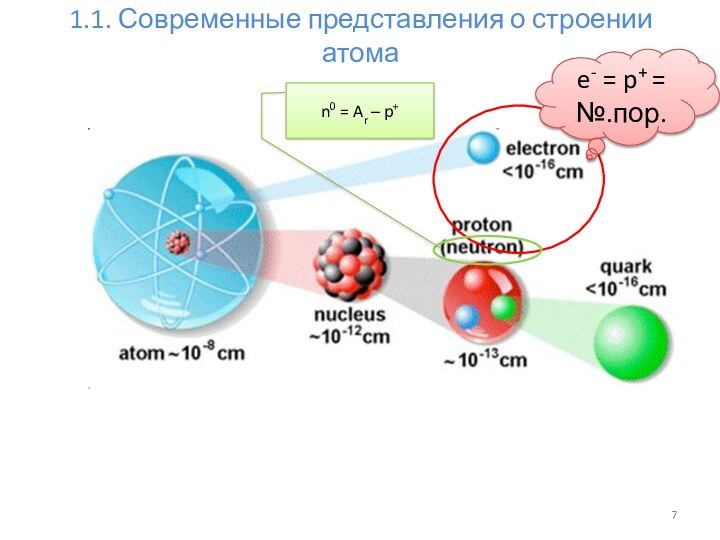
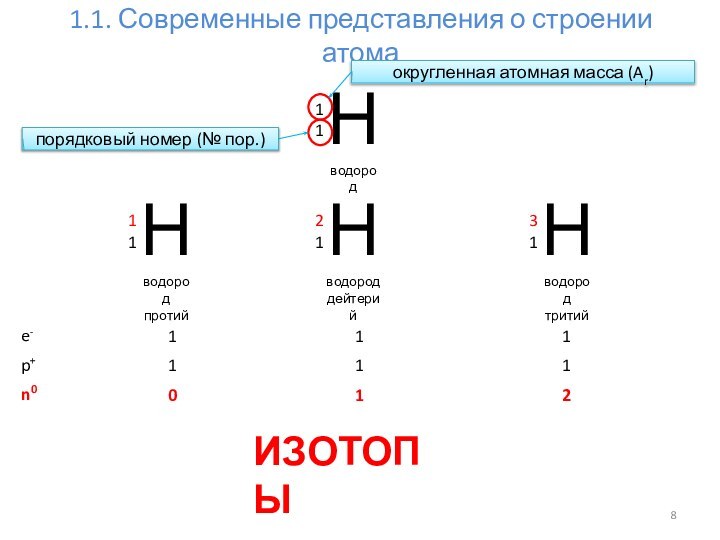
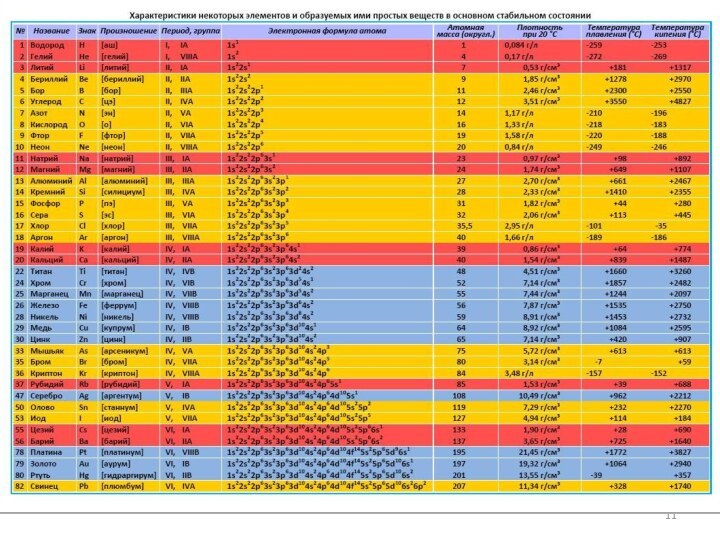
Современные представления о строении атома.
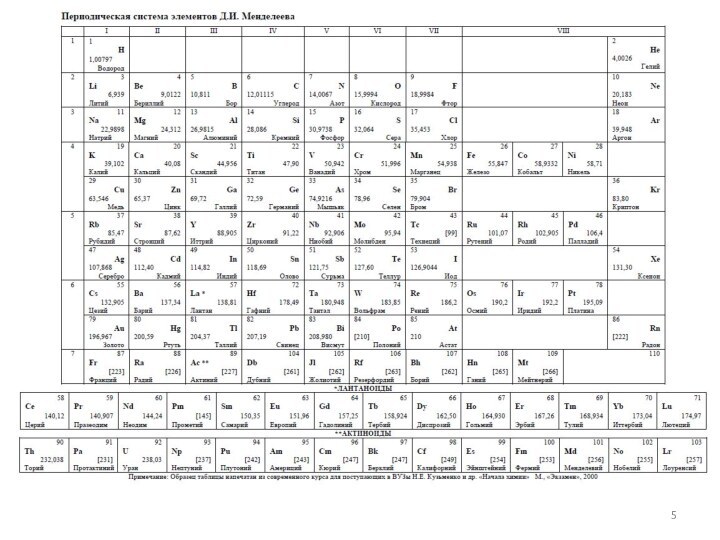
1.1.1. Строение электронных оболочек атомов
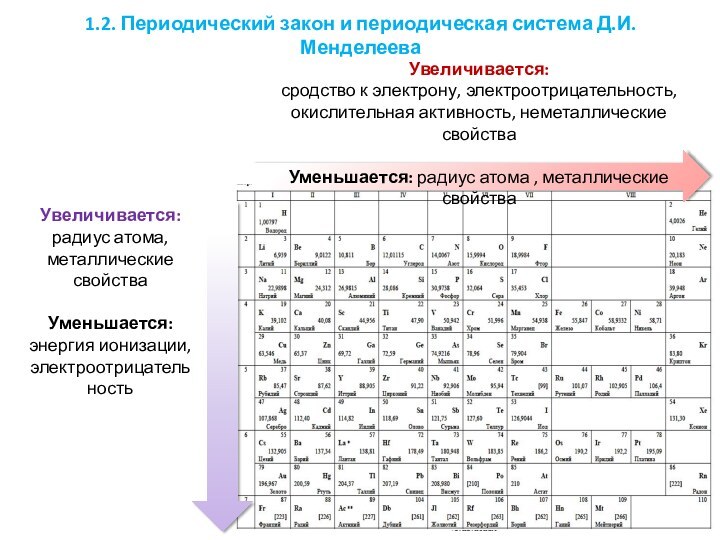
элементов первых четырех периодов: s-, p-, d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов.1.2. Периодический закон и периодическая система Д.И. Менделеева.
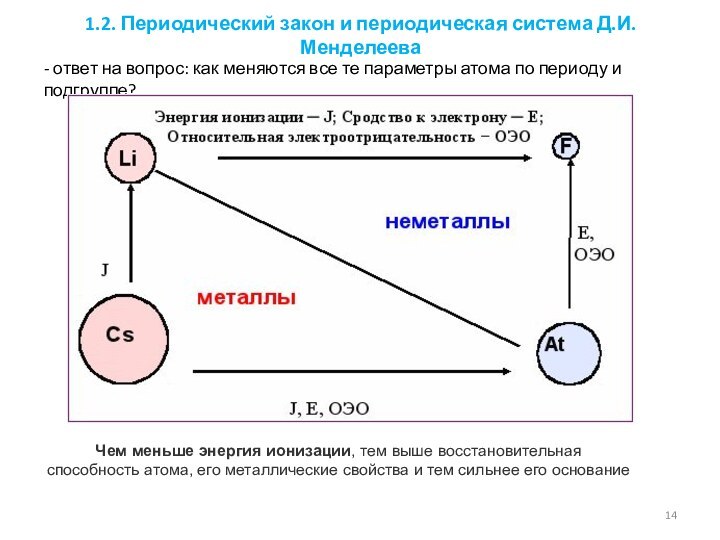
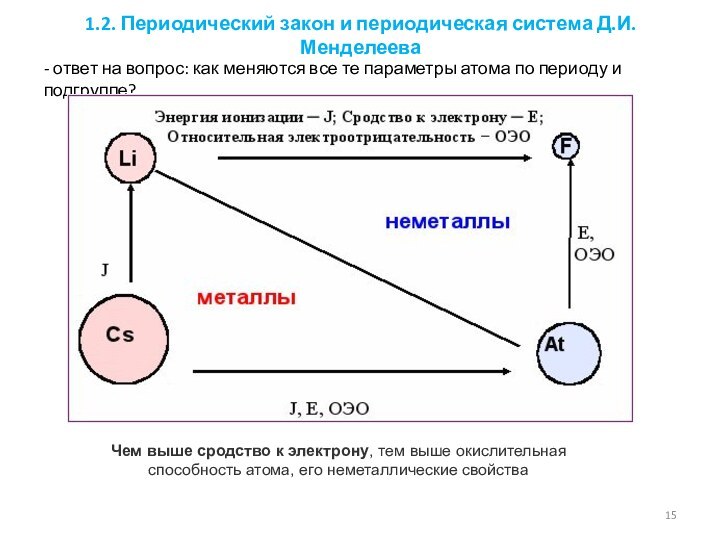
1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам.
1.2.2. Общая характеристика металлов I-III А групп в связи с их положением в периодической системе и особенности строения их атомов.
1.2.3. Характеристика переходных элементов – меди, цинка, хрома, железа по их положению в периодической системе Д.И.Менделеева и особенностям строения их атомов.
1.2.4. Общая характеристика неметаллов IV-VII А групп в связи с их положением в периодической системе Д.И. Менделеева и особенностями строения их атомов.
1.3. Химическая связь и строение вещества.
1.3.1. Ковалентная химическая связь, ее разновидности, механизмы образования. Характеристики связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь.
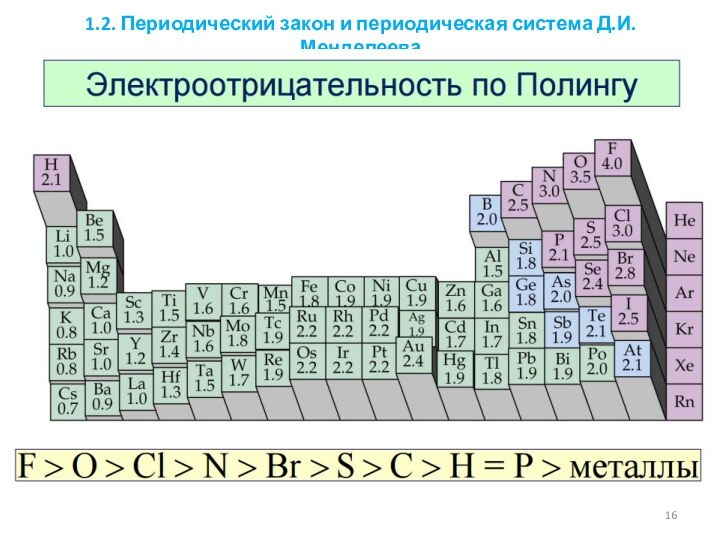
1.3.2. Электроотрицательность. Степень окисления и валентность элементов.
1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств вещества от их состава и строения.
1.4. Химическая реакция.
1.4.1. Классификация химических реакций в неорганической и органической химии.
1.4.2. Скорость реакции, ее зависимость от различных факторов.
1.4.3. Обратимые и необратимые реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов.
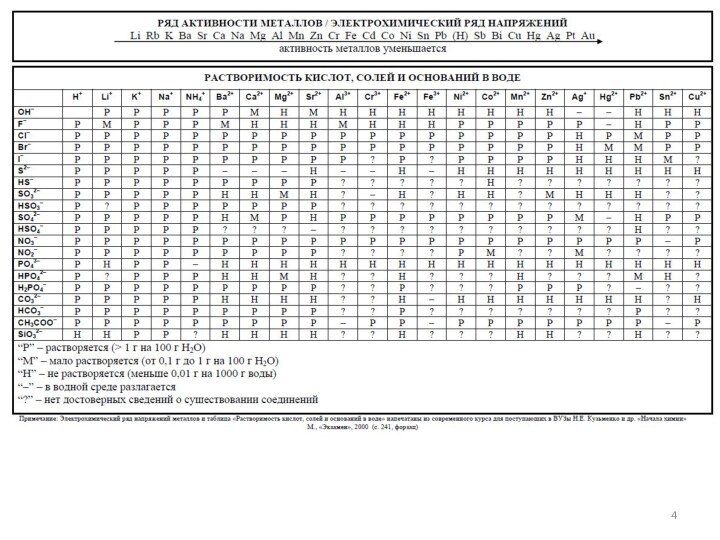
1.4.4. Реакции ионного обмена.
1.4.5. Гидролиз солей. Среда водных растворов.
1.4.6. Окислительно-восстановительные реакции. Коррозия металлов и способы защиты от нее. Окислительно-восстановительные реакции соединений марганца, хрома, пероксида водорода, азотной и серной кислот.
1.4.7. Электролиз расплавов и растворов.
Решение тренировочных задач по теме: «Теоретические основы химии».
Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей. Расчеты: объемных отношений газов при химических реакциях. Расчеты: теплового эффекта реакции. Расчеты: массовой доли (массы) химического соединения в смеси. Написание уравнений окислительно-восстановительных реакций, расстановка коэффициентов методом электронного баланса.
























![Занятие Автоматизация звуков [р] - [р'] в словах, словосочетаниях, предложениях, тексте. Дорога на вечеринку!](/img/tmb/13/1224079/42b840626e2a61a01b9efb7a544b6fba-210x.jpg)



















