Слайд 2
Тема урока:
« Углерод – основа всей живой природы»
Слайд 3
План урока
Углерод - основа всей живой природы
Паспортные данные
углерода
Станция историческая
Станция « Аллотропные модификации»
Станция химическая
Станция прикладная
Станция «Круговорот углерода
в природе»
Станция контрольная
Слайд 4
Углерод-основа всей живой природы
Углерод считается царем живой природы,
хотя в природе его находится только 0,35%.
Углерод в природе
существует в виде аллотропных видоизменений – алмаза и графита.
Соединения углерода весьма распространены в природе: все живые организмы, каменный уголь, торф, нефть, известняк, мел, мрамор и другие соединения.
Слайд 6
Паспортные данные углерода
Охарактеризуйте положение углерода в ПСХЭ.
Электронное строение
углерода.
Возможные степени окисления.
Составьте формулу высшего оксида углерода(его характер).
Составьте формулу
соответствующего гидроксида(его характер).
Формула летучего водородного соединения.
Сравните неметаллические свойства:а)углерода, кремния, германия,б)азота, углерода,кислорода.
Слайд 7
Станция историческая
Углерод является одним из первых химических элементов,
который известен человеку. С незапамятных времён человек использовал уголь
и сажу. Когда наши предки овладели огнём, а это было около 100 тысяч лет назад, они имели дело с углём и сажей.
В XVII—XVIII вв., в период расцвета теории флогистона, считали, что уголь полностью состоит из этого таинственного вещества: ведь при горении угля почти не образуется твёрдого остатка. И только A. Л. Лавуазье, изучая горение угля на воздухе и в кислороде, пришёл к выводу, что уголь — всего лишь простое вещество. Лавуазье назвал новый элемент Carboneum
Слайд 8
Станция «Аллотропные модификации углерода»
Слайд 9
АЛМАЗ
(греч. «адамас» –
твёрдый, непреклонный )
как аллотропное видоизменение
углерода
Слайд 10
Кристаллическая решётка – атомная
Кристаллизуется в кубической кристаллической решётке.
Каждый атом окружен четырьмя такими же атомами, располагающимися по
вершинам тетраэдра. Расположение атомов таково, что каждый из них окружен четырьмя равноотстоящими ближайшими атомами — тетраэдр. На одну ячейку приходится восемь атомов. Все атомы относятся к одной правильной системе точек. Междоузлия представляют собой тетраэдрические пустоты.
Из всех простых веществ алмаз имеет максимальное число атомов, приходящихся на единицу объёма – атомы упакованы очень плотно.
Слайд 11
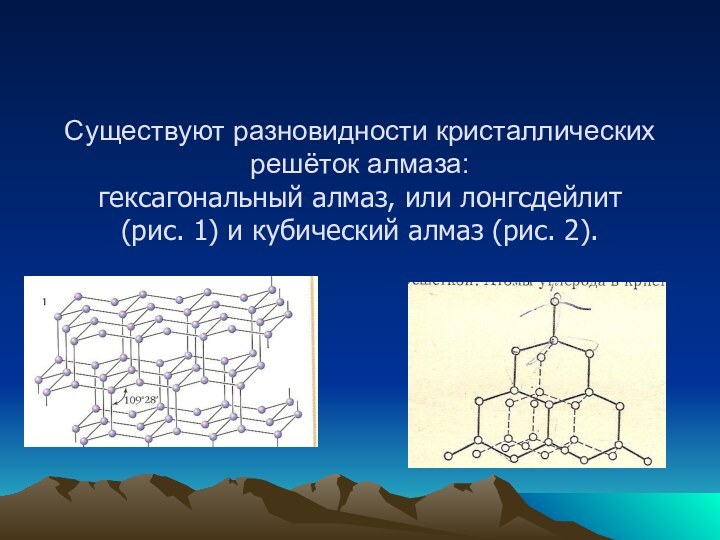
Существуют разновидности кристаллических решёток алмаза:
гексагональный алмаз, или лонгсдейлит
(рис. 1) и кубический алмаз (рис. 2).
Слайд 12
Физические свойства
Одно из самых твёрдых
и тугоплавких веществ
(плотная упаковка
и прочность связей).
Хрупок – довольно легко расколоть
на части.
Очень высокая теплопроводность – проводит тепло
в несколько раз лучше, чем многие металлы
(в 4 раза лучше меди).
Не проводит электрический ток.
Слайд 13
Алмазы имеют разный цвет
Известны алмазы оранжевого, голубого, розового,
жёлтого, коричневого, молочно-белого, синего, зелёного, серого и даже чёрного
цвета. Окраска связана с дефектами
в кристаллической решётке и замещением части атомов углерода на атомы бора, азота
и даже алюминия. Серая и чёрная окраска алмазов обусловлена включениями графита.
Слайд 14
Применение основано на физических свойствах
Изготовление бриллиантов – огранённые
алмазы сильно преломляют свет.
Для резки стекла, металлов, наконечники свёрл
(«алмазные жала»), буров и резцов – благодаря твёрдости.
Алмазный порошок – для полировки и огранки драгоценных камней (рубинов) – твёрдость.
Слайд 16
Графит (от др.-греч. γράφω — записывать, писать) —
минерал из класса самородных элементов, одна из аллотропных модификаций
углерода. Структура слоистая. Слои кристаллической решётки могут по-разному располагаться относительно друг друга, слои слабоволнистые, почти плоские, состоят из шестиугольных слоёв атомов углерода. Кристаллы пластинчатые, чешуйчатые. Образует листоватые и округлые радиально-лучистые агрегаты, реже — агрегаты концентрически-зонального строения. У крупнокристаллических выделений часто треугольная штриховка ,
Слайд 17
Образуется графит в результате вулканической деятельности при высоких
температурах, поэтому и находят его в природе в магматических
горных породах, где содержание кристаллического графита может доходить до 50%. Встречается графит также совместно с вольфрамитом - в кварценосных жилах, совместно с другими минералами – в полиметаллических среднетемпературных месторождениях, а в таких метаморфических породах, как мраморы, гнейсы, сланцы, графит распространен очень широко. Крупное графитовое месторождение находится в Тунгусском каменноугольном бассейне, образовавшееся в результате высокотемпературного воздействия на уголь – так называемая скрытокристаллическая форма графита, содержание которого лежит в пределах от 60 до 80%.
Химические свойства
графита
Графит химически малоактивен: в кислотах не растворяется, с некоторыми солями и щелочными металлами образует соединения наподобие включений. С кислородом воздуха реагирует только при очень высокой температуре, образуя углекислый газ.
Слайд 19
Применение графита
Техническое применение минерала чрезвычайно разнообразно и обусловлено
свойствами графита, главным образом его огнеупорностью и электропроводностью. Так,
в металлургии графит используется для производства тугоплавких тиглей, чехлов для термопар, емкостей для кристаллизации. В литейном производстве графитовый порошок используется в качестве антипригарной присыпки, а также для смазывания литейных форм.
Из коллоидно-графитовых смесей таких как графит С-1 изготавливают шлифовальные и полировочные пасты.
Слайд 20
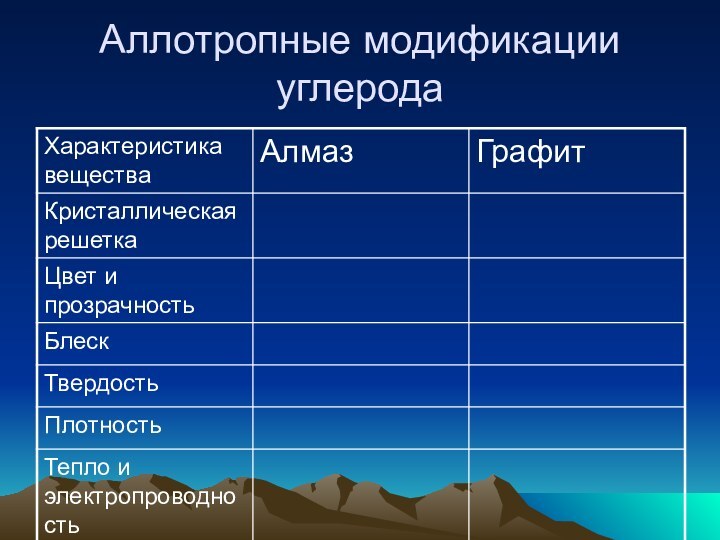
Аллотропные модификации углерода
Слайд 21
Применение активированного угля
Слайд 23
Обоснуйте истинность или заблуждение древних
1.В одном из трактатов
Плиний-старший пишет:
«Испытание производится на наковальне, на которую
кладут алмаз, по которому ударяют молотом; когда оказывается, что алмаз отталкивает молот, меж тем наковальня от удара иногда трескается…»
2.В легенде о Прометее говорится. Что похититель огня был прикован к скале алмазными цепями. Как это можно прокомментировать с точки зрения химика?
Слайд 24
Станция химическая
Допишите уравнения реакций. Распределите их на две
группы в зависимости от проявления свойств углерода:
1. АI +С
=
2. С + О 2=
3. С + Н 2 =
4. С + F2 =
Слайд 26
Станция «Круговорот углерода в природе»
Слайд 27
Станция контрольная
1.Сколько электронов в атоме углерода на вэу:
а)
2, б) 4,
в) 6, г) 8
2.Число протонов и нейтронов в ядре соответственно:
а) 4 и 4 б) 6 и 4 в) 6 и 6 г) 6 и 2
3. Максимальная степень окисления углерода в соединениях :
а) – 4 б) + 2 в) +4 г) + 6
4. В соединениях углерода с металлами С.О равна:
а) +4 б) – 4 в) + 2 г) - 2
5. Среди перечисленных элементов 4 группы типичным неметаллом является:
а) кремний, б) углерод, в) германий, г) олово
6. В соединениях: СО2, СО , СН 4 , АI 4С 3углерод имеет С.О:
а) + 4, -4, 0, +2 б)+4, +2, -4, -4 в) -4, 0, +4, +2 г) +6, -4, +2, -2
Слайд 28
Проверка теста
1 - б
2 - в
3 - в
4
- б
5 - б
6 - б