- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Адоптивная Т-клеточная терапия
Содержание
- 2. КонференцияТема конференции – адоптивная Т-клеточная терапияОсновное внимание
- 3. План презентацииОбщие вопросы онкологии и онкоиммунологииСовременные методы
- 4. Противоопухолевый иммунитет
- 5. Т-клеточный рецепторГипервариабельный рецептор Т-клетокФормируется путем перестройки генома
- 6. Презентация клеточных пептидов клетками организмаПрактически все виды
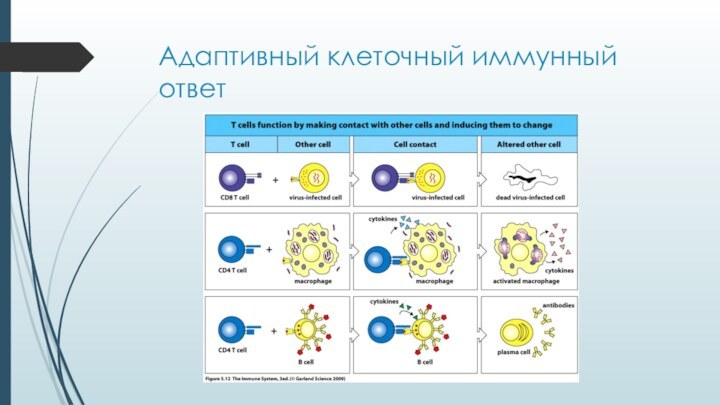
- 7. Адаптивный клеточный иммунный ответ
- 8. Презентация антигенов антиген-презентирующими клеткамиДля развития иммунного ответа
- 9. Костимуляторные молекулы антиген-презентирующих клетокПомимо презентации антигена антиген-презентирующие
- 10. Неоантигены опухолейНеоантиген – новый антиген, возникший в
- 11. Опухолевая иммуносупрессияНа самых ранних этапах опухолевого перерождения
- 12. TIL (опухоль-ассоциированные лимфоциты)
- 13. Общая схема терапии с помощью TIL Nicholas P. Restifo, Mark E. Dudley & Steven A. Rosenberg
- 14. Пре- и постмедикацияДо биопсии – checkpoint blockade
- 15. Плюсы и минусы терапииПреимущества:Использование собственных клеток пациентаОтсутствие
- 16. Лимфоциты с трансгенными TCR
- 17. Структура TCR
- 18. Плюсы и минусы терапииПреимущества:Возможность детектировать внутриклеточные антигеныВозможность
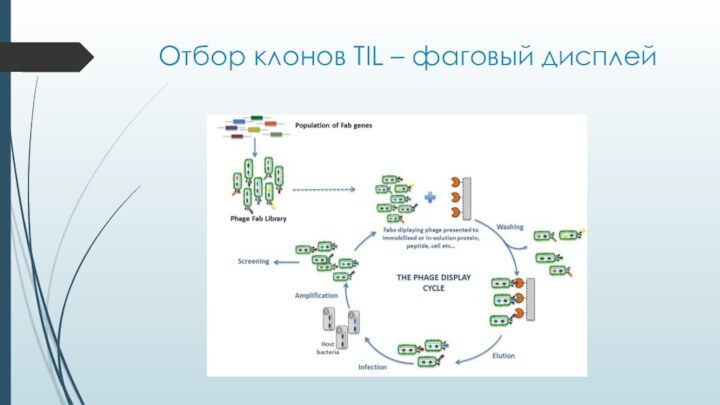
- 19. Отбор клонов TIL – фаговый дисплей
- 20. ТерапияТа же пре-/постмедикация, что и при использовании
- 21. Задачи модификации TCRСлучайное сочетание α и β
- 22. Преодоление случайного взаимодействия цепейУвеличение взаимной аффинности цепей
- 23. Повышение представленности экзогенного TCR на поверхностиКоличество TCR
- 24. Повышение аффинности TCRАффинность рецепторов TIL к неоантигенам
- 25. X-scan – методика от AdaptimmuneКаждая аминокислота последовательно
- 26. Привлечение Т-хелперовПолучаемые для клиники трансгенные TCR ограничены
- 29. CAR-T-cells – клетки с химерным антигенным рецептором
- 30. CAR – химерный антигенный рецепторРецептор состоит из:Антиген-связывающего
- 31. Схема терапии
- 32. Особенности CAR-T-клеточной терапииПреимущества:Легко создать нужную специфичностьНе требует
- 33. Текущее состояние CAR-T-клеточной терапииCD19+ лимфома – первый
- 34. Улучшение сигнализации через CARПервым сигнальным доменом, примененным
- 35. Преодоление системной токсичностиИдея – ввести второй CAR
- 36. Преодоление системной токсичности - iCARCAR модифицируется таким
- 37. Скачать презентацию
- 38. Похожие презентации
КонференцияТема конференции – адоптивная Т-клеточная терапияОсновное внимание уделено онкологииВыступали руководители исследовательских группКак правило, разработки доведены до клиники























Слайд 2
Конференция
Тема конференции – адоптивная Т-клеточная терапия
Основное внимание уделено
онкологии
Слайд 3
План презентации
Общие вопросы онкологии и онкоиммунологии
Современные методы адоптивной
Т-клеточной терапии рака
TIL – опухоль-резидентные лимфоциты
Рекомбинантные Т-клеточные рецепторы
CAR-T-cells –
Т-клетки с химерным антигенным рецептором
Слайд 5
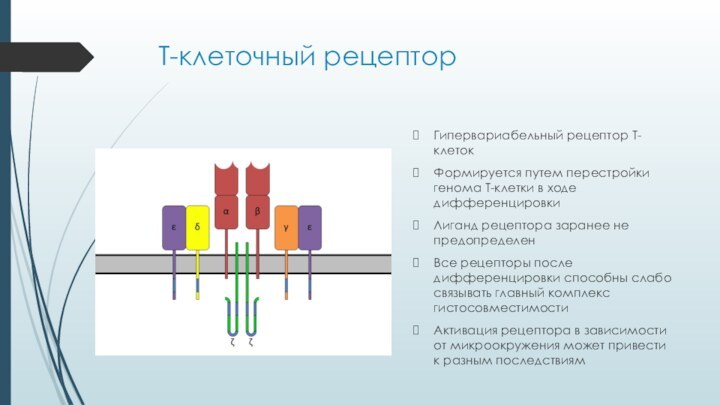
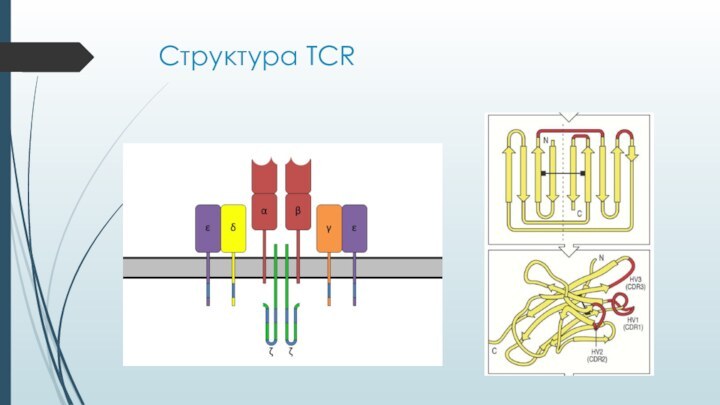
Т-клеточный рецептор
Гипервариабельный рецептор Т-клеток
Формируется путем перестройки генома Т-клетки
в ходе дифференцировки
Лиганд рецептора заранее не предопределен
Все рецепторы после
дифференцировки способны слабо связывать главный комплекс гистосовместимостиАктивация рецептора в зависимости от микроокружения может привести к разным последствиям
Слайд 6
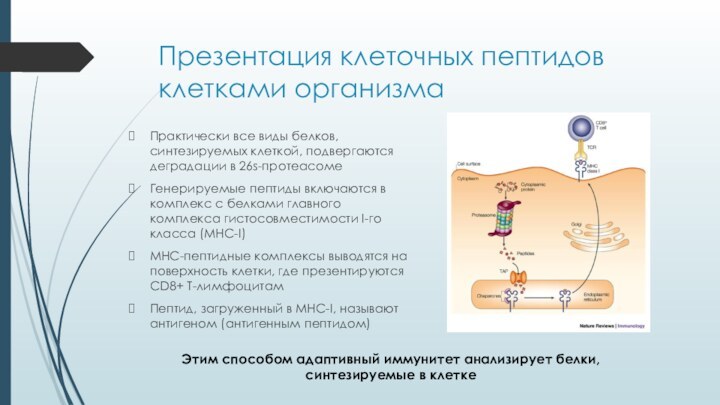
Презентация клеточных пептидов клетками организма
Практически все виды белков,
синтезируемых клеткой, подвергаются деградации в 26s-протеасоме
Генерируемые пептиды включаются в
комплекс с белками главного комплекса гистосовместимости I-го класса (MHC-I)MHC-пептидные комплексы выводятся на поверхность клетки, где презентируются CD8+ T-лимфоцитам
Пептид, загруженный в MHC-I, называют антигеном (антигенным пептидом)
Этим способом адаптивный иммунитет анализирует белки, синтезируемые в клетке
Слайд 8
Презентация антигенов антиген-презентирующими клетками
Для развития иммунного ответа Т-клетки
должны быть активированы
Профессиональные антиген-презентирующие клетки – макрофаги, дендритные клетки
и B-лимфоцитыПрезентируется содержимое лизосом: белки, захваченные в ходе пиноцитоза, фагоцитоза, рецептор-опосредованного эндоцитоза
Пептиды вводятся в комплекс с MHC II-го класса и презентируются наивным Т-клеткам (как CD4, так и CD8)
Слайд 9
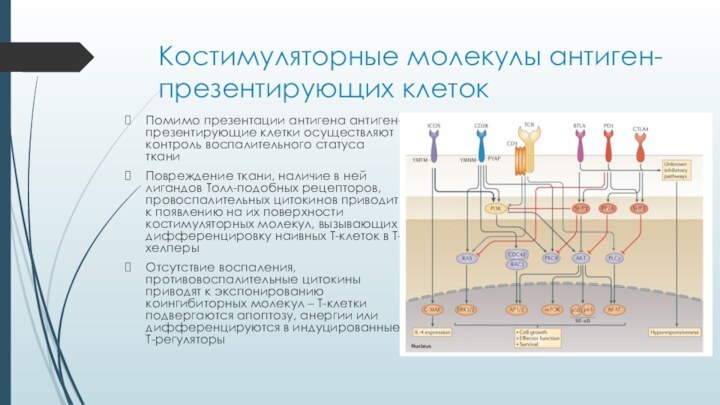
Костимуляторные молекулы антиген-презентирующих клеток
Помимо презентации антигена антиген-презентирующие клетки
осуществляют контроль воспалительного статуса ткани
Повреждение ткани, наличие в ней
лигандов Толл-подобных рецепторов, провоспалительных цитокинов приводит к появлению на их поверхности костимуляторных молекул, вызывающих дифференцировку наивных Т-клеток в Т-хелперыОтсутствие воспаления, противовоспалительные цитокины приводят к экспонированию коингибиторных молекул – Т-клетки подвергаются апоптозу, анергии или дифференцируются в индуцированные Т-регуляторы
Слайд 10
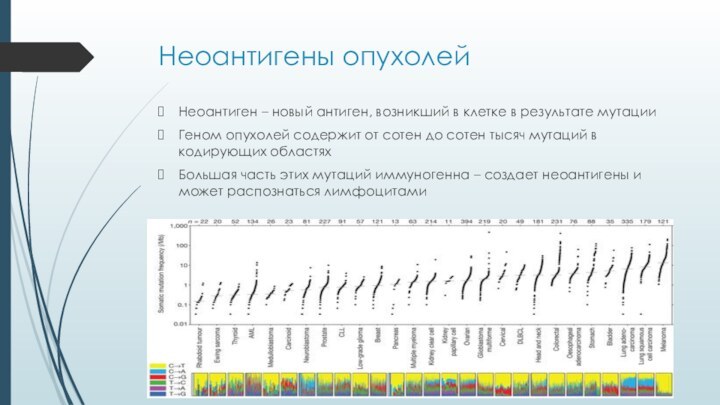
Неоантигены опухолей
Неоантиген – новый антиген, возникший в клетке
в результате мутации
Геном опухолей содержит от сотен до сотен
тысяч мутаций в кодирующих областяхБольшая часть этих мутаций иммуногенна – создает неоантигены и может распознаться лимфоцитами
Слайд 11
Опухолевая иммуносупрессия
На самых ранних этапах опухолевого перерождения опухоль
приобретает способность подавлять иммунитет
Механизмы иммуносупрессии:
Гуморальный – противовоспалительные цитокины и
белкиКонтактный – ингибиторные молекулы
Толерогенный – привлечение Т-регуляторов и других иммуносупрессорных клеток в ткань опухоли
Подавление презентации антигенов
В результате неоантиген-специфичные Т-клетки либо вообще не попадают в опухолевую ткань, либо (чаще) находятся в ней в состоянии анергии
Слайд 13
Общая схема терапии с помощью TIL
Nicholas P.
Restifo, Mark E. Dudley & Steven A. Rosenberg
Слайд 14
Пре- и постмедикация
До биопсии – checkpoint blockade inhibitors:
αCTLA-4
– ограниченный цитостатический эффект + больше лимфоцитов и меньше
регуляторов в опухолиПремедикация от биопсии до переливания – препараты, уничтожающие лимфоциты:
Циклофосфамид – дает токсичные метаболиты в отсутствие ферментов класса ALDH, уничтожает лимфоциты
Карбоплатин – препарат, создающий кросс-сшивки ДНК в активно делящихся клетках
Постмедикация:
IL-2 – провоспалительный цитокин, способствует выживанию перелитых лимфоцитов
aPD-1 – подавление опухолевой иммуносупрессии
Слайд 15
Плюсы и минусы терапии
Преимущества:
Использование собственных клеток пациента
Отсутствие кросс-реактивности
Недостатки:
Зависимость
от MHC
Очень долгая подготовка (3-4 недели)
Невозможность стандартизации, массового производства
и коммерциализацииНеобходимость агрессивной химиотерапии
Слайд 18
Плюсы и минусы терапии
Преимущества:
Возможность детектировать внутриклеточные антигены
Возможность стандартизации
и реализации в качестве препарата
Малое (в сравнении с TIL)
время подготовки к терапииНедостатки:
Зависимость от MHC
Необходимость генотипирования пациентов
Иммуногенность некоторых вариантов препарата
Необходимость агрессивной химиотерапии
Слайд 20
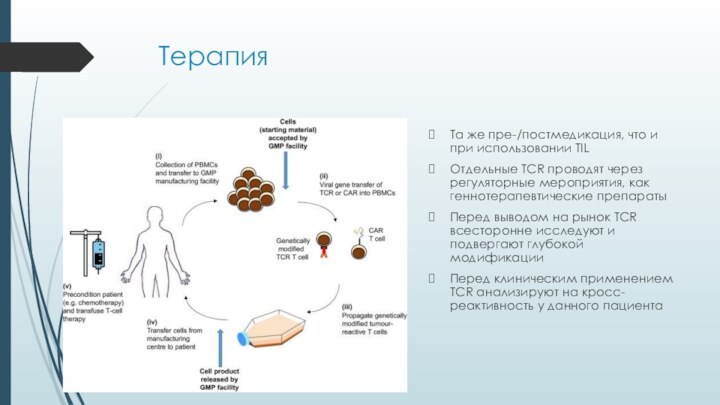
Терапия
Та же пре-/постмедикация, что и при использовании TIL
Отдельные
TCR проводят через регуляторные мероприятия, как геннотерапевтические препараты
Перед выводом
на рынок TCR всесторонне исследуют и подвергают глубокой модификацииПеред клиническим применением TCR анализируют на кросс-реактивность у данного пациента
Слайд 21
Задачи модификации TCR
Случайное сочетание α и β цепей
нативного и экзогенного TCR – как минимум 2 рецептора
неизвестной специфичностиНизкая представленность трансгенного TCR на поверхности
Низкая аффинность TIL-TCR к неоантигенам
Отсутствие помощи CD4 Т-хелперов
Слайд 22
Преодоление случайного взаимодействия цепей
Увеличение взаимной аффинности цепей экзогенных
TCR друг другу:
Введение дополнительных цистеинов
Использование альтернативных сайтов связывания второй
цепиСнижение экспрессии эндогенных TCR:
РНК-интерференция
CRISPR
Слайд 23
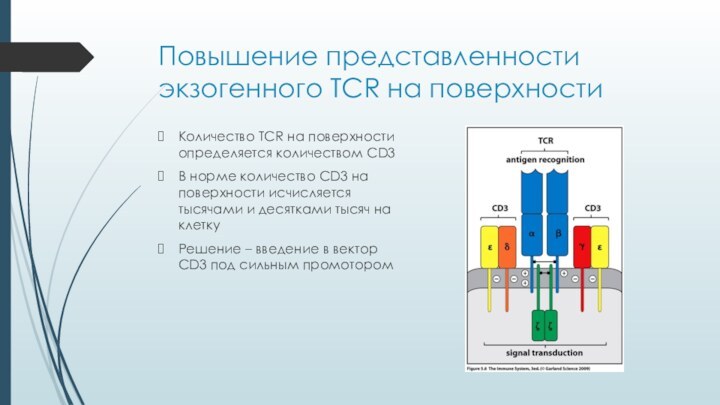
Повышение представленности экзогенного TCR на поверхности
Количество TCR на
поверхности определяется количеством CD3
В норме количество CD3 на поверхности
исчисляется тысячами и десятками тысяч на клеткуРешение – введение в вектор CD3 под сильным промотором
Слайд 24
Повышение аффинности TCR
Аффинность рецепторов TIL к неоантигенам низка
из-за клональной селекции
Смоделировать соматическую гипермутацию:
Для TCR ее можно
вызвать искусственно – путем наработки гена TCR неточными полимеразамиОсновной мишенью мутации является CDR3
Удалить сайты N-гликозилирования – увеличивается аффинность
Использовать мышиный TCR, полученный при иммунизации химерных по HLA мышей
Слайд 25
X-scan – методика от Adaptimmune
Каждая аминокислота последовательно заменяется
на каждую другую (171 вариант для 9-аминокислотного пептида)
При наличии
связывания измененного пептида определяют его возможную экспрессию методом Blast или прямого секвенирования транскриптома пациентаПараллельно проверяют активацию трансгенных Т-клеток на другие MHC-аллели данного пациента из библиотеки
Слайд 26
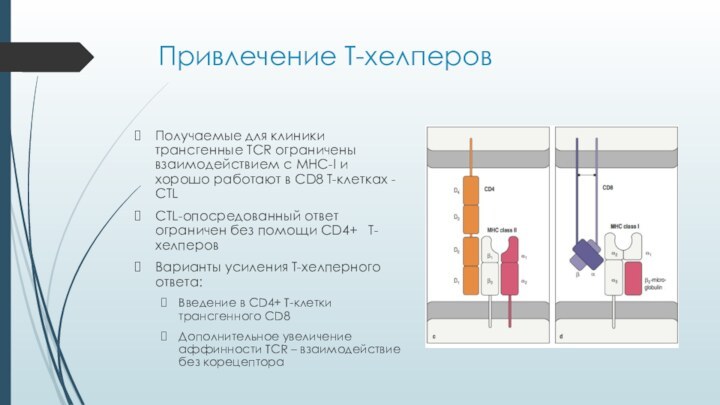
Привлечение Т-хелперов
Получаемые для клиники трансгенные TCR ограничены взаимодействием
с MHC-I и хорошо работают в CD8 Т-клетках -
CTLCTL-опосредованный ответ ограничен без помощи CD4+ Т-хелперов
Варианты усиления Т-хелперного ответа:
Введение в CD4+ Т-клетки трансгенного CD8
Дополнительное увеличение аффинности TCR – взаимодействие без корецептора
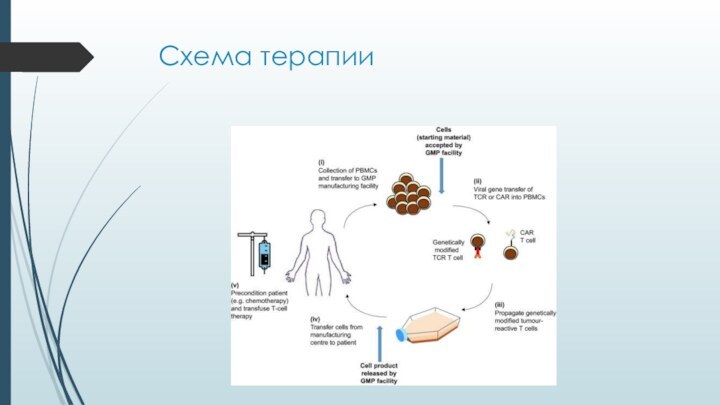
Слайд 30
CAR – химерный антигенный рецептор
Рецептор состоит из:
Антиген-связывающего участка
(вариабельный фрагмент моноклонального антитела)
трансмембранного домена
сигнальных внутриклеточных доменов
Активируется при контакте
с клетками, несущими «целевой» поверхностный антигенМеханизм запуска сигнализации не до конца ясен
Слайд 32
Особенности CAR-T-клеточной терапии
Преимущества:
Легко создать нужную специфичность
Не требует MHC
и антиген-презентирующих клеток
Можно «нацелить» не только на белки, но
и на липиды, гликолипиды, липопротеины и гликопротеиныНедостатки:
«Целевым» может быть только поверхностный антиген
Периодически наблюдается спонтанная активация и цитокиновый шторм
Крайне сложно найти опухоль-специфический антиген – риск атаки здоровой ткани
По-прежнему требуется агрессивная химиотерапия
Слайд 33
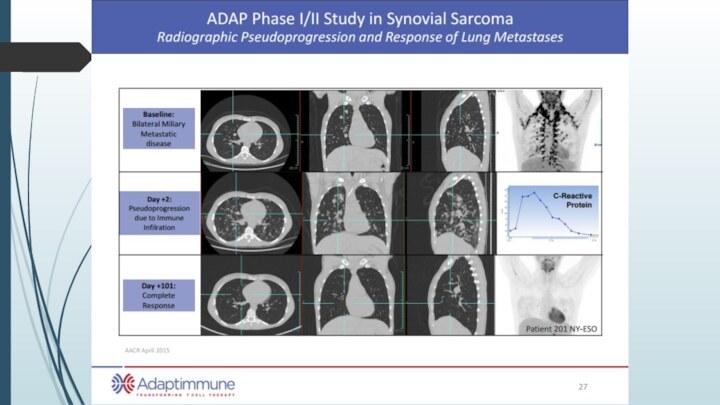
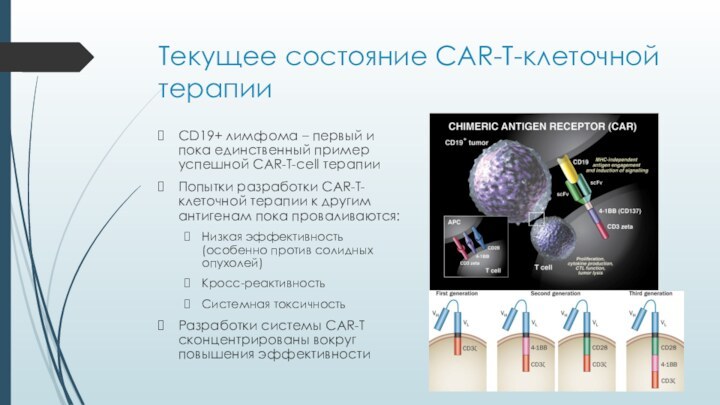
Текущее состояние CAR-T-клеточной терапии
CD19+ лимфома – первый и
пока единственный пример успешной CAR-T-cell терапии
Попытки разработки CAR-T-клеточной терапии
к другим антигенам пока проваливаются:Низкая эффективность (особенно против солидных опухолей)
Кросс-реактивность
Системная токсичность
Разработки системы CAR-T сконцентрированы вокруг повышения эффективности
Слайд 34
Улучшение сигнализации через CAR
Первым сигнальным доменом, примененным в
CAR была ζ-цепь CD3-комплекса
4-1BB и СD28
– молекулы корецепторов, активируемых при контакте с APC
Слайд 35
Преодоление системной токсичности
Идея – ввести второй CAR с
внутриклеточным доменом, ингибирующим сигналинг первого
При контакте с клеткой, несущей
оба антигена, кокластеризация обоих CAR предотвратит активацию Т-клеткиНа аналогичном принципе можно создать систему, активирующую Т-клетки только в ответ на 2 антигена
Слайд 36
Преодоление системной токсичности - iCAR
CAR модифицируется таким образом,
чтобы интенсивностью сигнала можно было управлять с помощью малых
молекулДля этого на внутриклеточной части CAR остается только «домен димеризации»
Сигнальный участок присутствует в цитозоле в виде растворимого белка с доменом димеризации
Добавлением димеризующего агента можно управлять интенсивностью CAR-опосредованного ответа