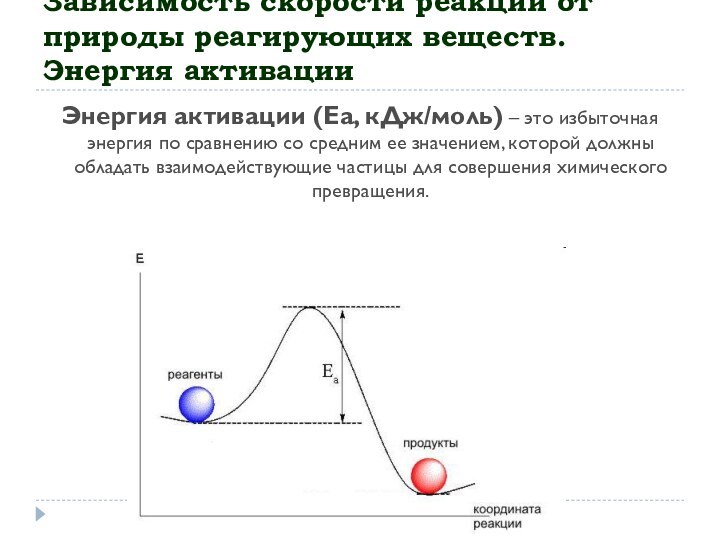
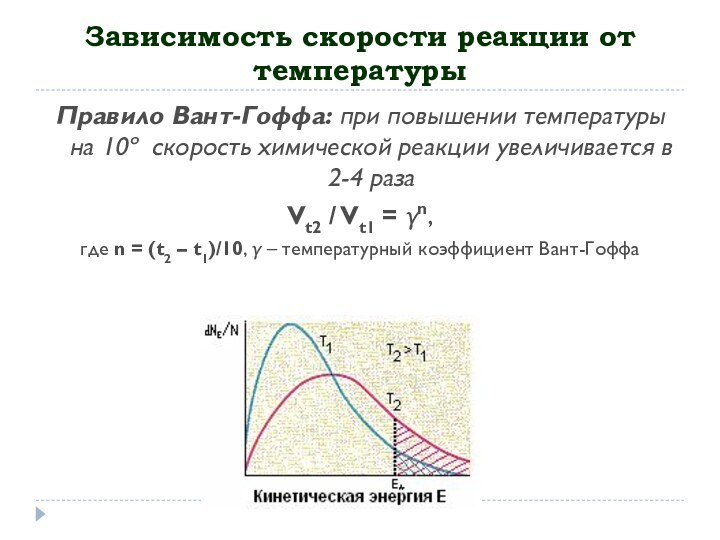
частицы, в какой последовательности и каким образом, реагируя между
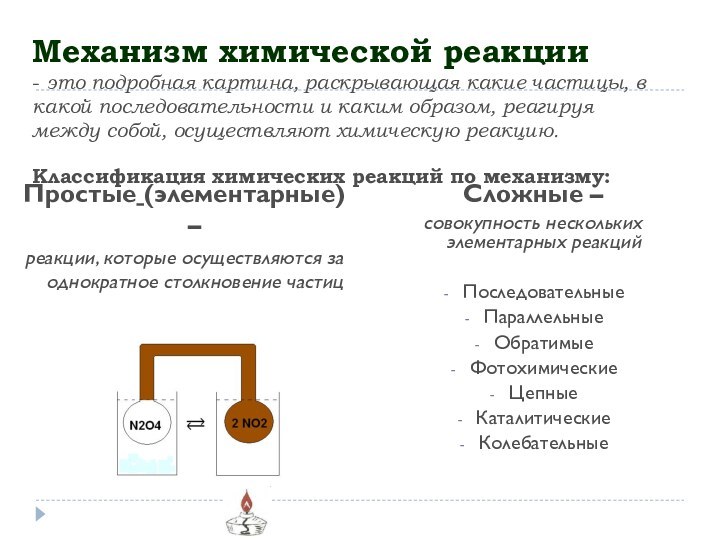
собой, осуществляют химическую реакцию. Классификация химических реакций по механизму:Простые (элементарные) –
реакции, которые осуществляются за однократное столкновение частиц
Сложные –
совокупность нескольких элементарных реакций
Последовательные
Параллельные
Обратимые
Фотохимические
Цепные
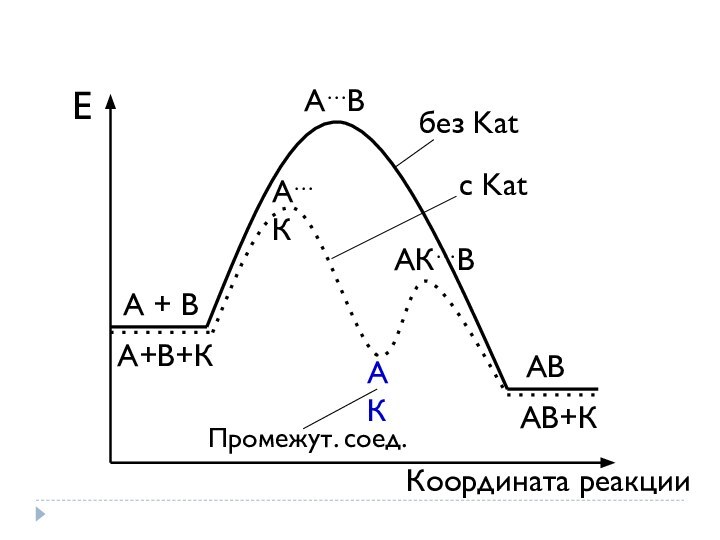
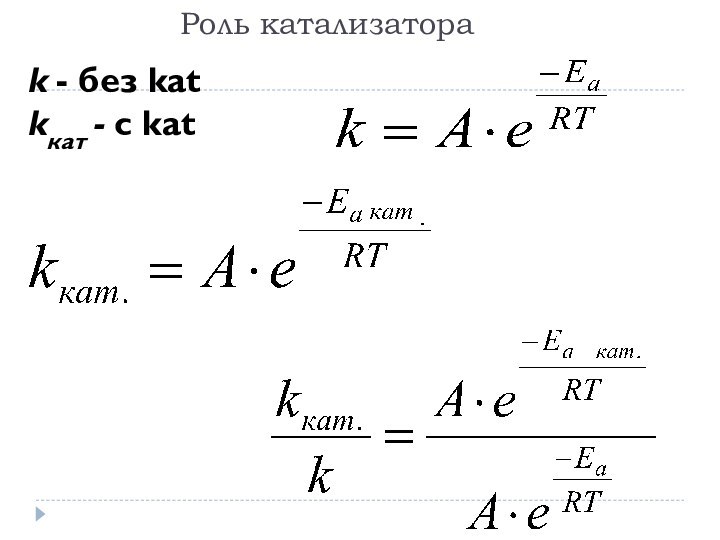
Каталитические
Колебательные