- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Нитраты
Содержание
- 2. Нитраты - хорошо растворимы в воде,
- 3. Нитрат (лат. nitras; устар. Селитры) - соль азотной
- 4. Нитраты получают действием азотной кислоты
- 5. ПрименениеОсновное применение нитратов — удобрения (селитры), взрывчатые вещества (аммониты) и другие.
- 6. Биологическая роль нитратовСоли азотной кислоты являются элементом
- 7. Биологическая роль нитритовНитриты попадают в организм человека
- 8. Биологическая роль НитрозаминовНитрозамины являются высокотоксичными соединениями. При
- 9. При нормальном физиологическом состоянии и поступлении нитритов
- 10. Нитраты в косметике Пальмовое масло – это
- 11. Нитраты в водеЧасто нитраты поступают в организм
- 12. Нитраты применяются в медицине около 130 лет.
- 13. СИМПТОМЫ отравления нитратамиПри поступлении в организм человека
- 14. Нитраты снижают содержание витаминов в пище, которые
- 15. Легко переносимая доза нитратов для человека в
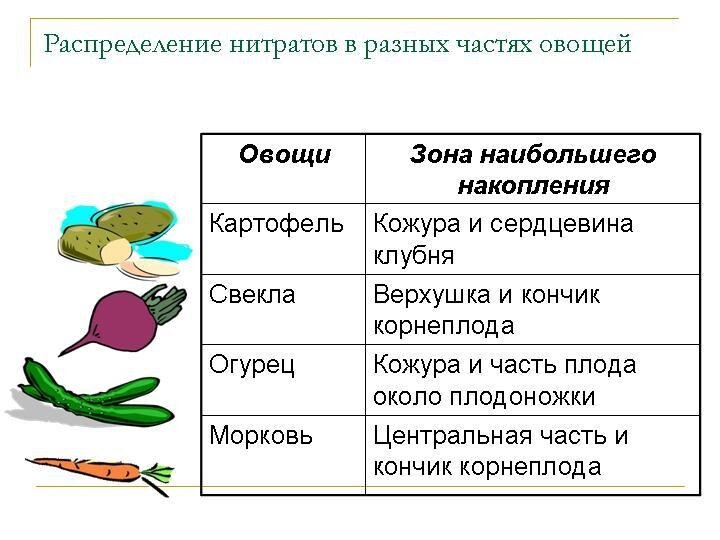
- 16. Нитраты поступают в организм человека: С овощами
- 17. Нитрат натрия в продуктах питания Применение
- 18. Добавка имеет противомикробные свойства, которые по силе
- 20. Скачать презентацию
- 21. Похожие презентации
Нитраты - хорошо растворимы в воде, токсичные, твёрдые кристаллические вещества. Получаются в последствии действия нитратной кислоты на металлы, аммониак и некоторые соли.



















Слайд 3 Нитрат (лат. nitras; устар. Селитры) - соль азотной кислоты,
содержит однозарядный анион NO3−. Устаревшее название — селитры — в настоящее
время используется преимущественно в минералогии, как название для минералов, а также для удобрений в сельском хозяйстве.
Слайд 4
Нитраты получают действием азотной кислоты HNO3
на металлы, оксиды, гидроксиды, соли. Практически все нитраты хорошо
растворимы в воде.Нитраты являются достаточно сильными окислителями в твёрдом состоянии (обычно в виде расплава), но практически не обладают окислительными свойствами в растворе, в отличие от азотной кислоты.
Нитраты устойчивы при обычной температуре. Они обычно плавятся при относительно низких температурах (200—600 °C), зачастую с зазложением.
Общие химические свойства
Слайд 5
Применение
Основное применение нитратов — удобрения (селитры), взрывчатые вещества (аммониты)
и другие.
Слайд 6
Биологическая роль нитратов
Соли азотной кислоты являются элементом минеральных
удобрений. Растение использует азот из соли для построения клеток
организма, создания хлорофилла. В организме людей нитраты превращаются в нитриты и нитрозамины.Существует мнение, что овощи можно очистить от нитратов, вымачивая в воде или проварив около часа. Нитратов действительно становиться меньше, однако ценнейшие вещества – каротиноиды, танины витамины, токоферолы вымываются. В результате овощи совсем не становятся полезными, скорее наоборот.
Слайд 7
Биологическая роль нитритов
Нитриты попадают в организм человека двумя
путями: прямым содержанием или же нитратами, которые в пищеварительном
тракте (в полости рта, желудке или кишечнике) человека превращаются в нитриты под действием фермента нитратредуктазы, в результате в крови образуются нитрозил-ионы. Они — яд для гемоглобина человека, вызывающий метгемоглобинемию. Двухвалентное железо в гемоглобине крови окисляется до трёхвалентного и получается метгемоглобин. В результате такого превращения гемоглобин, имеющий красную окраску, меняет цвет на темно-коричневый. Метгемоглобин не способен переносить О2 и СО2.
Слайд 8
Биологическая роль Нитрозаминов
Нитрозамины являются высокотоксичными соединениями. При попадании
в организм они поражают печень, вызывают кровоизлияния, конвульсии, могут
привести к коме. Большая часть нитрозаминов обладает сильным канцерогенным действием даже при однократном действии, проявляют мутагенные свойства. Напротив, N-нитрозо-N-метилмочевина обладает противоопухолевой активностьюСлайд 9 При нормальном физиологическом состоянии и поступлении нитритов в
организм не более допустимой суточной дозы, утвержденной Министерством здравоохранения
- 0,2 мг/кг массы тела (за исключением детей грудного возраста), в организме человека образуется примерно 2 % метгемоглобина, поскольку редуктазы эритроцитов взрослого человека обладают способностью превращать образовавшийся метгемоглобин обратно в гемоглобин.
Слайд 10
Нитраты в косметике
Пальмовое масло – это недорогой
ингредиент, который часто используется в косметике. Его добавляют в
составы шампуней, гелей для душа и зубные пасты. Данное вещество имеет свойство накапливаться в организме и поражать такие органы как печень, глаза, мозг. Кроме этого оно вступает в реакцию с другими косметическими компонентами и образует такие вещества как нитросамины или нитраты, которые негативно влияют на организм человека.
Слайд 11
Нитраты в воде
Часто нитраты поступают в организм человека
с водой, которая является одним из основных условий нормальной
жизни человека. Загрязнённая питьевая вода вызывает 70-80% всех имеющихся заболеваний, которые на 30% сокращают продолжительность жизни человека. По данным ВОЗ по этой причине заболевает более 2млрд человек на Земле, из которых 3,5 млн умирает (90% из них составляют дети младше 5 лет).В подземных водах содержится до 200мг/л нитратов. Нитраты попадают в подземные воды через различные химические удобрения (нитратные, аммонийные), с полей и от химических предприятий по производству этих удобрений. Наибольшее количество нитратов содержится в грунтовых водах, а значит, и в колодезной воде. Обычно жители городов пьют очищенную воду, где содержится до 20мг/л нитратов, жители же сельской местности — воду, где содержится 20-80мг/л нитратов.
Слайд 12 Нитраты применяются в медицине около 130 лет. Нитроглицерин
(НГ) был впервые синтезирован в 1846 г. итальянским химиком
Собреро в процессе поисков новых взрывчатых веществ и стал исходным веществом для создания целого класса препаратов, которые в настоящее время наиболее часто применяются при лечении сердечно-сосудистых заболеваний.В настоящее время существует огромное количество препаратов из группы нитратов, относящихся к различным химическим веществам и лекарственным формам, что ставит врача перед трудным выбором оптимального лекарства для конкретного больного.
Слайд 13
СИМПТОМЫ отравления нитратами
При поступлении в организм человека высоких
доз нитратов, через 4-6 часов появляются:
Тошнота
Одышка
Посинение кожных покровов
Диарея
Головокружение
Боли в
затылкеСердцебиение
Общая слабость организма.
Слайд 14 Нитраты снижают содержание витаминов в пище, которые входят
в состав многих ферментов, стимулируют действие гормонов, а через
них влияют на все виды обмена веществ. У беременных женщин возникают выкидыши, а у мужчин — снижение потенции.При длительном поступлении нитратов в организм человека уменьшается количество йода, что приводит к увеличению щитовидной железы. Установлено, что нитраты сильно влияют на возникновение раковых опухолей в желудочно-кишечном тракте у человека. Нитраты способны вызывать резкое расширение сосудов, в результате чего понижается кровяное давление.





























