Слайд 2
Окислители и восстановители
Активные металлы относительно легко отдают электроны
и являются восстановителями.
Активные неметаллы легко присоединяют электроны и
являются окислителями.
Элемент в своей высшей степени окисления, когда уже отданы все валентные электроны, может быть только окислителем.
Элемент в своей низшей степени окисления, заполнив все свои орбитали, может быть только восстановителем.
В промежуточных степенях окисления элемент может иметь и окислительные и восстановительные свойства.
Слайд 3
Окисленная и восстановленная формы
Окислители, принимая электроны, переходят в
восстановленную форму:
F2 [ок.] + 2ē 2F- [вост.]
Восстановители,
отдавая электроны, переходят в окисленную форму:
Na0 [вост.] - 1ē Na+ [ок.]
Таким образом, как окислители, так и восстановители существуют в окисленной и восстановленной формах. При этом для окислителей более характерен переход из окисленной формы в восстановленную форму, а для восстановителей характерен переход из восстановленной в окисленную форму.
Слайд 5
Электродные потенциалы
Величины стандартных электродных потенциалов Ео приведены в
таблицах и характеризуют окислительные и восстановительные свойства соединений:
чем
положительнее величина Ео, тем сильнее окислительные свойства, и чем отрицательнее значение Ео, тем сильнее восстановительные свойства.
Например, для F2 + 2ē 2F- Ео = 2,87 вольт (F2 - сильный окислитель), а для Na+ + 1ē Na0 Ео = -2,71 вольт (Na - сильный восстановитель)
Процесс всегда записывается для реакций восстановления.
Слайд 6
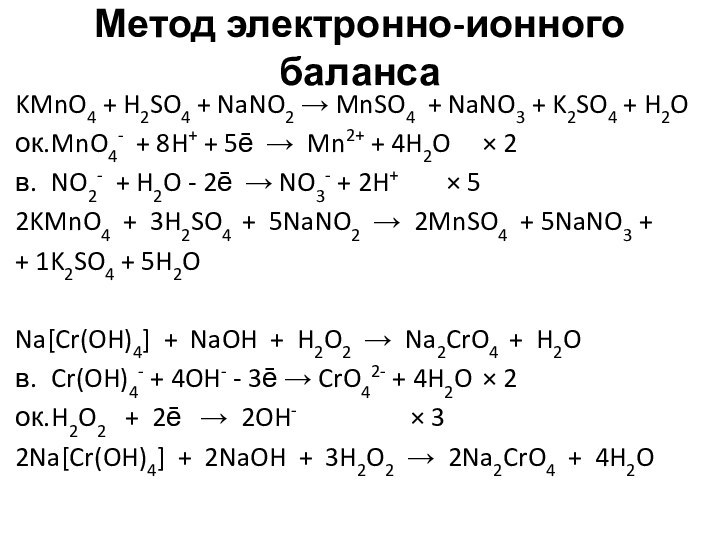
Метод электронно-ионного баланса
KMnO4 + H2SO4 + NaNO2 →
MnSO4 + NaNO3 + K2SO4 + H2O
ок. MnO4- + 8H+
+ 5ē → Mn2+ + 4H2O 2
в. NO2- + H2O - 2ē → NO3- + 2H+ 5
2KMnO4 + 3H2SO4 + 5NaNO2 → 2MnSO4 + 5NaNO3 +
+ 1K2SO4 + 5H2O
Na[Cr(OH)4] + NaOH + H2O2 → Na2CrO4 + H2O
в. Cr(OH)4- + 4OH- - 3ē → CrO42- + 4H2O 2
ок. H2O2 + 2ē → 2OH- 3
2Na[Cr(OH)4] + 2NaOH + 3H2O2 → 2Na2CrO4 + 4H2O
Слайд 7
Влияние среды на электродные потенциалы
Окислительно-восстановительные свойства соединений зависят
от характера среды. Например, окислительный потенциал KMnO4 уменьшается при
переходе от кислой к нейтральной и щелочной среде:
в кислой среде: MnO4- + 5e Mn+2 Е0 = +1,51 в
в нейтральной среде: MnO4- + 3e MnO2 Е0 = +0,60 в
в щелочной среде: MnO4- + e MnO4-2 Е0 = +0,56 в
Соединения хрома (VI) являются сильными окислителями в кислой среде (Е0 = +1,33 в), восстанавливаясь в Cr+3, а соединения хрома (III) в щелочной среде проявляют восстановительную способность (Е0 = -0,13 в), окисляясь в соединения хрома (VI).
Слайд 8
Э.д.с. реакции
Окислительно-восстановительная реакция представляет собой совокупность двух
полуреакций, окисления и восстановления, и характеризуется электродвижущей силой (э.д.с.)
Еo:
Еo = Еoок - Еoвосст,
где Еoок и Еoвосст - стандартные потенциалы окислителя и восстановителя для данной реакции.
Слайд 9
Связь э.д.с. реакции Е с G и К
Э.д.с.
реакции Е связана с изменением энергии G
Go =
-nFЕo или Еo = -(1/nF)Go
Э.д.с. реакции Е связана с константой равновесия К:
Е = (0,059/n)lgK и К = 10nЕ /0,059
Для самопроизвольного протекания реакции должно выполняться соотношения: G <0 или К>>1, которым соответствует условие Ео>0. Поэтому для определения возможности протекания данной окислительно-восстановительной реакции необходимо вычислить значение Ео.
Если Ео0, реакция идет.
Если Ео0, реакция не идет


![Окислительно-восстановительные реакции Окисленная и восстановленная формыОкислители, принимая электроны, переходят в восстановленную форму: F2 [ок.]](/img/tmb/13/1239863/e93491edcc619eaf2a6ce7a1854a3f3d-720x.jpg)