Слайд 2
Объект исследования
ветеринарно-санитарного эксперта
Исследуется организм животного на тканевом,
клеточном, субклеточном, молекулярном уровнях организации.
В зависимости от уровня организации,
размеров объекта подбираются соответственно и методы исследования.
Исследуемый объект представляется в виде гистологического препарата.
Для его изучения применяется световая (оптическая) микроскопия и в настоящее время используются электронные микроскопы.
Слайд 3
Устройство светового микроскопа
А - МИКМЕД-1; Б - БИОЛАМ.
1
- окуляр, 2 - тубус, 3 - тубусодержатель, 4
- винт грубой наводки, 5 - микрометренный винт, 6 - подставка, 7 - зеркало, 8 - конденсор, ирисовая диафрагма и светофильтр, 9 - предметный столик, 10 - револьверное устройство, 11 - объектив, 12 - корпус коллекторной линзы, 13 - патрон с лампой, 14 - источник электропитания.
Слайд 4
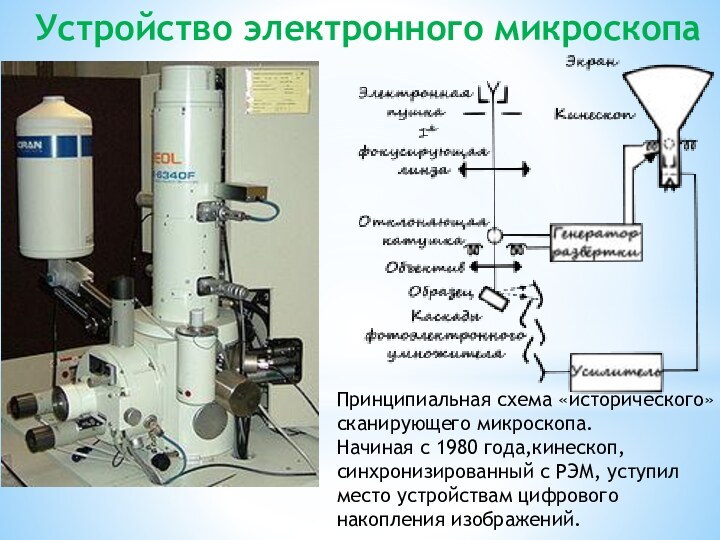
Устройство электронного микроскопа
Принципиальная схема «исторического» сканирующего микроскопа.
Начиная
с 1980 года,кинескоп, синхронизированный с РЭМ, уступил место устройствам цифрового
накопления изображений.
Слайд 5
Электронные микроскопы бывают двух видов:
1)Просвечивающие
В таком микроскопе используется
поток, которые излучает нить катода, расположенная на вершине цилиндрической
колонны. Из нее предварительно откачали воздух вакуумным насосом. Электромагнитное устройство микроскопа фокусирует и направляет поток электронов на исследуемый объект. Электронный пучок проходит через образец и оставляет изображение на фосфоресцирующем экране или фотопластинке.
2)Сканирующие
Позволяет получить трехмерное изображение исследуемого объекта. Электронный луч отражается от объекта исследования и преобразуется в изображение на экране компьютера.
Слайд 6
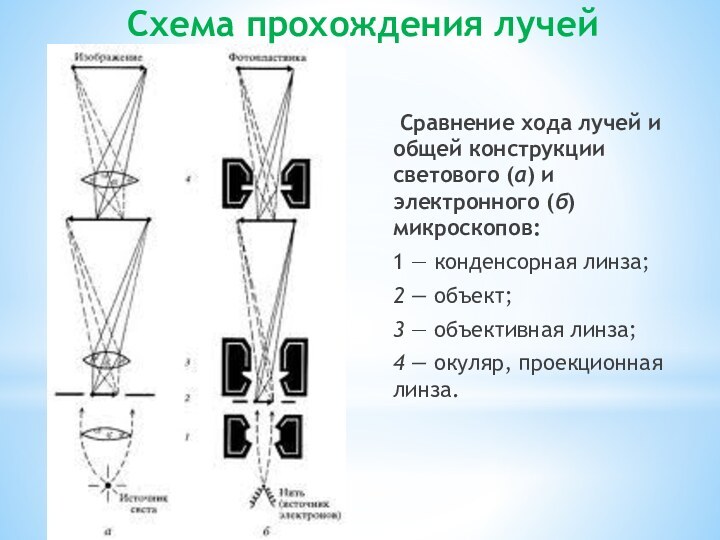
Схема прохождения лучей
Сравнение хода лучей и общей конструкции
светового (а) и электронного (б) микроскопов:
1 — конденсорная линза;
2
— объект;
3 — объективная линза;
4 — окуляр, проекционная линза.
Слайд 7
Преимущество электронного микроскопа
Разрешающая способность микроскопа – это наименьшее
расстояние, на котором две ближайшие точки объекта воспринимаются раздельно.
С
помощью светового можно достичь разрешения 0,2 мкм-0,0002 мм, более мелкие объекты как бы ни увеличивали, воспринимаются как одна точка.
Разрешающая способность электронного микроскопа в 100 раз выше, чем у светового!
Слайд 8
Методы исследования фиксированных (мертвых) клеток и тканей
С помощью
световой микроскопии наиболее часто исследуют препараты, расположенные между предметным
и покровным стеклом.
Для изготовления качественных препаратов необходимы равномерные тонкие срезы исследуемого объекта. Ткани предварительно обрабатывают специальными растворами для фиксации, обезвоживают с помощью спирта, пропитывают органическим растворителем. Затем кусочки тканей необходимо пропитать и залить такой средой, которая превратила бы ткань в твердую хорошо режущуюся массу, потому что мягкие ткани будут сминаться при резке. С этой целью ткани помещают в жидкий раствор парафина, целлоидина, желатина. После затвердевания блоки тканей с помощью микротома разделяют на слои толщиной 2-10 мкм.
Слайд 9
Микротом
Микротом — инструмент для приготовления срезов фиксированной и не
фиксированной биологической ткани, а также небиологических образцов для оптической микроскопии.
Существует несколько основных разновидностей микротомов, с подачей материала на нож, с подачей ножа на материал, микротомы-криостаты (криомикротомы).
Микротомы, позволяющие получать срезы толщиной 10-100 нм получили название ультрамикротомов. Ультрамикротомы, совмещенные с криокамерами для приготовления срезов в условиях низких температур, получили название криоультрамикротомов. Они используются для подготовки образцов для электронной и сканирующей зондовой микроскопии.
Слайд 11
После того, как получили необходимый срез ткани, его
начинают окрашивать разными органическими красителями, каждый из которых предназначен
для определенной части клетки, чтоб улучшить видимость тех или иных органелл клетки.
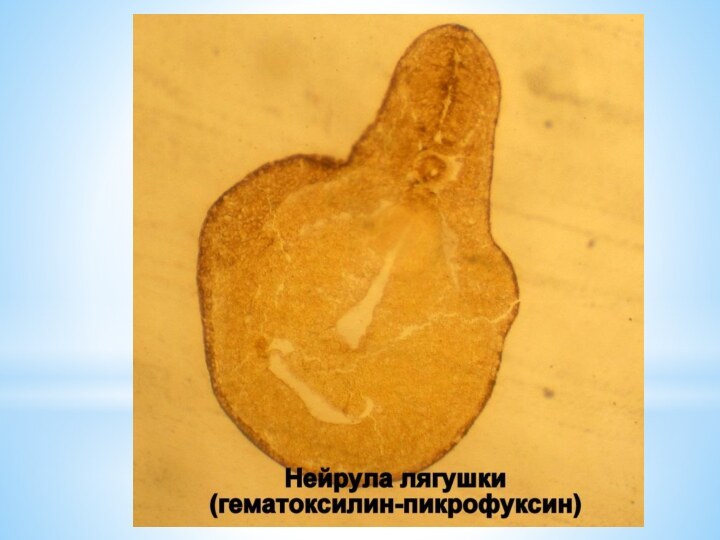
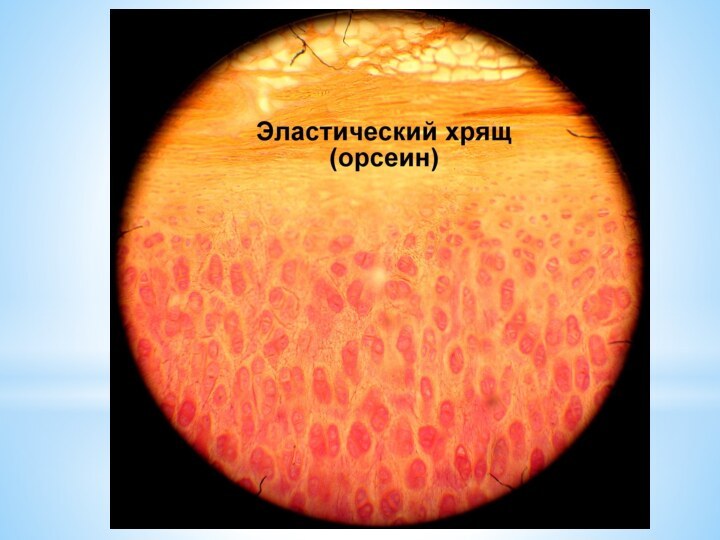
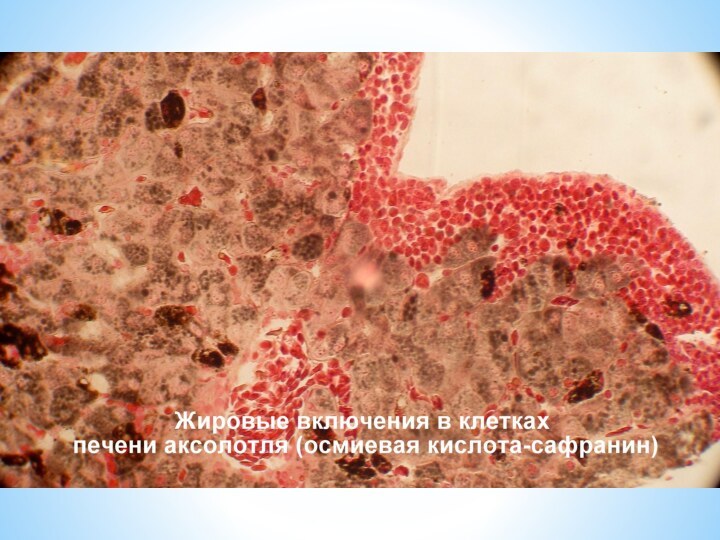
Часто, например, используют такие окраски: гематоксилин-эозин, гематоксилин-пикрофуксин, железный гематоксилин, орсеин, осмиевая кислота-сафранин, толуидин, серебрение по Кахалю, тионин-пикриновая кислота и многие другие.
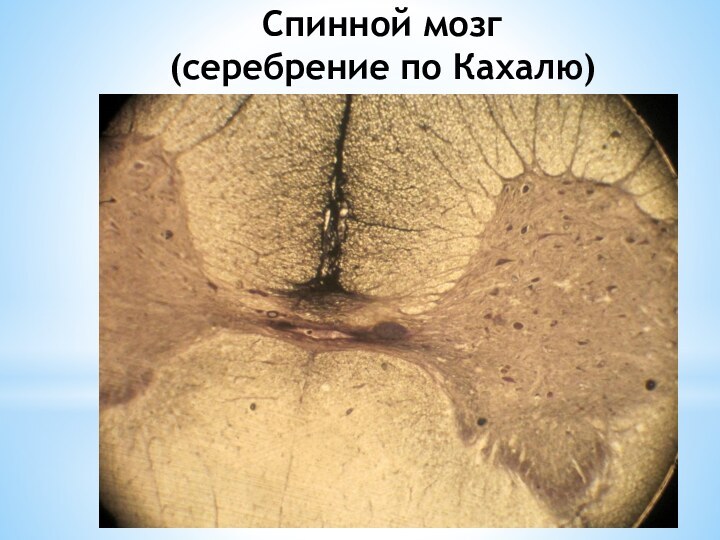
Слайд 16
Спинной мозг
(серебрение по Кахалю)
Слайд 19
Кость в поперечном разрезе
(тионин-пикриновая кислота)
Слайд 20
Для выявления специализированных клеток структур используют гистохимические методы
исследования.
Они основаны на использовании реакции, с помощью которой выявляют
различные химические вещества в клетках органов и тканей.
Современные гистохимические методы позволяют обнаружить в клетке аминокислоты, белки, нуклеиновые кислоты, углеводы, липиды.
Иммунохимический метод исследования основан на обработке срезов специфическими антителами к выявляемому веществу, которое служит антигеном.
Для количественного анализа применяют различные методы морфометрии, спектрофотометрии с последующей математической обработкой цифрового материала.
Слайд 21
Центрифугирование
Разделительное вращение в центрифуге позволяет исследовать строение клеток
на молекулярном уровне. Принцип основан на том, что частицы
оседают под действием центробежных сил при вращении пробирок с огромной скоростью; время оседания частиц зависит от размера и плотности. Таким образом можно получить практически все составные части клетки.
Слайд 23
Методы исследования живых клеток и тканей
Биологические объекты можно
рассматривать и живыми. Для этого на микроскоп монтируют специальные
устройства, которые особым образом преобразуют видимый свет. Тогда многие детали видны более отчетливо, чем при использовании светового микроскопа без специальных насадок.
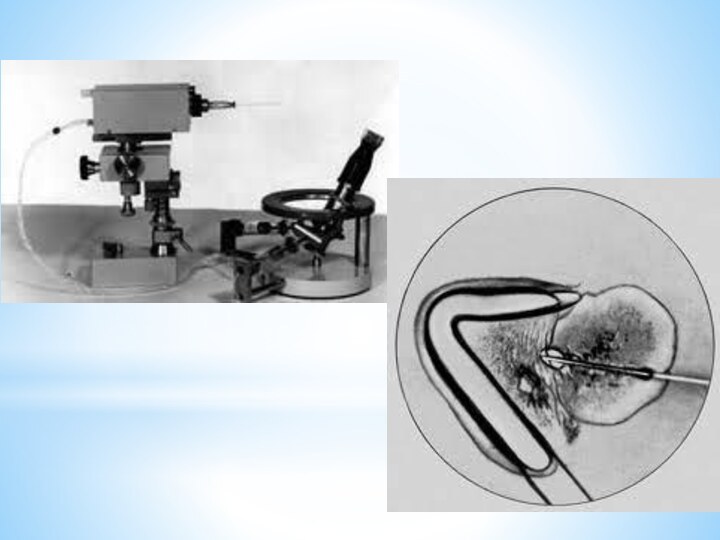
При изучении живой клетки используют метод микрохирургии: очень тонкой иглой в специальном аппарате производят манипуляции внутри клетки, например перемещают или вынимают ядро, вводят в цитоплазму различные вещества. Это дает возможность изучать структуры и функции различных составляющих клетки и открывает перспективы для генной инженерии.
Слайд 25
Биопсия – прижизненное
взятие материала
Биопсия бывает трех видов:
Эксцизионная
биопсия — в результате хирургического вмешательства происходит изъятие всего исследуемого
образования или органа.
Инцизионная биопсия — в результате хирургического вмешательства происходит изъятие части образования или органа.
Пункционная биопсия — в результате прокола полой иглой исследуемого образования происходит забор фрагментов или столбика ткани.
Слайд 26
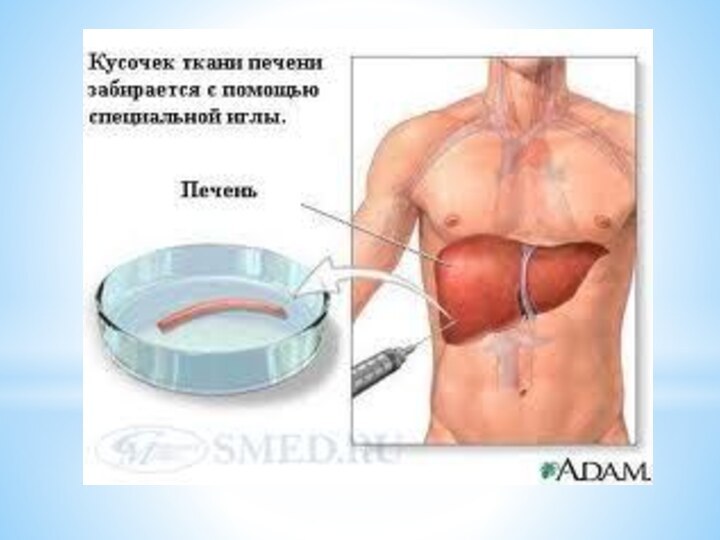
Биопсия печени
В процессе биопсии с помощью специальной иглы
получают кусочек печени (биоптат) диаметром около 1 мм и
длиной около 1,5-2 см и затем исследуют его под микроскопом. Главная цель биопсии печени — узнать, каково состояние печени, на которую воздействует вирус гепатита С. Хотя результаты анализов могут рассказать врачу о многом, биопсия остается "золотым стандартом" диагностики воспаления и фиброза печеночной ткани.
Чаще всего врачи прибегают к пункционной биопсии (т.е. осуществлению прокола), и лишь в тех случаях, когда такое исследование опасно для пациента, применяются другие методы.
Слайд 28
Метод «культура тканей»
Метод позволяет культивировать ткани in vitro
(в пробирке).
Предварительно ткань обрабатывают ферментами, что вызывает распад ее
на клеточные элементы. Выделенные клетки выращивают в соответствующей для данного вида тканей среде, создавая оптимальные температурные условия. Немногие клетки способны продолжать деление в течение хотя бы нескольких месяцев.
Однако ученые обнаружили непрерывные клеточные линии, которыми можно пользоваться десятилетиями. Большинство тканевых культур способны переносить глубокое замораживание с помощью жидкого азота и хранятся неограниченно долго.
Создаются банки клеточных культур.