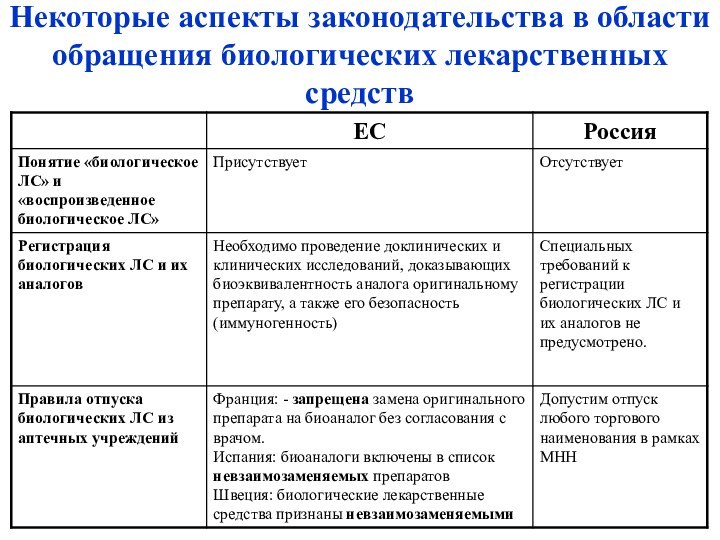
– определения и отличия
Свойства и особенности ЛС биологической
природыОсобенности регулирования обращения
Взаимозаменяемость
Выводы
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть































М. Ченцова. Анализ мирового биофармацевтического рынка на 2003-2006 гг. Ремедиум, №5, 2007.
Biotechnology Industry Organization website (www.bio.org), 2004.
*EMEA directive (Directive 2003/63/EC from 25 June 2003 )
Классификация EMEA
Примеры:
*Источник: Crommelin DJA, et al. Int J Pharm 2003;266:3-16.
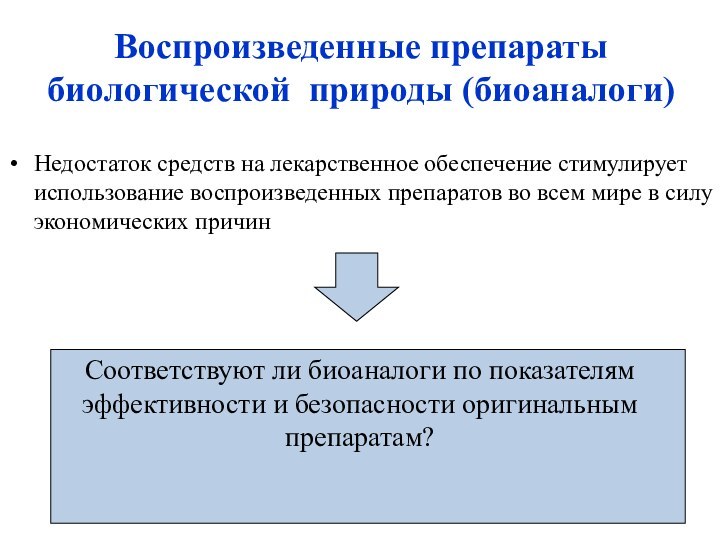
Воспроизведенные препараты биологической природы (биоаналоги)
Источник: Переведено из Article 10 (2) b of Directive 2001/83 as amended
Почему надо с особенной осторожностью говорить о равнозначности (взаимозаменяемости) биологических лекарственных средств?
АДМИНИСТРАТИВНЫЙ РЕГЛАМЕНТ
от 30.10.06. №736
АДМИНИСТРАТИВНЫЙ РЕГЛАМЕНТ
(продолжение)
The rules governing medicinal products in the European Union.
Investigation of Bioavailability and Bioequivalence.
1998, v. 3C, pp.231-244
Подтверждение биоэквивалентности ещё не свидетельствует о терапевтической эквивалентности сравниваемых препаратов.
Мексика.
HIS Global lnsight Article, 06March 2009, http://www.ibclifesciences.com/upload/wysiwyg/biopharma_series/B9194/BiosimilarsUS_IHSGlobalInsight.pdf
Принципы регистрации генериковых препаратов не могут быть применимы к биоаналогам
Четко прописаны определения, требования и процесс регистрации для биоаналогов
Биоаналог ≠ Генерик
Один и тот же препарат сравнения должен быть при проведении любых испытаний
Органы здравоохранения должны решать вопрос взаимозаменяемости
Источник: European Union: 26 May 2006: Generics Industry Leader Warns of Stumbling Blocks to European Biosimilars Market
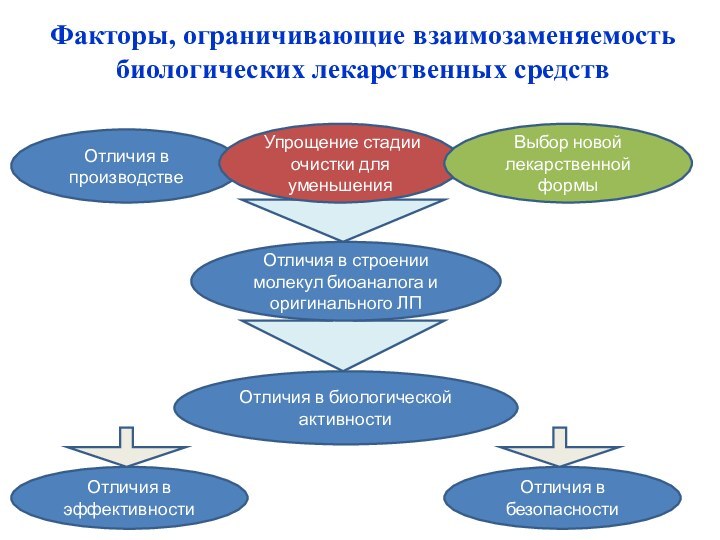
Отличия в биологической активности
Отличия в эффективности
Отличия в безопасности
Факторы, ограничивающие взаимозаменяемость биологических лекарственных средств