Слайд 2
Статическая биохимия
Изучает структуру и свойства следующих соединений, участвующих
в построении и функционировании живых клеток, тканей, органов:
Белки
Нуклеиновые кислоты
Углеводы
Липиды
Витамины
Ферменты
Гормоны
Минеральные
элементы
Микроэлементы
воду
Слайд 3
Динамическая биохимия
Изучает обмен веществ в организме, то есть
все превращения различных соединений, начиная с их поступления в
организм с пищей и кончая выделением конечных продуктов обмена. Это
Пищеварение
Всасывание
Транспорт в крови
Промежуточный обмен (метаболизм), включая анаболизм(синтез веществ), катаболизм (распад веществ), превращение одних веществ в другие.
Выделение конечных продуктов обмена веществ из организма.
Слайд 4
Частная биохимия
Рассматривает особенности химического состава и обменных процессов
различных тканей и органов (печение, почек, нервной ткани, крови
и др.)
Функциональная биохимия изучает химические процессы, лежащие в основе определенных функциональных проявлений живых систем (таких как движение, нервная проводимость, транспорт веществ через биологические мембраны и т.д.)
Слайд 5
Биохимию делят на:
Биохимию животных и человека;
Медицинскую (клиническую
биохимию) или патобиохимию
Биохимию растений
Биохимию микроорганизмов
Техническую биохимию
Квантовую биохимию
Молекулярную биологию
Слайд 6
Знание биохимии необходимо для успешного развития двух главных
направлений биомедицинских наук:
Решение проблем сохранения здоровья
Выяснение причин различных болезней
и изыскание путей их эффективного лечения
Слайд 7
Всемирная организация здравоохранения (ВОЗ) определяет – здоровье как
состояние «полного физического, духовного и социального благополучия, которое не
сводится к простому отсутствию болезней и недомоганий».
С биохимической точки зрения организм можно считать здоровым, если многие тысячи реакций, протекающих внутри клеток и во внеклеточной среде, идут в таких условиях и с такими скоростями, которые обеспечивают максимальную жизнеспособность организма и поддерживают физиологически нормальное состояние.
Все болезни – это проявление каких-то изменений в свойствах молекул и нарушений хода химических реакций и процессов
Слайд 8
Вклад биохимических исследований в диагностику и лечение заболеваний
Выявление
причины болезней
Предложение рационального и эффективного пути лечения
Разработка методики для
массового обследования населения с целью ранней диагностики
Контроль хода болезни и эффективности проводимого лечения.
(Пример - энзимопатии)
Слайд 9
Жизнь есть способ существования белковых тел.
Белки – это
высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков
аминокислот.
Жизнь немыслима без обмена веществ, без постоянного обновления составляющих компонентов живого организма, без анаболизма и катаболизма, в основе которой лежит деятельность катаболически активных белков - ферментов. Таким образом, белки являются основой структуры и функции живой системы.
Слайд 10
Функции белков
По образному выражению одного из основоположников молекулярной

биологии Ф.Крика, белки важны потому, что они могут выполнять
самые разнообразные функции:
1. Структурная (пластическая) - белки образуют основу протоплазмы живой клетки, в комплексе с липидами они являются основным структурным материалом всех цитоплазматических мембран и органелл.
2. Каталитическая – все биохимические реакции катализируются белками-ферментами.
3. Дыхательная – белок крови гемоглобин транспортирует кислород от легких и углекислый газ из клеток органов к легким, т.е. органам дыхания.
4. Транспортная - в транспорте липидов принимают участие альбумины сыворотки крови. Ряд других сывороточных белков образует комплексы с жирами, медью, железом, тироксином, витамином А и др. соединениями, обеспечивая их доставку в соответствующие органы-мишени.
5. Защитная – важнейшие факторы иммунитета – иммуноглобулины и система комплемента являются белками. Процесс свертывания крови, защищающий организм от чрезмерной кровопотери происходит с участием белков свертывающей системы.
6. Сократительная – в акте мышечного сокращения и расслабления участвуют специфические белки мышечной ткани- актин и миозин.
7. Рецепторная – функция восприятия различных воздействий из вне и из внутренней среды осуществляется гликопротеидами.
8. Гормональная – гуморальная регуляция осуществляется белковыми гормонами.
Подсчитано, что в природе существует от 1010 до 1012 различных белков, обеспечивающих существование 1,2 х 108 видов живых организмов. По мнению академика Ю.Овчинникова белки являются «законодателями мод» в организме человека.
Слайд 11
Структурной единицей белка является аминокислота.
Аминокислоты – это карбоновые
кислоты у которых атом водорода у альфа углеродного атома
замещен на амино-группу.
R – CH- COOH
I
NH2
Слайд 12
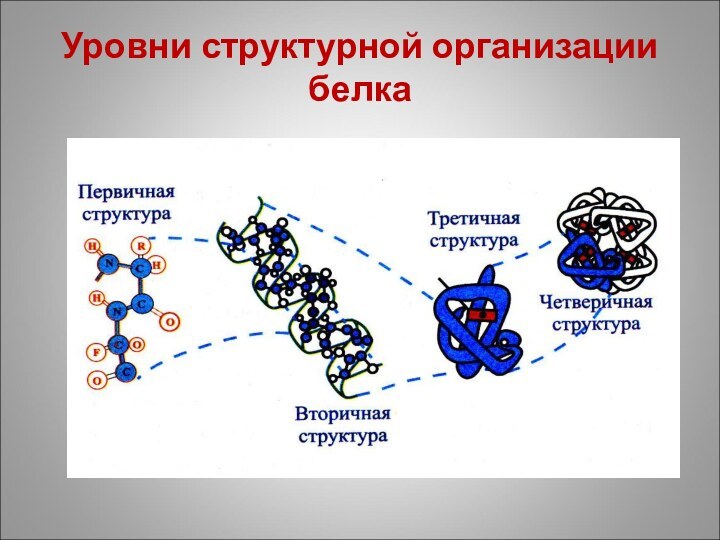
Уровни организации белка - структуры белка
первичная
вторичная
третичная
четвертичная
Слайд 13
Уровни структурной организации белка
Слайд 14
Первичная структура белка
Первичная структура – это уникальная аминокислотная
последовательность, детерменированная генетически и образованная пептидными или амидными связями.
В первичной структуре заложен весь план дальнейшей пространственной укладки белковой молекулы.
Стабилизируется пептидными связями.
Слайд 15
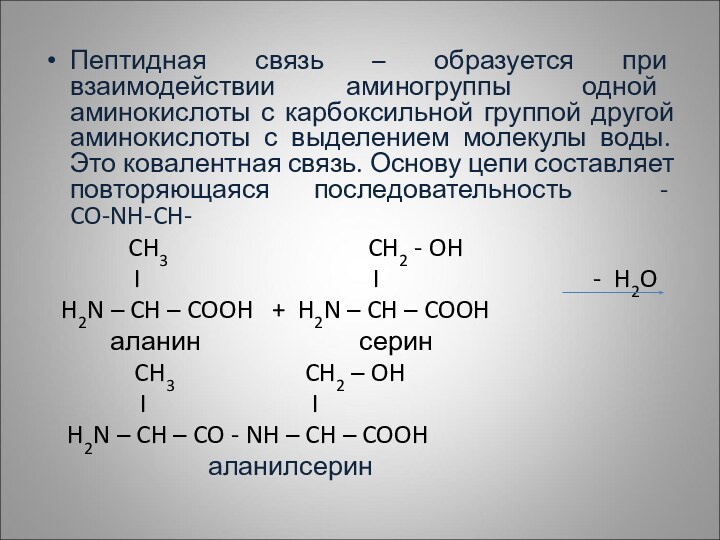
Пептидная связь – образуется при взаимодействии аминогруппы одной
аминокислоты с карбоксильной группой другой аминокислоты с выделением молекулы
воды. Это ковалентная связь. Основу цепи составляет повторяющаяся последовательность - CO-NH-CH-
CH3 CH2 - OH
I I - H2O
H2N – CH – COOH + H2N – CH – COOH
аланин серин
CH3 CH2 – OH
I I
H2N – CH – CO - NH – CH – COOH
аланилсерин
Слайд 17
Вторичная структура
Вторичная структура это пространственная конфигурация полипептидных
цепей, которые стремятся уменьшить свободную энергию, то есть способ
ориентации полипептидных цепей в пространстве.
Различаем α -спирализацию и β – структуру, беспорядочный клубок.
Слайд 18
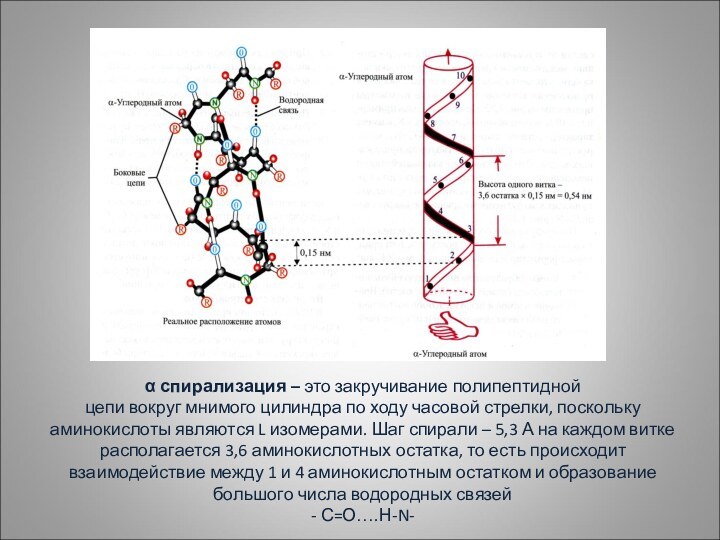
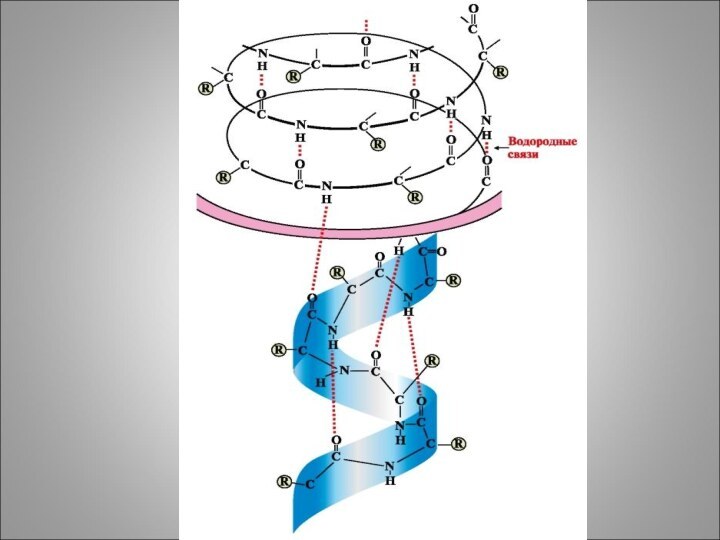
α спирализация – это закручивание полипептидной
цепи вокруг мнимого
цилиндра по ходу часовой стрелки, поскольку аминокислоты являются L
изомерами. Шаг спирали – 5,3 А на каждом витке располагается 3,6 аминокислотных остатка, то есть происходит взаимодействие между 1 и 4 аминокислотным остатком и образование большого числа водородных связей
- С=О….Н-N-
Слайд 20
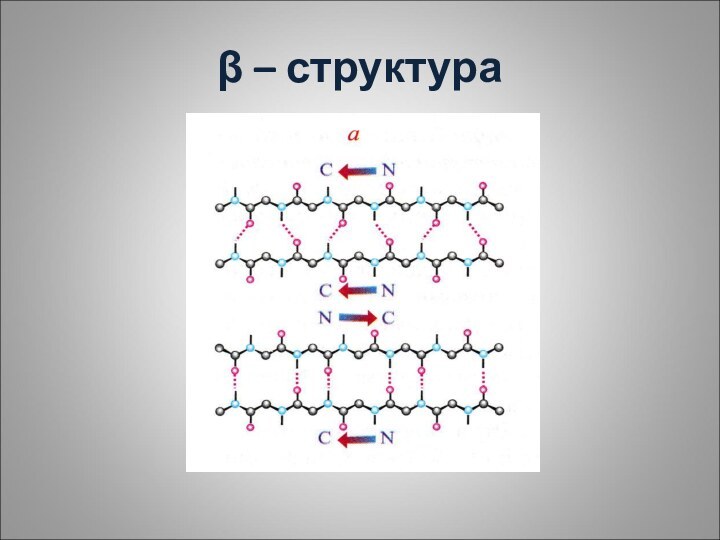
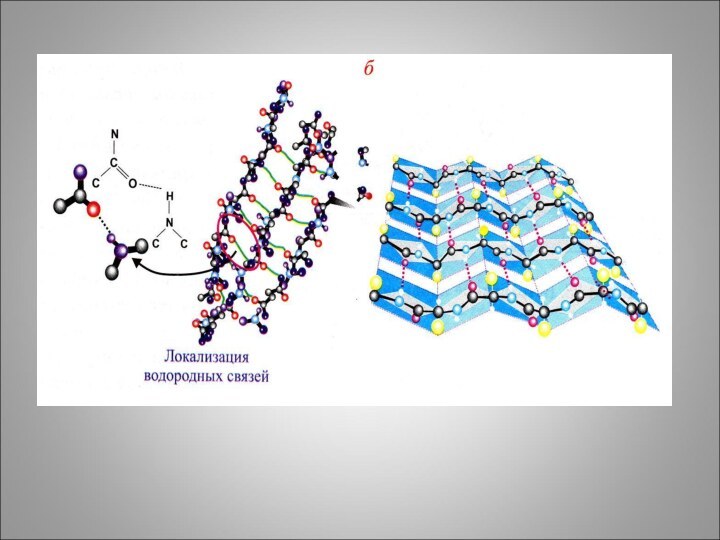
Некоторые фибриллярные белки образуют конформацию β – структуры-
структуры складчатого листа, то есть, последовательный ряд листков, расположенных
под углом друг другу. Она может сформироваться между отдельными полипептидными цепями и может быть параллельной и антипараллельной.
Слайд 24
Связи, поддерживающие
вторичную структуру:
водородные
электростатические
гидрофобные
ван-дер-ваальсовые
Слайд 25
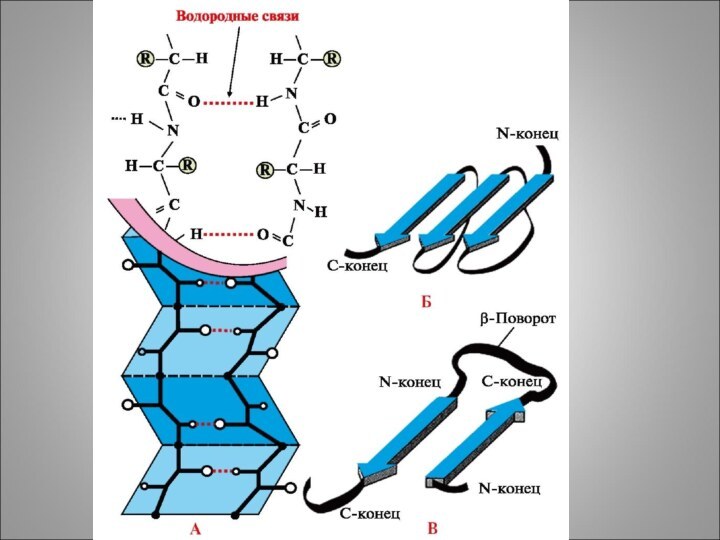
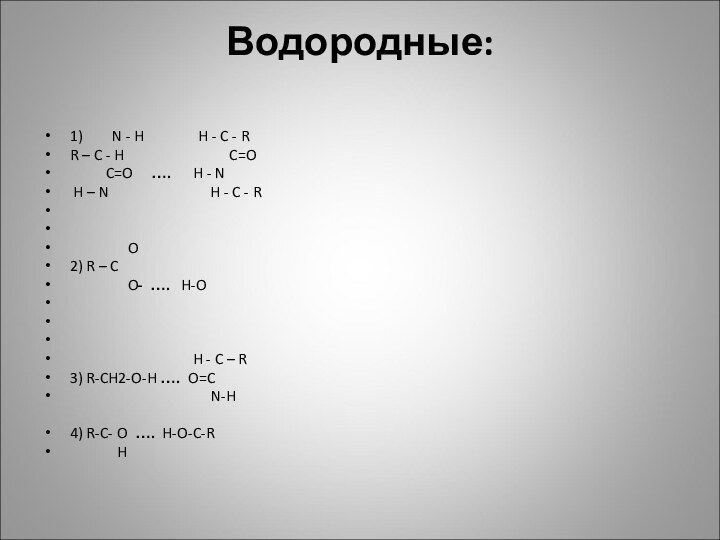
Водородные:
1) N - H
H - C
- R
R – C - H C=O
C=O …. H - N
H – N H - C - R
O
2) R – C
O- …. H-O
H - C – R
3) R-CH2-O-H …. O=C
N-H
4) R-C- O …. H-O-C-R
H
Слайд 26
Третичная структура-
Третичная структура- это способ укладки полипептидной цепи

в определенном объеме пространства. Она прежде всего зависит от
характера боковых групп аминокислотных остатков - радикалов. Каждая из этих групп стремится к наиболее выгодным энергетическим взаимодействиям с другими группами и атомами. Каждая специфическая последовательность аминокислот в полипептидной цепи всегда занимает определенное негативное положение в пространстве, обеспечивающая максимально выгодного числа связей между атомами полимера и его окружением.
Силы, которые способствуют формированию – это разновидности слабых связей, но поддерживается третичная структура ковалентными дисульфидными связями. Дисульфидные связи не определяют характер свертывания полипептидной цепи, но несомненно стабилизируют конформацию молекулы , после завершения процесса свертывания.
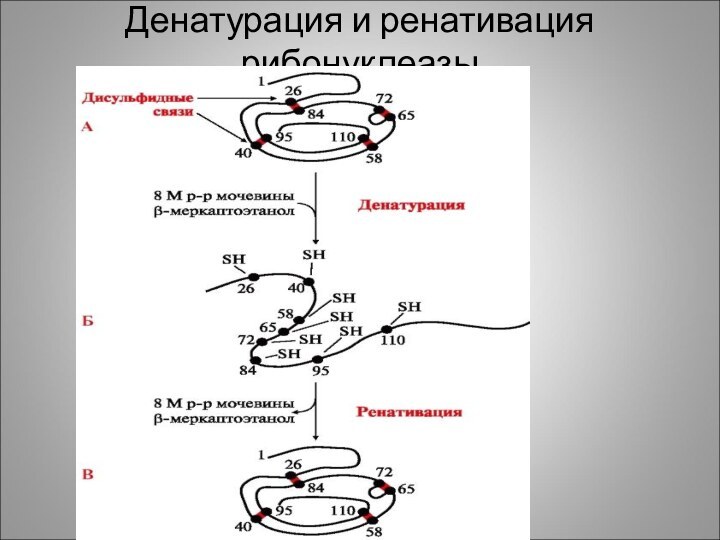
Например: фермент рибонуклеаза состоит из одной полипептидной цепи (124 аминокислотных остатка) содержит 4 дисульфидных мостика. В положениях 26-84, 72-65, 40-95, 58-110.
При формировании третичной структуры гидрофобные группировки располагаются во внутренней области молекулы.
Слайд 27
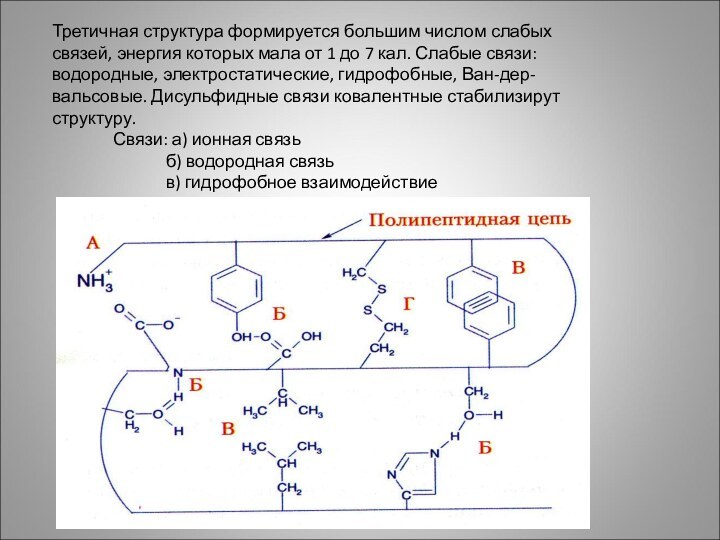
Третичная структура формируется большим числом слабых связей, энергия
которых мала от 1 до 7 кал. Слабые связи:
водородные, электростатические, гидрофобные, Ван-дер-вальсовые. Дисульфидные связи ковалентные стабилизирут структуру.
Связи: а) ионная связь
б) водородная связь
в) гидрофобное взаимодействие
г) дисульфидная связь.
Слайд 28
Водородные связи между радикалами аминокислот
Слайд 30
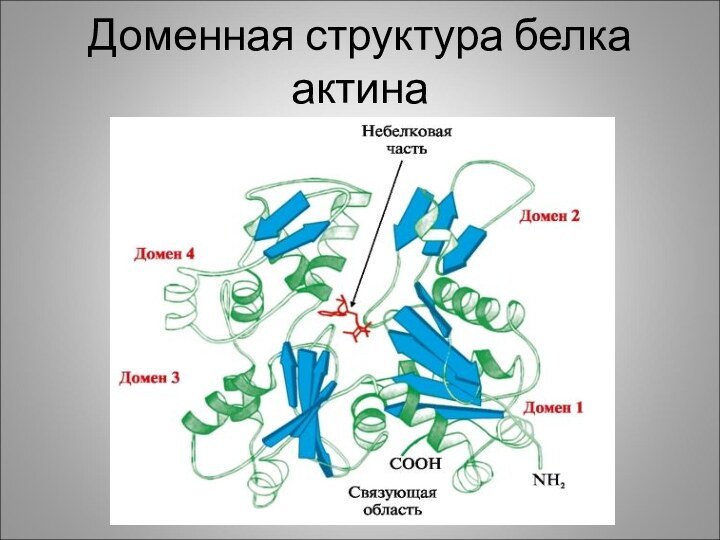
Доменная структура белка актина
Слайд 31
Денатурация и ренативация рибонуклеазы
Слайд 32
Четвертичная структура
Четвертичная структура – это способ укладки в
пространстве отдельных полипептидных цепей, обладающих одинаковой или разной первичной,
вторичной, третичной структурой и формирующих единое макромолекулярное образование в структурном и функциональном отношениях.
Эту способность белок приобретает при определенном способе пространственного объединения входящих в его состав протомеров образовавшуюся молекулу называемая мультиметром, (построены из четного числа протомеров от 2 до 4, реже от 6 до 10,12…).
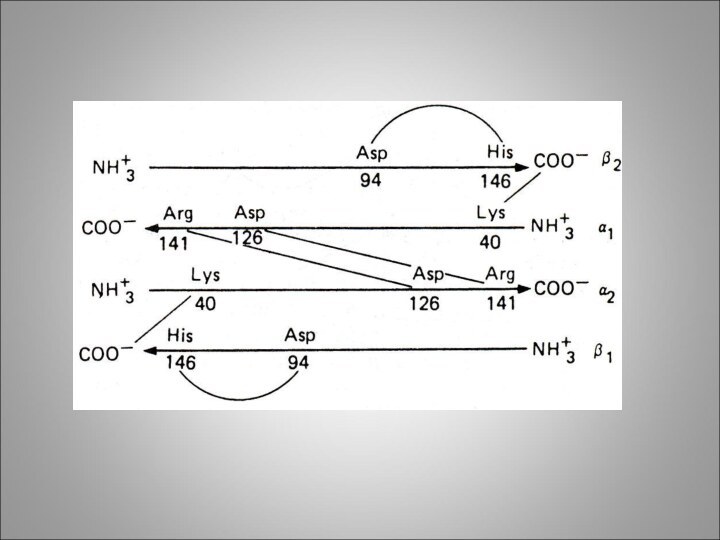
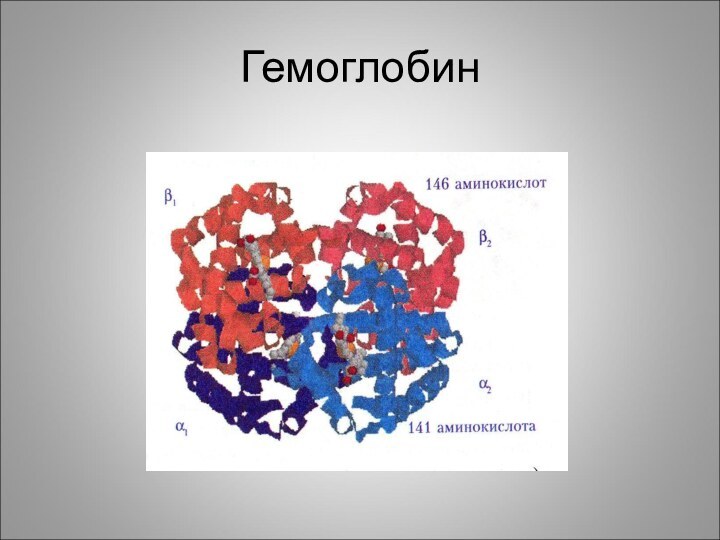
Субъединица – функционально активная часть молекулы мультимерного белка. Молекула гемоглобина состоит из α -, и β – субчастиц, каждая из которых состоит из 2-х одинаковых α -, и β –полипептидных цепей т.е. молекула гемоглобина состоит из 4-х полипептидных цепей, каждая из которых окружает группу гема.
Слайд 35
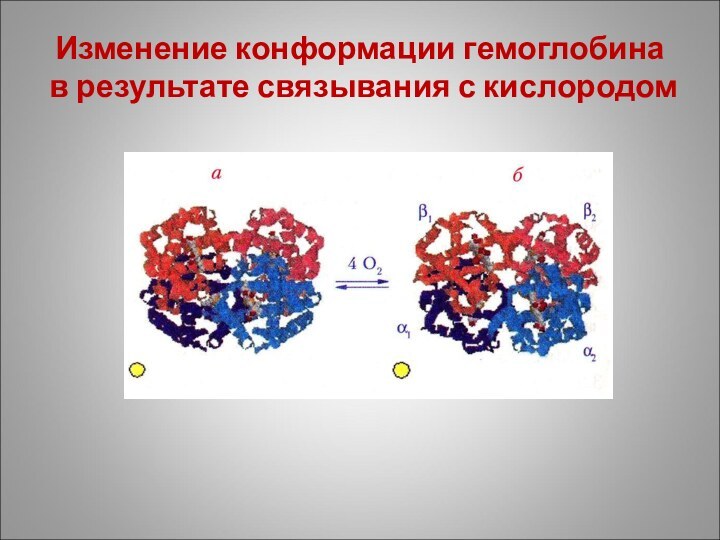
Изменение конформации гемоглобина в результате связывания с кислородом
Слайд 36
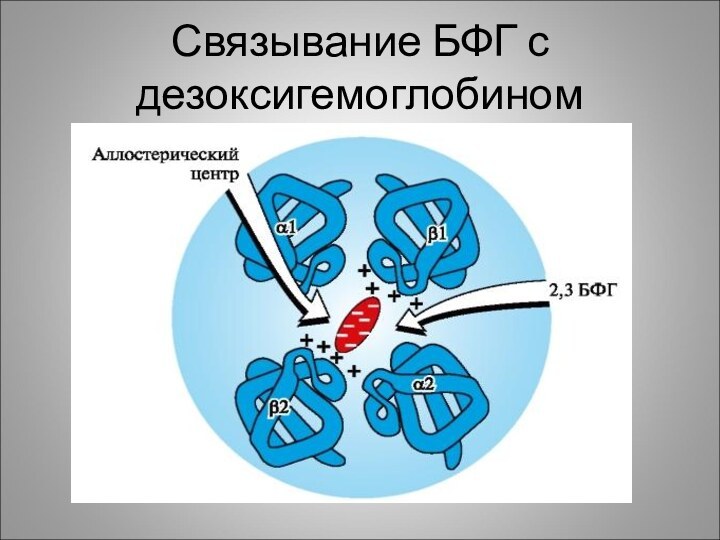
Связывание БФГ с дезоксигемоглобином
Слайд 37
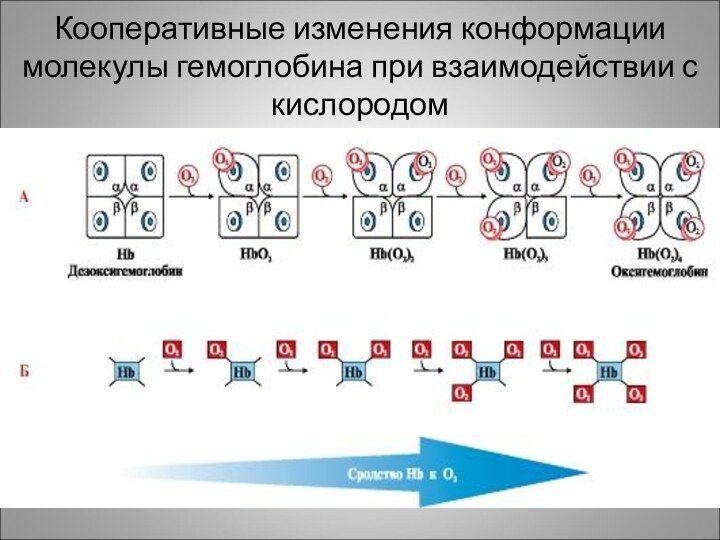
Кооперативные изменения конформации молекулы гемоглобина при взаимодействии с
кислородом
Слайд 38
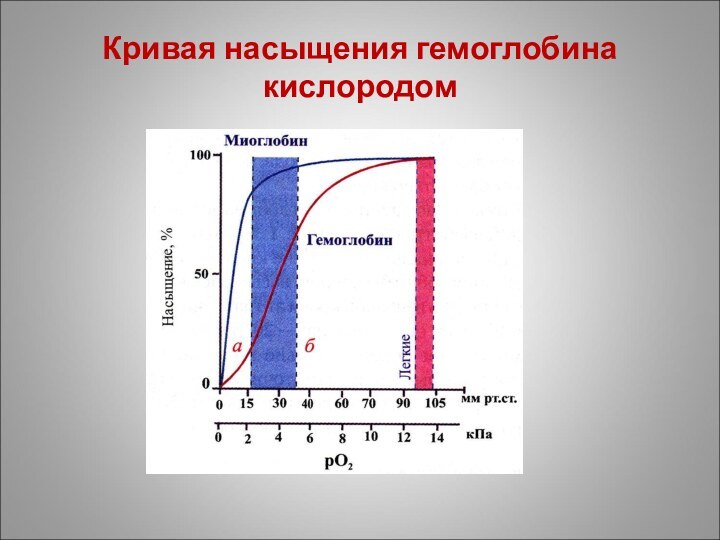
Кривая насыщения гемоглобина кислородом
Слайд 39
Виды гемоглобина человека
Гемоглобин А (НвА) - α 2β2
- основной тип гемоглобина у взрослых
Гемоглобин А2 (НвА 2)
- α 2δ2 - минорный тип гемоглобина у взрослых
Гемоглобин F (НвF) - α 2γ2 - основной тип гемоглобина у плода