Слайд 2
План лекции
Нервная ткань: определение понятия, классификация по функциям
и клеточному составу.
Нейрон – как основная морфо-функциональная единица нервной
системы: особенности структуры, состава органелл, функции. Нейрональная теория функционирования высшей нервной системы.
Головной мозг: химический состав сухого остатка, белого и серого вещества, нейронов, синапсов, нервных волокон. Особенности обмена – энергетического, углеводного, липидного, нуклеотидного и нуклеиновых кислот, белкового и аминокислот. Биохимические причины и механизмы развития патологических состояний.
Биохимические основы нервной деятельности. Виды синапсов и рецепторов, обмен нейромедиаторов и механизмы передачи нервного импульса через синапсы. Основные ингибиторы механизмов передачи нервного импульса в различных видах синапсов.
Биохимические показатели крови, мочи, спинномозговой жидкости, отражающие функциональное состояния нервной ткани.
Слайд 3
Функции нервной системы:
воспринимает информацию из внешней и внутренней
среды;
перерабатывает полученную информацию;
хранит информацию;
генерирует сигналы, обеспечивающие ответные реакции, адекватные
действующим раздражителям.
координирует взаимодействие организма с внешней средой,
координирует функции различных органов и тканей
осуществляет интеграцию частей организма в единое целое,
является центральным органом поддержания гомеостаза.
Принципы действия нервной системы
Слайд 4
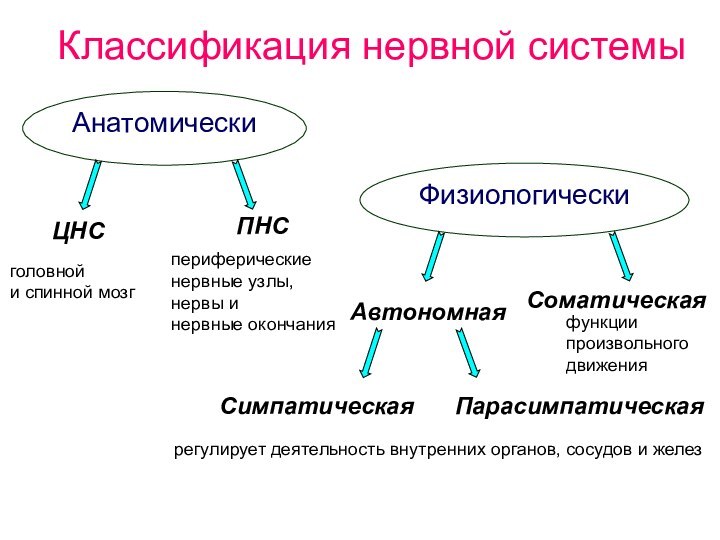
Классификация нервной системы
Анатомически
Физиологически
ЦНС
ПНС
Соматическая
Автономная
Симпатическая
Парасимпатическая
головной
и спинной мозг
периферические
нервные узлы,
нервы и
нервные окончания
функции
произвольного
движения
регулирует деятельность внутренних органов, сосудов и желез
Слайд 5
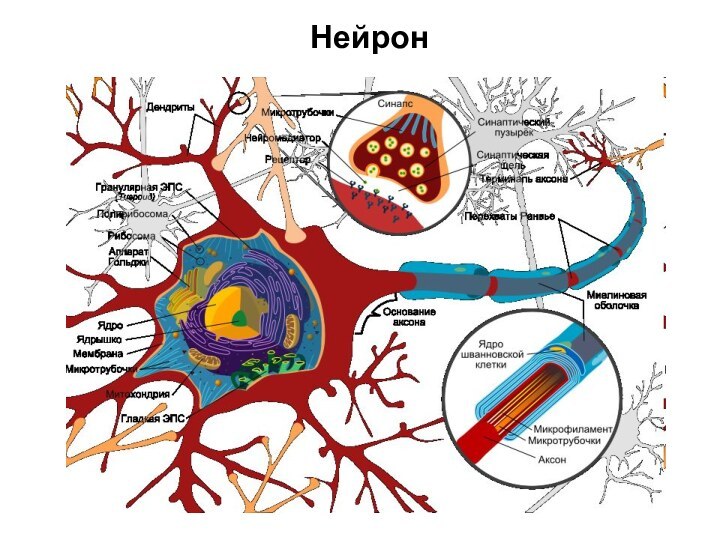
Функциональной тканью нервной системы является нервная.
Нервная ткань
– это высокоспециализированная ткань, обладающая возбудимостью и проводимостью, она
состоит из:
Нейронов
Нейроглии
Макролия (астроциты, эпендимоциты, олигодендроциты)
Микроглия (тканевые макрофаги)
Слайд 7
Нейроглия (от греческого glia – клей) это клетки
нервной системы, которые не проводят нервные импульсы. Глиальные клетки
занимают 50% объема ЦНС и более 90% от количества всех ее клеток.
Глиальные клетки обеспечивают деятельность нейронов, играя вспомогательную роль:
опорную,
трофическую,
Барьерную
Защитную
Секреторную (некоторые)
Слайд 8
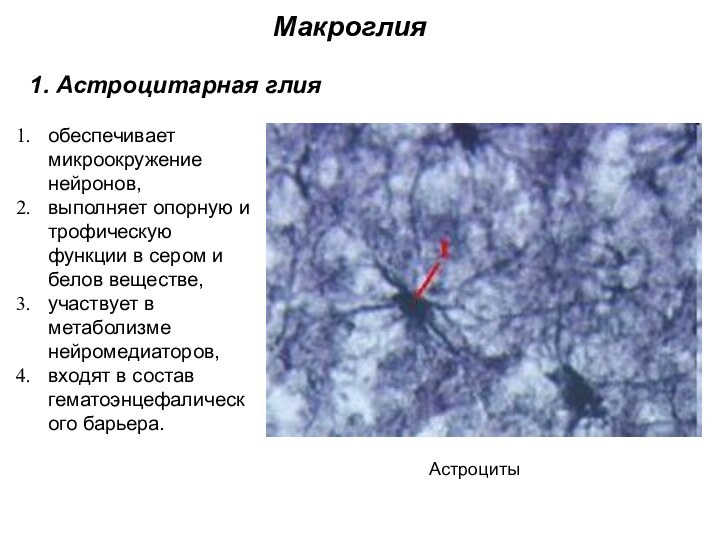
Макроглия
1. Астроцитарная глия
Астроциты
обеспечивает микроокружение нейронов,
выполняет опорную
и трофическую функции в сером и белов веществе,
участвует
в метаболизме нейромедиаторов,
входят в состав гематоэнцефалического барьера.
Слайд 9
образует выстилку желудочков головного мозга
входит в состав
гематоликворного барьера.
На снимке - просвет одного из желудочков мозга
(1).
Он заполнен жидкостью и выстлан эпендимой (2).
Под эпендимой - белое вещество (3) мозга.
2. Эпендимная глия
эпиндимоциты
Слайд 10
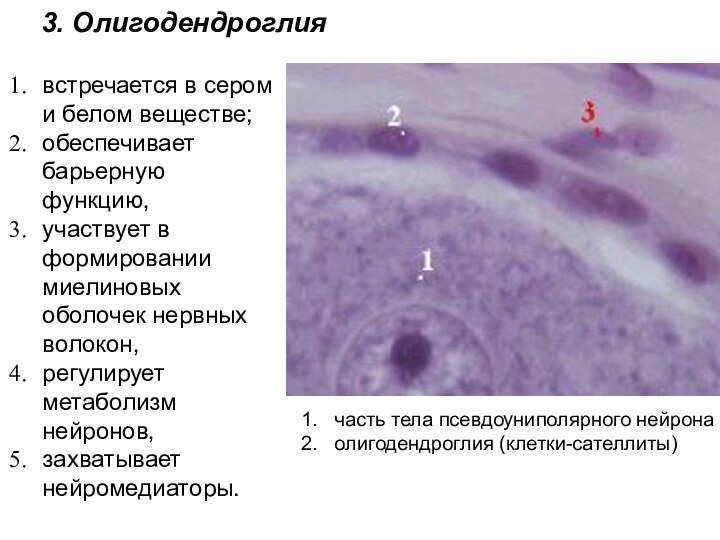
встречается в сером и белом веществе;
обеспечивает барьерную
функцию,
участвует в формировании миелиновых оболочек нервных волокон,
регулирует
метаболизм нейронов,
захватывает нейромедиаторы.
часть тела псевдоуниполярного нейрона
олигодендроглия (клетки-сателлиты)
3. Олигодендроглия
Слайд 11
Микроглия – специализированные макрофаги ЦНС.
Способны к амёбоидным
движениям и фагоцитозу
Активизируются при воспалительных и дегенеративных заболеваниях.
Выполняют
в ЦНС роль антиген-представляющих дендритных клеток
микроглиоциты
Микроглия
Слайд 12
Серое вещество образовано скоплением нейронов, тонких немиелинизированных нервных
волокон и нейроглии (астроциты, олигодендроциты)
в
ЦНС называется ядром, в ПНС – ганглием (узлом).
Белое вещество представлено совокупностью аксонов, покрытых миелиновой оболочкой и глиальных клеток (астроцитов).
в ЦНС носят название трактов, в ПНС образуют нервы.
По клеточному составу нервную ткань делят на:
Слайд 13
Химический состав нервной ткани
Слайд 14
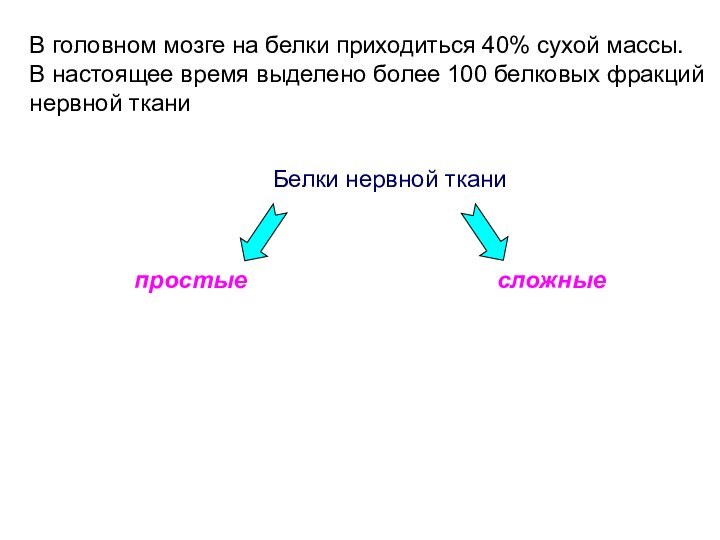
Белки нервной ткани
сложные
простые
В головном мозге на белки
приходиться 40% сухой массы.
В настоящее время выделено более
100 белковых фракций нервной ткани
Нейроальбумины – основные растворимые белки (80%)
Нейроглобулины -
5%.
Катионные белки - основные белки (рН 10 – 12) - гистоновые.
Нейросклеропротеины (нейроколлагены, нейроэлластины)– 10% - структурно-опорная функция
Гликопротеины –нейрорецепция
Протеолипиды – структурная ф -я
Нейроспецифические белки
Нейроспецифическая енолаза (Белок 14-3-2) - кислый белок в нейронах ЦНС
Белок Р-400 - в мозжечке - двигательный контроль
Нейротубулин, нейростенин, актиноподобные белки - подвижность цитоскелета, активный транспорт веществ.
Гликопротеины гипоталамуса,
нейрофизины - гуморальная регуляция
Нейроспецифические поверхностные антигены (NS1, NS2, L1)
Факторы адгезии клеток (N-САМ) - на мембране нейронов
Слайд 17
Белок S100 - гетерогенный кислый Сa-связывающий белок, локализуется
в нейроглии (в астроцитах) и интенсивно нарабатывается в клетках
гиппокампа при обучении, тренировках, формировании условных рефлексов.
Белок В-50 - один из основных фосфорилируемых белков плазматических мембран нейронов. Локализован в синапсах и является эндогенным субстратом диацил-глицерол-зависимой и Са-зависимой протеинкиназы С.
Слайд 18
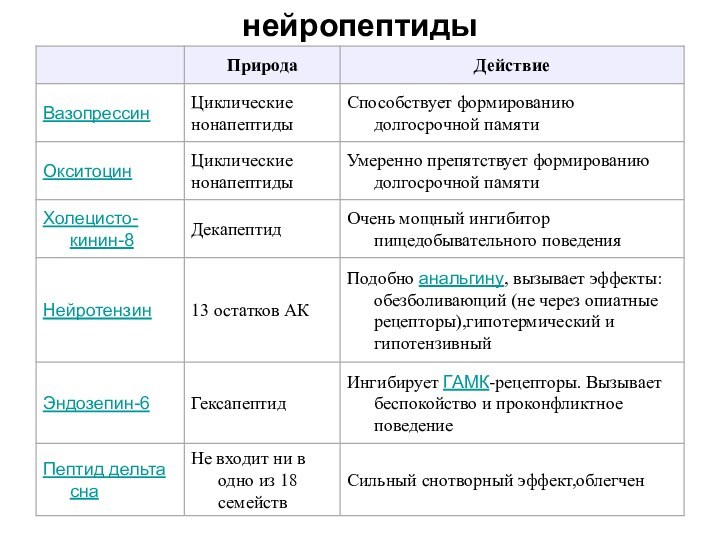
НЕЙРОПЕПТИДЫ - эндогенные регуляторы функций ЦНС
Осуществляют контроль:
за экспрессией вторичных клеточных мессенджеров,
цитокинов
и других сигнальных молекул,
за запуском генетических программ апоптоза ,
антиапоптозной защиты,
усиления нейротрофического обеспечения
Слайд 22
Ферменты
Нейроспецифическая енолаза
ЛДГ (ЛДГ1, ЛДГ2 в нейронах, ЛДГ5
- в глии),
АСТ,
альдолаза,
креатинкиназа (ВВ),
гексокиназа,
глутамат-дегидрогеназа,
Малат-дегидрогеназа
холинэстераза,
Кислая фосфатаза,
Моноаминоксидазы.
Слайд 23
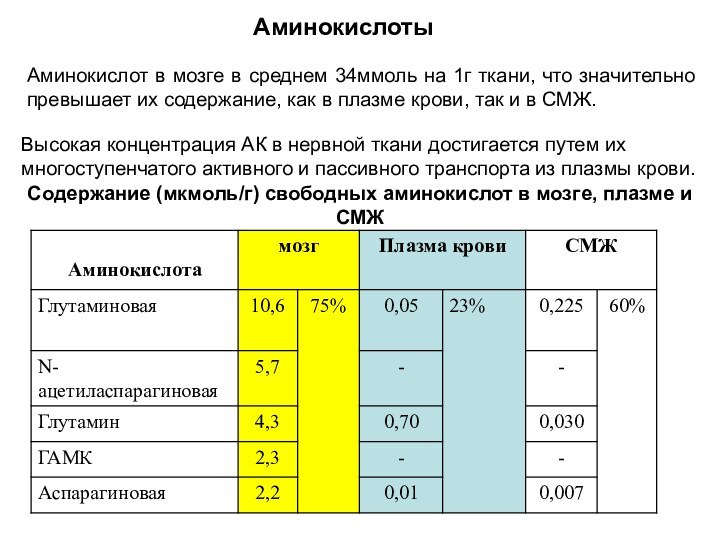
Аминокислоты
Содержание (мкмоль/г) свободных аминокислот в мозге, плазме и
СМЖ
Аминокислот в мозге в среднем 34ммоль на 1г ткани,
что значительно превышает их содержание, как в плазме крови, так и в СМЖ.
Высокая концентрация АК в нервной ткани достигается путем их многоступенчатого активного и пассивного транспорта из плазмы крови.
Слайд 24
Липиды нервной ткани
фосфоглицериды в сером
веществе составляют более 60% от всех липидов, а в белом – около 40%.
Холестерин - 25% от общего содержания липидов (повышает электроизоляционные свойства клеточных мембран, защищает их от ПОЛ, защищает от повреждения).
Сфинголипиды (ганглиозиды и цереброзиды), участвуют в процессах коммуникации нервной клетки с окружающей ее средой, в передаче сигналов с наружной поверхности клетки внутрь.
ХС, сфингомиелинов, сульфатидов и особенно цереброзидов содержится больше в белом веществе, чем в сером.
Много этерефицированных жирных кислот (пальмитиновой, стеариновой, олеиновой и арахидоновой).
Нервная ткань отличается высоким содержанием и разнообразием липидов, которые придают ей специфические особенности.
Слайд 25
Ганглиозиды - в сером веществе - Gм1, GD1a,
GD1b, GT1. Синтез ганглиозидов связан с дифференциацией нейронов.
Функции ганглиозидов:
1). являются рецепторами внешних сигналов; 2). с гликопротеинами отвечают за специфичность клеточной поверхности, распознавание клеток и их адгезию; 3). участвуют в развитии нервной системы при образовании «правильных» межклеточных связей; 4). участвуют в коммуникации между мембранами аксонов и окружающими их олигодендроглиальными клетками; 5). участвуют в функциональной адаптации зрелой нервной системы.
Фосфатидилинозитолы - 2% от об. липидов - в мембранах, миелине. Участвуют в инозитолтрифосфатной системе передаче сигнала.
Слайд 26
Углеводы нервной ткани
много олигосахаров (составляют 2-10% массы плазматической
мембраны) придают ей индивидуальность и специфичность.
мало глюкозы (0,05%) и
гликогена
Слайд 27
Нуклеотиды нервной ткани
Клетки Пуркинье мозжечка содержат избыточное количество
ДНК.
Необычно короткие нуклеосомные единицы, наличие редких вариантов гистонов, большое
разнообразие негистоновых белков и высокая матричная активность.
Содержание РНК в нейронах велико, что связано с активным синтезом белка. Среднее отношение РНК/ДНК может достигать 50
Содержание цАМФ и цГМФ в головном мозге значительно выше, чем во многих других тканях.
Слайд 28
Макроэргические соединения нервной ткани
Содержание креатина и креатинфосфата более,
чем в 2 раза превышает количество адениновых нуклеотидов –
АТФ.
Слайд 29
Минеральные вещества нервной ткани
Na+, K+, Cu2+, Fe2+, Ca2+,
Mg2+ и Mn2+ распределены в головном мозге относительно равномерно
между серым и белым веществом.
Содержание фосфора в белом веществе выше, чем в сером.
В мозговой ткани существует дефицит анионов, который покрывается за счет белков и липидов (у липидов нервной ткани важная роль в ионном балансе).
Слайд 30
Строение нервного волокна. Миелиновая оболочка
1
2
3
1-аксон; 2-миелин; 3-ось волокна;
4-белок (наружные слои)
5-липиды; 6-белок (внутренний слой); 7-холестерин;
8-цереброзид;
9- сфингомиелин; 10-фосфатидилсерин.
Белки миелина ЦНС:
Протеолипид
Основной белок миелина А1 (МВР)
Белки Вольфграма
Белки миелина ПНС:
белками А1 (немного)
Р0 и Р2.
В миелине активны ферменты:
холестеролэстеразы;
фосфодиэстеразы, гидролизирующей цAMФ;
протеинкиназы А, фосфорилирующей основной белок;
сфингомиелиназы;
карбоангидразы.
Слайд 31
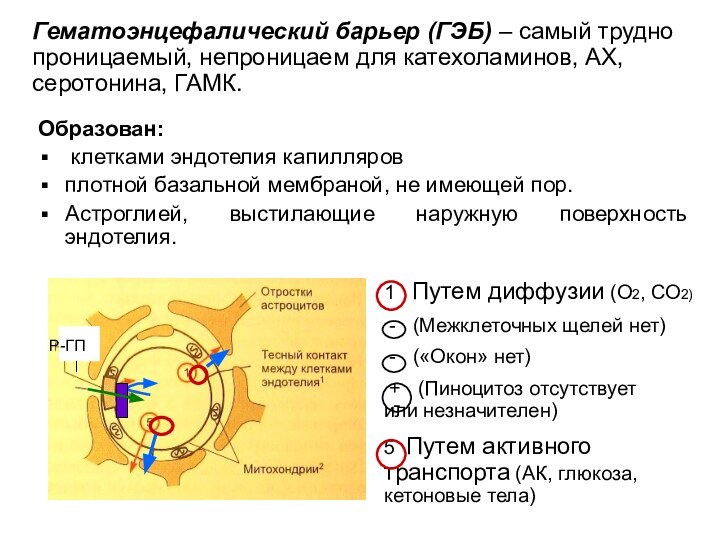
Образован:
клетками эндотелия капилляров
плотной базальной мембраной, не
имеющей пор.
Астроглией, выстилающие наружную поверхность эндотелия.
Р-ГП
1
Путем диффузии (О2, СО2)
- (Межклеточных щелей нет)
- («Окон» нет)
+ (Пиноцитоз отсутствует или незначителен)
5 Путем активного транспорта (АК, глюкоза, кетоновые тела)
Гематоэнцефалический барьер (ГЭБ) – самый трудно проницаемый, непроницаем для катехоламинов, АХ, серотонина, ГАМК.
Слайд 32
Особенности метаболизма нервной ткани
Для мозга характерна высокая интенсивность
энергетического обмена с преобладанием аэробных процессов.
Головной мозг составляет
2-2,5% веса тела, а потребляет 10-20% О2, поглощаемого организмом. Газообмен в мозге превышает газообмен в мышечной ткани в 20 раз.
у детей в возрасте 4 лет к окончанию миелинизации и завершения процессов дифференцировки нервная ткань потребляет около 50% всего О2 поступающего в организм.
Энергетический обмен нервной ткани
Слайд 33
Основной энергетический субстрат для нервной ткани - глюкоза
За
1 минуту 100 г ткани мозга потребляют 5 мг
глюкозы (до 70% свободной глюкозы, выделяемой из печени в кровь)
85% глюкозы расходуется в аэробном гликолизе,
12% - в анаэробном гликолизе (до лактата)
3% - в ПФП, образуя НАДФН2 и рибозу
В экстремальных состояниях нервная ткань переключается на кетоновые тела (до 50% всей энергии).
Слайд 34
Обмен белков и аминокислот нервной ткани
Нервная ткань характеризуется
высоким обменом аминокислот и белков. Максимальная скорость в сером
веществе, минимальная в белом.
Аминокислоты используются :
для синтеза белков, пептидов, некоторых липидов, гормонов, биогенных аминов и др. В сером веществе преобладает синтез БАВ, в белом – белков миелиновой оболочки.
как нейротрансмиттеры и нейромодуляторы. АК и их производные участвуют в синаптической передаче (глу), в осуществлении межнейрональных связей.
Источник энергии. в ЦТК окисляются АК глутаминовой группы и с разветвленной боковой цепью (лейцин, изолейцин, валин).
Для выведения азота. При возбуждение нервной системы возрастает образование аммиака (в первую очередь за счет дезаминирования АМФ), который связывается с глутаминовой кислотой с образованием глутамина.
Слайд 35
Обмен азота нервной ткани
Источником аммиака в головном
мозге служит непрямое дезаминирование аминокислот с участием глутаматдегидрогеназы, а
так же дезаминирование с участием АМФ–ИМФ цикла.
Слайд 36
Липидный обмен нервной ткани
Особенность: липиды не используются в
качестве энергетического материала, а в основном идут на строительные
нужды.
В нейронах серого вещества из фосфоглицеридов наиболее интенсивно обновляются фосфотидилхолины и особенно фосфотидилинозитол, который является предшественником внутриклеточного посредника ИТФ.
В миелиновых оболочках обмен липидов протекает медленно, очень медленно обновляются холестерин, цереброзиды и сфингомиелины
Слайд 37
Механизмы передачи
нервного импульса
Слайд 38
Механизмы передачи нервного импульса
по нервному волокну
1. Потенциал
покоя (-70 мВ)
Na-канал
К-канал
2. Потенциал действия
а)Локальный ответ (-50 мВ)
Na
б)Стадия деполяризации
(0 мВ - +50 мВ)
в)Стадия реполяризации (-70 мВ)
К
Слайд 39
Са
Na
K
Синтез медиатора
Загрузка в везикулу
Слияние везикул
Специфические рецепторы
Открытие
Na канала
Проведение импульса
Открытие Сa канала
Деградация
медиатора
Обратное поглощение
Механизмы передачи нервного импульса
через химический синапс
Слайд 40
Аминокислотные медиаторы
ингибиторные нейтральные
(ГАМК, глицин, β-аланин и таурин).
возбуждающие
кислые
(глутамат и аспартат)
Глицин
открывает хлорные каналы
вызывает гиперполяризацию
тормозит возбудимость
постсинаптической мембраны
Нейромедиатор - это сигнальная молекула, синтезируется и запасается в нейроне, высвобождается при проведении нервного импульса и специфически связывается постсинаптической мембраной, где оно активирует или ингибирует постсинаптическую клетку посредством деполяризации и гиперполяризации.
Слайд 41
открывает хлорные каналы
вызывает гиперполяризацию
тормозит
возбудимость постсинаптической мембраны
ГАМК
Слайд 43
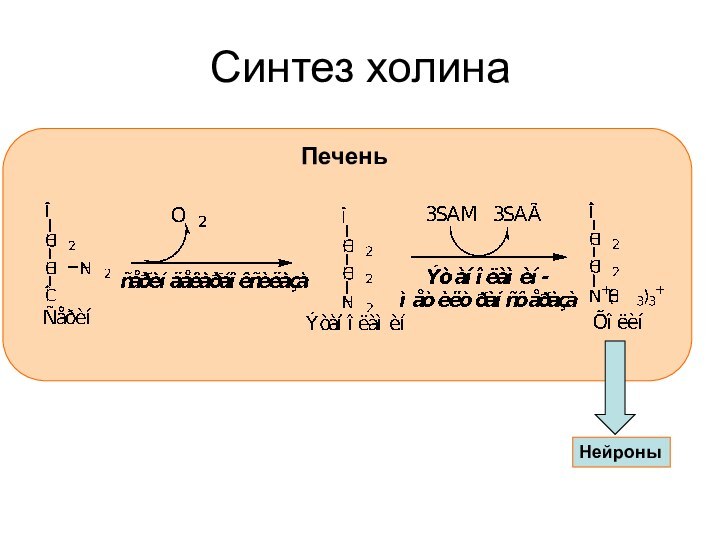
Синтез и распад медиатора на примере ацетилхолина
(CH3)3N-CH2-CH2-OH
холинацетилтрансфераза
(CH3)3N-CH2-CH2-O-CO-CH3
H2O
ацетилхолинэстераза
(CH3)3N-CH2-CH2OH
Нейрон
ПЕЧЕНЬ
CH3-CO-S-KoA
HS-KoA
CH3COOH
Слайд 44
Рецепторы
Рецепторы - это белки, встроенные в клеточную мембрану
или находящиеся внутри клетки, которые, взаимодействуя с сигнальными молекулами,
меняют активность регуляторных белков.
По механизму передачи сигнала рецепторы делятся на 4 типа:
1). Рецепторы, связанные с ионными каналами (холинэргические, ГАМК)
2). Рецепторы, с ферментативной активностью.
Бывают 3 видов:
а). Рецепторы, с тирозинкиназной активностью (тирозиновые протеинкиназы).
б). Рецепторы, с фосфатазной активностью (тирозиновые протеинфосфотазы) (например, ФПФ).
в). Рецепторы с гуанилатциклазной активностью (ГЦ).
3). Рецепторы, сопряженные с G-белками по строению их еще называют серпантинными (к норадреналину).
4). Ядерные и цитоплазматические рецепторы.
Слайд 45
Биохимические синдромы в психиатрии
Интоксикации (аминокислоты, кетокислоты, аммиак, мочевина)
Нарушения
окислительно-восстановительных процессов (гипоксия, накопление молочной к-ты, энергодефицит)
Гипоэргизма-гиперэргизма (гипогликемия-гипергликемия)
Алиментарной недостаточности
(аминокислоты, витамины)
Нарушения эндокринной и вегетативной регуляции (медиаторы -+)
Аутоиммунные (гамма-глобулины +)
Наследственные (дефекты ферментов)
Слайд 46
Патобиохимия нервной системы
1) Миастения - уменьшение числа холинорецепторов
3)
болезнь Паркинсона - дегенерация дофамин содержащих ней-
ронов нитростриарного проводящего пути
4) Депрессия - из-за истощения запасов моноаминовых нейроме-
диаторов в нейронах.
Шизофрения - из-за гиперреактивности дофаминовых рецепто-
ров в нейронах.
Слайд 47
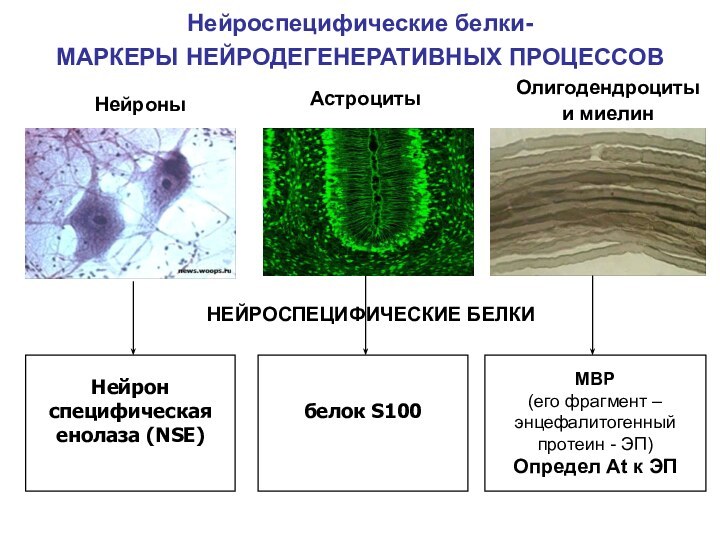
Нейроспецифические белки-
МАРКЕРЫ НЕЙРОДЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ
белок S100
Нейрон
специфическая
енолаза
(NSE)
Нейроны
Астроциты
Олигодендроциты
и миелин
MBP
(его фрагмент –
энцефалитогенный
протеин - ЭП)
Определ
Аt к ЭП
НЕЙРОСПЕЦИФИЧЕСКИЕ БЕЛКИ
Слайд 48
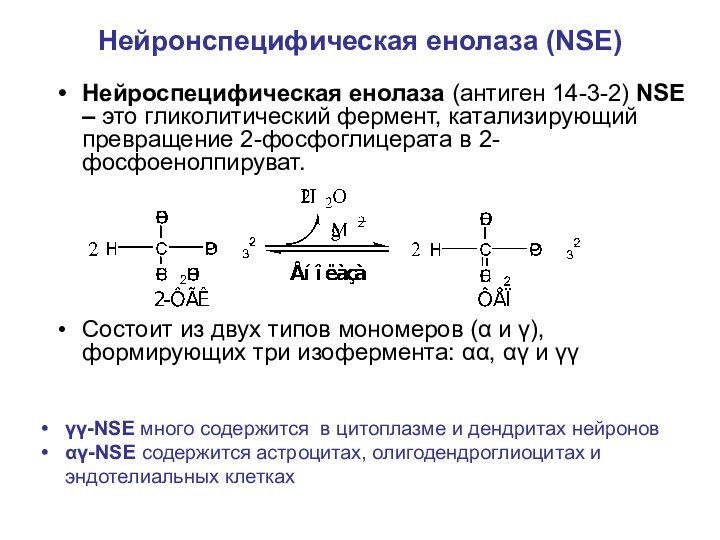
Нейронспецифическая енолаза (NSE)
Нейроспецифическая енолаза (антиген 14-3-2) NSE –
это гликолитический фермент, катализирующий превращение 2-фосфоглицерата в 2-фосфоенолпируват.
Состоит
из двух типов мономеров (α и γ), формирующих три изофермента: αα, αγ и γγ
γγ-NSE много содержится в цитоплазме и дендритах нейронов
αγ-NSE содержится астроцитах, олигодендроглиоцитах и эндотелиальных клетках
Слайд 49
Белок S100
S-100 - кальций-связывающий протеин.
Локализация мембраны, цитоплазма.
участвует в фосфорилировании белка, обеспечивает работу цитоскелета астроцитов, их
движение, рост и дифференцировку.
Семейство S-100 состоит из 20 тканеспецифичных мономеров, два из которых: α (10,4 кДа) и β (10,5 кДа) образуют гомо- и гетеродимеры, присутствующие в высокой концентрации в клетках нервной системы.
Гомодимер ββ присутствует в высоких концентрациях в глиальных и шванновских клетках, гетеродимер αβ находится в глиальных клетках.
Слайд 50
антитела к S100β являются специфичными маркерами повреждения астроцитарной
глии.
Ген S100 находиться в длинном плече 21-й хромосомы
в области 22.2-22.3, которая отвечает за фенотипические проявления синдрома Дауна.
При синдроме Дауна концентрация S100 в крови плода резко возрастает. Однако S100 не проходит плацентарный барьер, что не позволяет его использовать в качестве маркера синдрома Дауна.
В норме белок S100 не присутствует в сыворотке крови.
Увеличение концентрации S-100 (αβ) и S-100 (ββ) в спинномозговой жидкости и плазме свидетельствует о нарушении гематоэнцефалического барьера и гибели астроцитов.
Слайд 51
Основной белок миелина (MBP)
MBP - щелочной белок, с
высоким содержанием (25%) основных аминокислот (аргинина, лизина, гистидина).
Ген в
18 хромосоме.
Миелин содержит 3 изоформы MBP с массами: 21,5; 18,5 и 17,2 кДа.
MBP составляет 25-30% массы сухого вещества миелина
В ЦНС на долю MBP 35% всех белков миелина,в периферических нервах 18% всех белков.
функции: питание аксона, изоляция и ускорение проведения нервного импульса, опорная и барьерная функции, иммуногенез и энцефалитогенез
в молекуле МВР выявлено 27 антигенных детерминант, часть из них являются энцефалитогенными
эпитоп 85-96 имеет собственное название – энцефалитогенный протеин (ЭП).
Слайд 52
NSE, S100 и MBP – маркеры повреждения мозговой
ткани
Нейроспецифические белки в нормальных условиях обнаруживаются в крови в
следовых концентрациях, не приводящих к образованию аутоантител.
при повреждении нервной ткани повышается сначала их концентрация в СМЖ, а затем происходит их выход в кровоток.
К НСБ отсутствует иммунологическая толерантность, поэтому появление их в крови запускает аутоиммунную агрессию на эти антигены.
Слайд 53
NSE является высокоспецифичным маркером мелкоклеточного рака легкого и
нейробластомы, а также других опухолей нейроэктодермального или нейроэндокринного происхождения.
S100 (αβ- и ββ-димеры) служит диагностическим и прогностическим маркером злокачественной меланомы, глиальных опухолей ЦНС.
MBP также может определяться у больных с различными видами опухолей ЦНС, включая злокачественные. MBP отражает тяжесть рецидива в период обострения рассеянного склероза
НСБ являются маркерами деструктивных процессов вещества мозга (эпилепсия, нейродегенеративные заболевания, гидроцефалия, экстапирамидные расстройства, психические заболевания, шизофрения, психозы)
чем выше концентрация НСБ в сыворотке крови и СМЖ, тем выше вероятность летального исхода.
Слайд 54
концентрация белка НСБ увеличивается с возрастом, у мужчин
в большей степени, чем у женщин
NSE, S100 и
MBP включены в панель биохимических тестов в остром периоде инсульта
Слайд 55
Дофамин – нейромедиатор центральной нервной системы, а также

медиатор паракринной регуляции в ряде периферических органов ( слизистой
желудочно-кишечного тракта, почках), предшественник норадреналина и адреналина в ходе их синтеза.
Дофамин вырабатывается:
мозговым веществом надпочечников (3)
областью среднего мозга, называемой "Substantia nigra".
Биосинтез дофамина: происходит в нейронах промежуточного и среднего мозга.
Предшественником дофамина является L-тирозин (он синтезируется из фенилаланина), который гидроксилируется (присоединяет OH-группу) ферментом тирозингидроксилазой с образованием L-DOPA, которая, в свою очередь, теряет COOH-группу с помощью фермента L-DOPA-декарбоксилазы, и превращается в дофамин. Этот процесс происходит в цитоплазме нейрона.
Рецепторы дофамина: трансмембранные метаботропные G-белки, впервые были выделены в 1979 году. По своим структурным, биохимическим и фармакологическим характеристикам подразделяемые на:
D1-подобные (D1, D5) - D1-подобные рецепторы активируют аденилатциклазу
D2-подобные (D2, D3, D4) - D2 ингибируют аденилатциклазу.
Классификация предложенная в 1983 году подразделяет рецепторы дофамина по их эффектам:
Активация группы D1-подобных рецепторов вызывает релаксацию мышц и расширение сосудов, для этих рецепторов (R)-сульпирид, является сильным антагонистом, апоморфин — слабым агонистом, а домперидон на них не действует.
Активация группы D2-подобных рецепторов ингибирует действие норадреналина, апоморфин — их сильный агонист, а сильные антагонисты — (S)-сульпирид и домперидон.
Слайд 56
Катаболизм дофамина:
Синтезированный нейроном дофамин накапливается в дофаминовых
везикулах («синаптическом пузырьке»). В везикулу с помощью протон-зависимой АТФазы
закачиваются ионы H+. При выходе протонов по градиенту в везикулу поступают молекулы дофамина.
Далее дофамин выводится в синаптическую щель. Часть его участвует в передаче нервного импульса, воздействуя на клеточные D-рецепторы постсинаптической мембраны, а часть возвращается в пресинаптический нейрон с помощью обратного захвата.
Ауторегуляция выхода дофамина обеспечивается D2 и D3 рецепторами на мембране пресинаптического нейрона. Обратный захват производится транспортером дофамина. Вернувшийся в клетку медиатор расщепляется с помощью моноаминооксидазы (МАО) и, далее, альдегиддегидрогеназы и катехол-О-метил-трансферазы до гомованилиновой кислоты.
Слайд 57
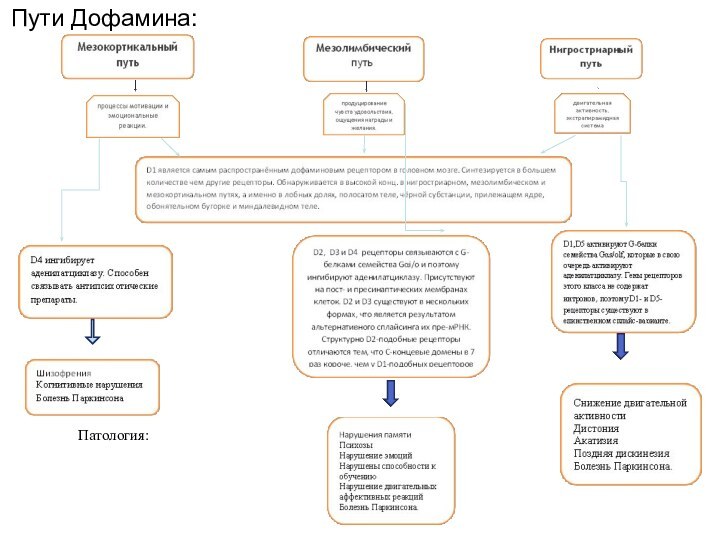
ДОФАМИНЕРГИЧЕСКАЯ СИСТЕМА ГОЛОВНОГО МОЗГА
Различают семь отдельных подсистем (первые

три являются основными):
1. Нигростриатная
2. Мезокортикальная
3. Мезолимбическая
4. Тубероинфундибулярная
5. Инцертогипоталамическая
6.
Диенцефалоспинальная
7. Ретинальная
Нигростриатная система. Аксонами нейронов нигростриарного тракта выделяется около 80 % мозгового дофамина.
Тела дофаминовых нейронов, находятся:
в компактной части черной субстанции - через аксоны дают проекции в дорсальный стриатум (полосатое тело)
в латеральном отделе вентрального поля покрышки среднего мозга – через аксоны дают проекции в вентральный стриатум.
Мезолимбическая система. Тела нейронов этой системы, расположены в вентральном поле покрышки среднего мозга и частично в компактной части черной субстанции. Отростки идут в: поясную извилину, энториальную кору, миндалину, обонятельный бугорок, аккумбентное ядро, гиппокамп, парагиппокампальную извилину, перегородку и др.
Тубероинфундибулярный тракт. Данный тракт образован аксонами нейронов, расположенных в аркуатном ядре гипоталамуса. Отростки таких нейронов достигают наружного слоя срединного возвышения.
Инцертогипоталамический тракт. Инцертогипоталамический тракт начинается от zona incerta и оканчивается в дорсальном и переднем отделах медиального таламуса, а также в перивентрикулярной области. Он принимает участие в нейроэндокринной регуляции.
Диенцефалоспинальный тракт. Источником проекций диенцефалоспинального тракта являются нейроны заднего гипоталамуса, отростки которых достигают задних рогов спинного мозга.
Ретинальный тракт. Ретинальный тракт расположен в пределах сетчатки глаза. Особенности этого тракта делают его среди других дофаминергических трактов достаточно автономным.
Патология:
Патология
Патология
Слайд 59
Заболевание развивается при недостаточности дофамина в чёрной субстанции
мозга.
Снижена активность тирозингидроксилазы, ДОФА-декарбоксилазы.
Патология Дофамина. Болезнь Паркинсона.
ЛОБНАЯ КОРА
D2 СКОРЛУПА D1
ЧЕРНАЯ СУБСТАНЦИЯ
НЕПРЯМОЙ ПУТЬ
ПРЯМОЙ ПУТЬ
НАРУЖНЫЙ СЕГМЕНТ БЛЕДНОГО ШАРА
СУБТАЛАМИЧЕСКОЕ ЯДРО
ВНУТРЕННИЙ СЕГМЕНТ БЛЕДНОГО ШАРА
СТВОЛ МОЗГА И СПИННОЙ МОЗГ
ППЯ
ТАЛАМУС
Функциональная организация экстрапирамидальной системы В НОРМЕ.
АКТИВИРУЮЩЕЕ ВЛИЯНИЕ (ГЛУТАМАТЕРГИЧЕСКИЕ)
ТОРМОЗЯЩЕЕ ВЛИЯНИЕ (ДОФАМИНЕРГИЕЧЕСКИЕ И ГАМКергические)
Слайд 60
Заболевание развивается при недостаточности дофамина в чёрной субстанции
мозга.
Снижена активность тирозингидроксилазы, ДОФА-декарбоксилазы.
Патология Дофамина. Болезнь Паркинсона.
ЛОБНАЯ КОРА
D2 СКОРЛУПА D1
ЧЕРНАЯ СУБСТАНЦИЯ
НЕПРЯМОЙ ПУТЬ
ПРЯМОЙ ПУТЬ
НАРУЖНЫЙ СЕГМЕНТ БЛЕДНОГО ШАРА
СУБТАЛАМИЧЕСКОЕ ЯДРО
ВНУТРЕННИЙ СЕГМЕНТ БЛЕДНОГО ШАРА
СТВОЛ МОЗГА И СПИННОЙ МОЗГ
ППЯ
ТАЛАМУС
Функциональная организация экстрапирамидальной системы ПРИ БОЛЕЗНИ ПАРКИНСОНА.
АКТИВИРУЮЩЕЕ ВЛИЯНИЕ (ГЛУТАМАТЕРГИЧЕСКИЕ)
ТОРМОЗЯЩЕЕ ВЛИЯНИЕ (ДОФАМИНЕРГИЕЧЕСКИЕ И ГАМКергические)
Слайд 61
1.Журнал экспериментальная и клиническая фармакология 2007 г. том

70. №4 с.11 «изучение эффектов острого и хронического введения
гимантана на обратный захват {3H}-дофамина синаптосомами стриатума крыс» Д. А. Абаимов, Г. И. Ковалев.
2. Журнал лечение нервных и психических заболеваний. Лечение болезни Паркинсона с 29. № 6 2006 год.
3.Федорова Н. В. , Шток В. Н., Стратегия и тактика лечения болезни Паркинсона. Консилиум 2001, 3, 5, 237-242.
4.Литвиненко И. В. Болезнь Паркинсона. Москва 2006 г. – 216. с. – ISBN 5-900518-51-5. стр 11, 12, 22.
5. Я. Кольман, К.- Г. Рем. Наглядная БИОХИМИЯ. 1998г. под редакцией канд. хим. наук П. Д. Решетова и канд. хим. наук Т. И. Соркиной. Москва “Мир” 2000.
6. Hervé D, Lévi-Strauss M, Marey-Semper I, Verney C, Tassin JP, Glowinski J, Girault JA (1993). «G(olf) and Gs in rat basal ganglia: possible involvement of G(olf) in the coupling of dopamine D1 receptor with adenylyl cyclase». J. Neurosci. 13 (5): 2237—2248. PMID 8478697
7. Переход от стандартной формы препаратов Л-дофа на сталево (Л-дофа/карбидопа/энтакапон) повышает качество жизни пациентов при болезни Паркинсона: результаты открытого клинического исследования Авторы: Одинак М.М. Литвиненко И.В. Могильная В.И. Сахаровская А.А. Сологуб О.С.
Издание: Журнал неврологии и психиатрии им.С.С.Корсакова
Год издания: 2009 .Объем: 4с. Дополнительная информация: 2009.-N 1.-С.51-54. Библ. 14.
8. М. Р. Сапин, Д. Б. Никитюк, В. С. Ревазов. Анатомия человека. В двух томах. Том 2. 5-е издание, пераб. И доп. – М.: Медицина, 2001-640с.: ил. ISBN5225045855.