- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Биосинтез белков, трансляция. (Лекция 13)
Содержание
- 2. Биосинтез белков осуществляется в цитоплазме эукариотической клетки,
- 3. Цикл (эпицикл) трансляции(задается фаза по триплетам) находиться
- 4. тРНК – адапторная молекула белкового синтеза
- 5. Химические реакции включения аминокислоты в полипептидную цепьрибосомный этап(реакция транспептидации)
- 6. ATPаминокислотааминоациладенилатPPiсвободная тРНКаминоацил-тРНК(«нагруженная» тРНК)AMP3’Amino acid activationandtRNA chargingРеакции, катализируемые аминоацил–тРНК-синтетазамисмешанная ангидридная связь сложноэфирная связь
- 7. Генетический код транслируется при участии двух адапторов:
- 8. Аминоацил-тРНК-синтетазы катализируют активацию аминокислот и аминоацилирование
- 9. Два класса аминоацил-тРНК-синтетаз Активируемыеаминокислоты Arg Leu
- 10. Пространственные модели комплексов аминоацил-тРНК-синтетаз с тРНККласс IКласс
- 11. тРНК – адапторная молекула белкового синтеза
- 12. Укладка Россмана (Rossmann fold)Пептидные мотивы, характерные для
- 13. 1. Два типа возможных ошибок аминоацил-тРНК-синтетазы (отбор
- 14. «Сверхспецифичность» аминоацил-тРНК-синтетаз: гидролитическое редактирование «неправильной» аминоацил-тРНК Частота
- 15. Элементы, определяющие «индивидуальность» (identity) тРНК, или элементы
- 16. Структура тРНКPhe и тРНКAsp
- 17. Отдельные элементы распознавания в тРНК антикодон (например,
- 18. Наборы элементов распознавания в тРНКИндивидуальность тРНК определяется
- 19. Вовлечение акцепторного конца и антикодона тРНКGln в комплекс с аминоацил-тРНК-синтетазой
- 20. Комплекс тРНКGln с глютаминил-тРНК-синтетазой (Т. Стейц)АТРВ приведенной
- 21. РИБОСОМА - крупный внутриклеточный макромолекулярный ансамбль,
- 22. химически – рибонуклеопротеид;физически - компактная частица, грубо
- 23. Реакция транспептидации Реакция транспептидации осуществляется в рибосоме
- 24. Модель рибосомы E.coli«перекрывающаяся»проекциябоковая проекция30S50SРибосома состоит из двух неравных лабильно ассоциированных субчастиц30S50S
- 25. Каждая рибосомнаясубчастица содержитодну молекулукомпактно свернутой высокополимернойрибосомной РНК,которая
- 26. Сравнение прокариотической и эукариотической рибосомS20=L26L7=ацетил.S12РНК : белок
- 27. Рибосомные белкиРазделение индивидуальных белковбактериальной (E. coli) 70S-рибосомы
- 28. Трехмерная модель 70S-рибосомы E.coli, содержащей молекулы рРНК
- 29. Типы рибосом
- 30. Определяющая роль рРНК в рибосоме Полость
- 31. Участки связывания тРНК в рибосоме Рибосома
- 32. Три участка связывания тРНК в рибосомеВ процессе
- 33. Положение мРНК в малой рибосомной субчастицеОриентация малой субчастицы та же, что и на предыдущем слайде (В).
- 34. Разделение декодирующей и энзиматической функций между субчастицамиРибосома
- 35. Расположение функциональных центров на малой и большой
- 36. Cech (2000) Science 289:878-879Ban et al. (2000)
- 37. Этап 1 - связывание аминоацил-тРНК в комплексе
- 38. кодоны мРНК132движение рибосомыРибосома как лентопротяжный механизмполярное 5’-3’
- 39. Конформационная подвижность рибосомыВзаимная подвижность двух рибосомных субчастиц;
- 40. Взаимная подвижность рибосомных субчастиц при элонгации (4
- 41. Доп. слайды
- 42. Катализируемый аминоацил-тРНК-синтетазами дорибосомный этап белкового синтеза приводит
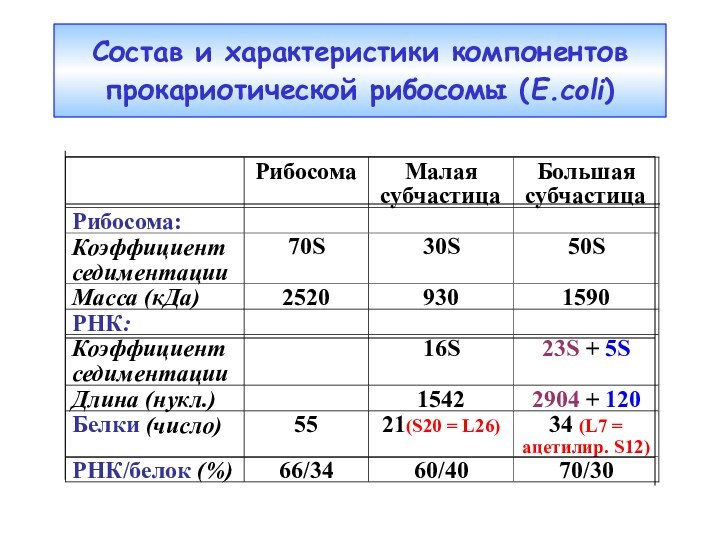
- 43. Состав и характеристики компонентов прокариотической рибосомы (E.coli)
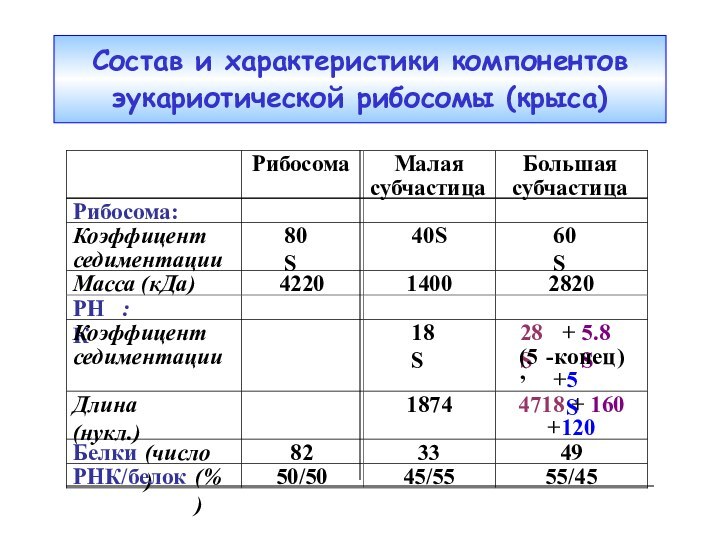
- 44. Состав и характеристики компонентов эукариотической рибосомы (крыса)
- 45. Трехмерная модель с высоким разрешением малой субчастицы
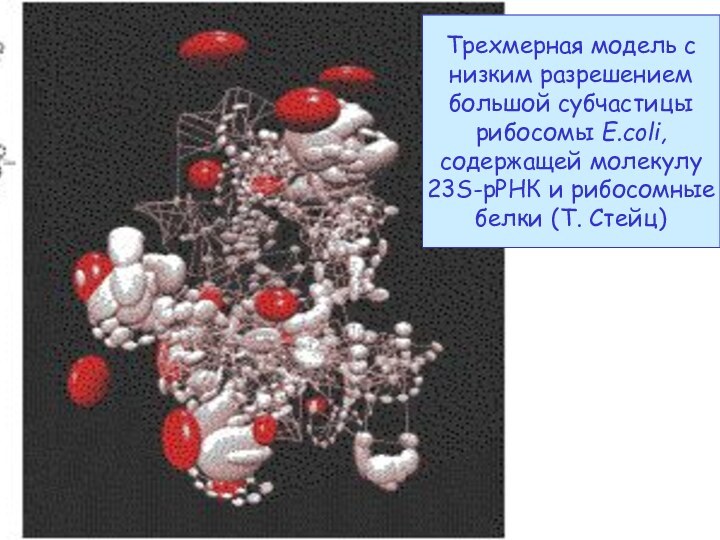
- 46. Трехмерная модель с низким разрешением большой субчастицы
- 47. Скачать презентацию
- 48. Похожие презентации

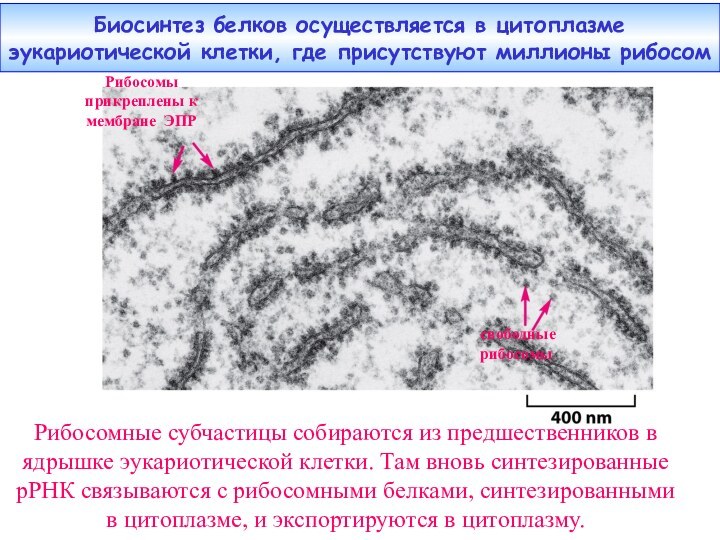



















Слайд 2 Биосинтез белков осуществляется в цитоплазме эукариотической клетки, где
присутствуют миллионы рибосом
субчастицы собираются из предшественников в ядрышке эукариотической клетки. Там вновь синтезированные рРНК связываются с рибосомными белками, синтезированными в цитоплазме, и экспортируются в цитоплазму.
Слайд 3
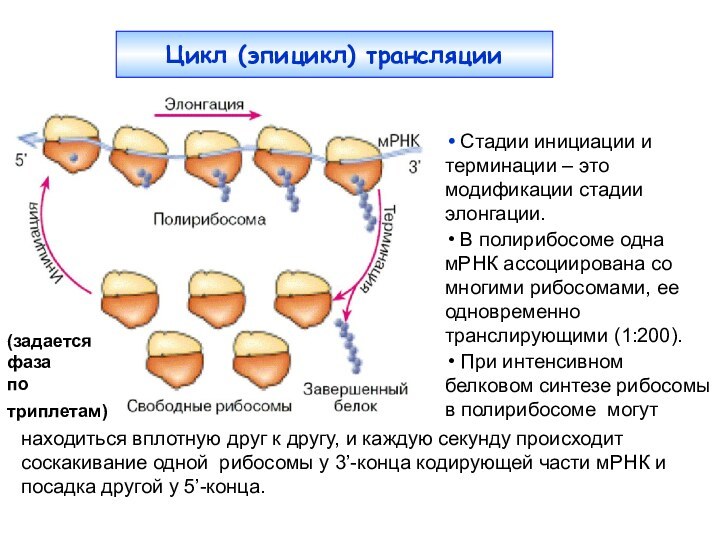
Цикл (эпицикл) трансляции
(задается фаза
по триплетам)
находиться вплотную
друг к другу, и каждую секунду происходит соскакивание
одной рибосомы у 3’-конца кодирующей части мРНК и посадка другой у 5’-конца. Стадии инициации и терминации – это модификации стадии элонгации.
В полирибосоме одна мРНК ассоциирована со многими рибосомами, ее одновременно транслирующими (1:200).
При интенсивном белковом синтезе рибосомы в полирибосоме могут
Слайд 4
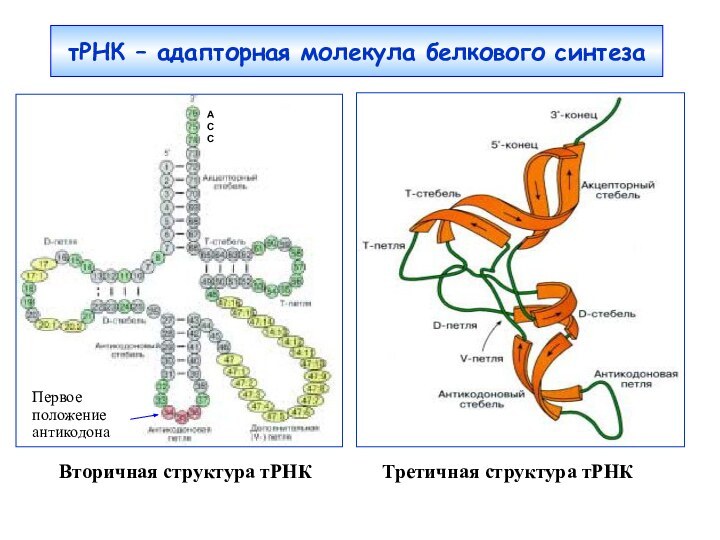
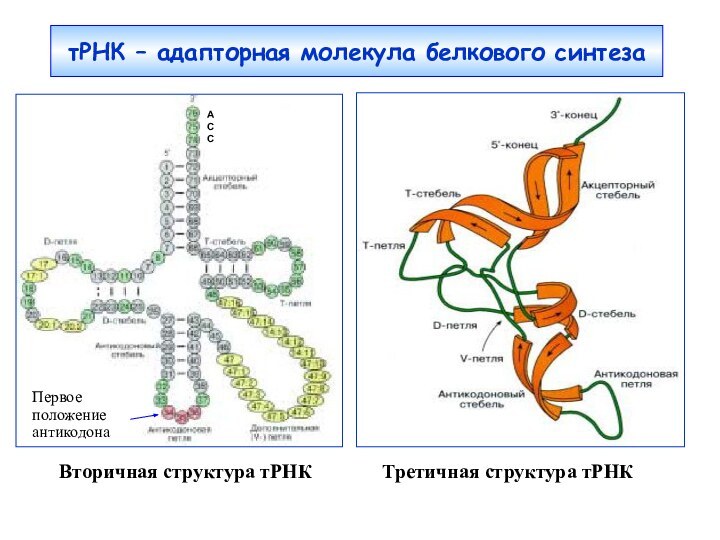
тРНК – адапторная молекула белкового синтеза
Вторичная структура тРНК
Третичная структура тРНКA
C
C
Первое положение антикодона
Слайд 5
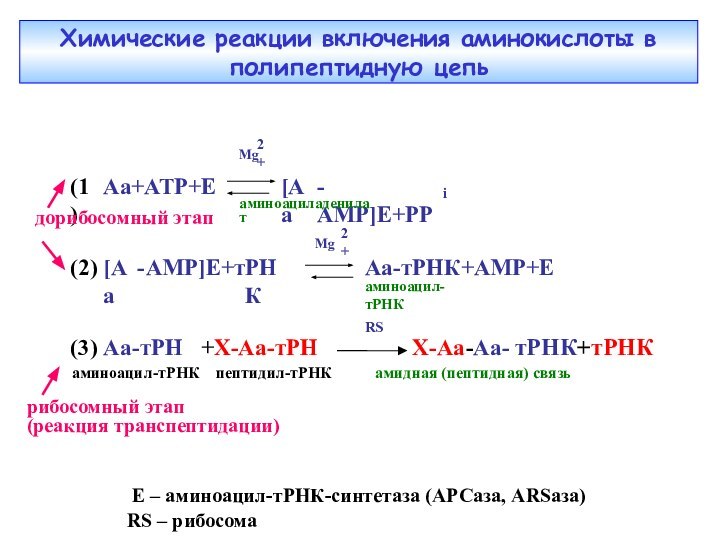
Химические реакции включения аминокислоты в полипептидную цепь
рибосомный этап
(реакция
транспептидации)
Слайд 6
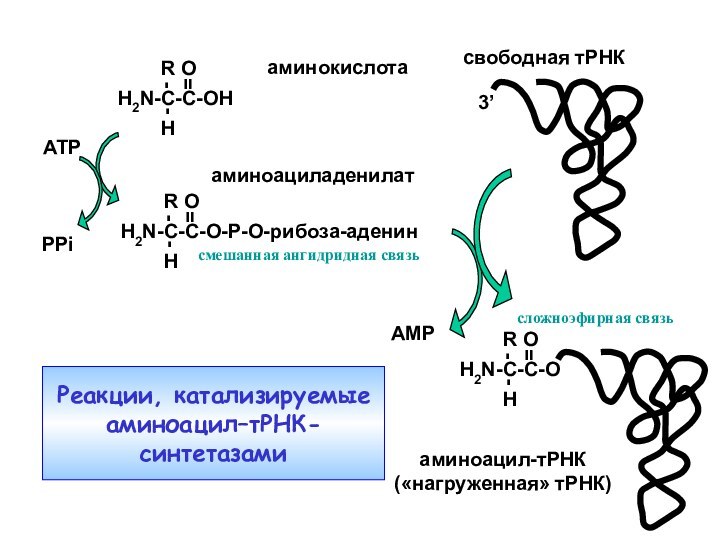
ATP
аминокислота
аминоациладенилат
PPi
свободная тРНК
аминоацил-тРНК
(«нагруженная» тРНК)
AMP
3’
Amino acid activation
and
tRNA charging
Реакции, катализируемые
аминоацил–тРНК-синтетазами
смешанная ангидридная
связь
сложноэфирная связь
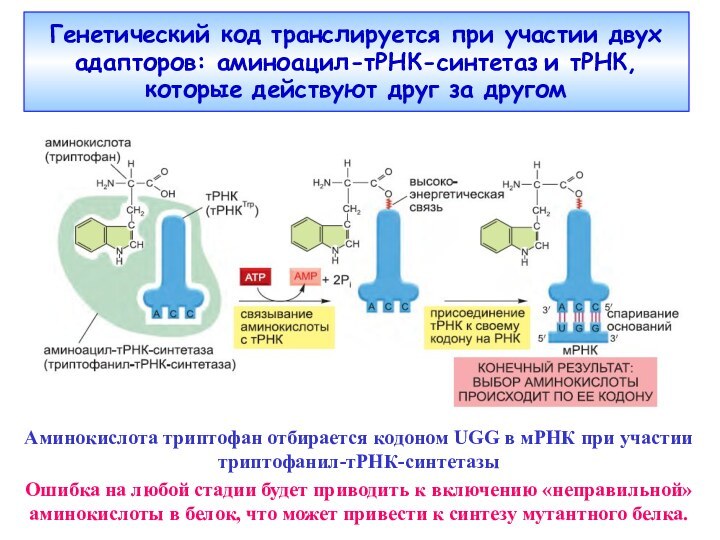
Слайд 7 Генетический код транслируется при участии двух адапторов: аминоацил-тРНК-синтетаз
и тРНК, которые действуют друг за другом
Аминокислота триптофан отбирается
кодоном UGG в мРНК при участии триптофанил-тРНК-синтетазыОшибка на любой стадии будет приводить к включению «неправильной» аминокислоты в белок, что может привести к синтезу мутантного белка.
Слайд 8
Аминоацил-тРНК-синтетазы катализируют активацию аминокислот и аминоацилирование тРНК:
в
большинстве клеток для каждой из 20 аминокислот имеется по
одной АРСазе (есть исключения – две изоформы LysRSазы у E.coli; некоторые прокариоты имеют меньше 20 ARSаз, модификация аминокислот происходит после их присоединения к тРНК););одна и та же АРСаза аминоацилирует все изоакцепторные тРНК для данной аминокислоты;
активация аминокислот и аминоацилирование тРНК протекают сопряженно: АРСазы образуют промежуточные аминоациладенилат-ферментные комплексы;
АРСазы - обычно функциональные димеры (даже если структурные мономеры).
Дорибосомный этап белкового синтеза
Слайд 9
Два класса аминоацил-тРНК-синтетаз
Активируемые
аминокислоты
Arg
Leu
Cys
Met
Gln
Trp
Glu
Tyr
Ile
Val
Ala
Lys
Asn
Phe
Asp
Pro
Gly
Ser
His
Thr
Класс
I
Класс
II
Позиционная
специфичность
аминоацилирования
2’
-
OH
рибозы
концевого А
тРНК
3’
-
OH
рибозы
концевого А
тРНК
Характерные His-Ile-Gly-His Три мотива с характерным
аминокислотные Lys-Met-Ser-Lys-Ser чередованием гидрофильных мотивы АРСаз и гидрофобных АК
СЕ структура в основном мономеры обязательно олигомеры
в основном с объемным в основном с небольшими гидрофобным радикалом нейтральными остатками
исключение
Слайд 10
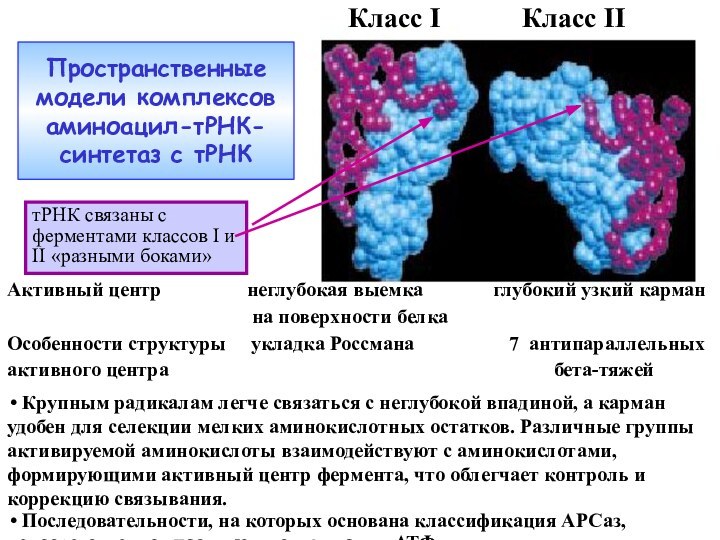
Пространственные
модели комплексов
аминоацил-тРНК-синтетаз с тРНК
Класс I
Класс II
Активный центр
неглубокая выемка
глубокий узкий карманна поверхности белка
Особенности структуры укладка Россмана 7 антипараллельных
активного центра бета-тяжей
Крупным радикалам легче связаться с неглубокой впадиной, а карман удобен для селекции мелких аминокислотных остатков. Различные группы активируемой аминокислоты взаимодействуют с аминокислотами, формирующими активный центр фермента, что облегчает контроль и коррекцию связывания.
Последовательности, на которых основана классификация АРСаз, непосредственно участвуют в связывании АТФ.
тРНК связаны с ферментами классов I и II «разными боками»
Слайд 11
тРНК – адапторная молекула белкового синтеза
Вторичная структура тРНК
Третичная структура тРНКA
C
C
Первое положение антикодона
Слайд 12
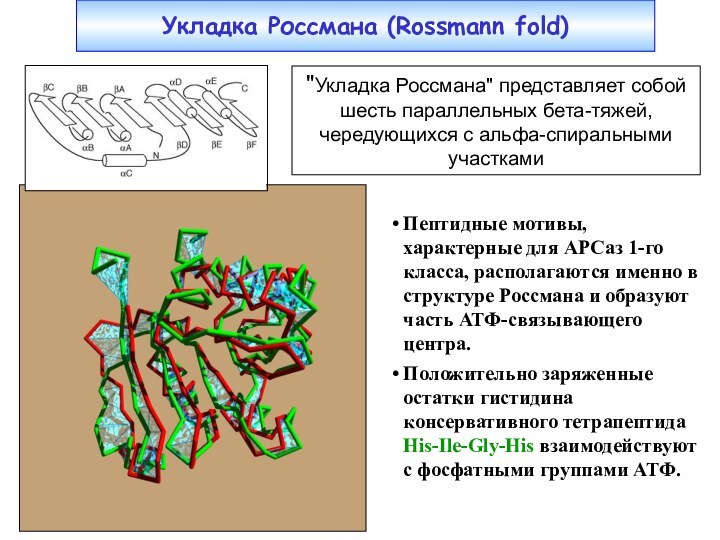
Укладка Россмана (Rossmann fold)
Пептидные мотивы, характерные для АРСаз
1-го класса, располагаются именно в структуре Россмана и образуют
часть АТФ-связывающего центра.Положительно заряженные остатки гистидина консервативного тетрапептида His-Ile-Gly-His взаимодействуют с фосфатными группами АТФ.
"Укладка Россмана" представляет собой шесть параллельных бета-тяжей, чередующихся с aльфа-спиральными участками
Слайд 13 1. Два типа возможных ошибок аминоацил-тРНК-синтетазы (отбор «неправильной»
аминокислоты и «неправильной» тРНК) приводят к одинаковому ошибочному результату:
Ех
+ Y + тРНКх ↔ Ех + Y-тРНКхЕх + Х + тРНКy ↔ Ех + Х-тРНКу
2. При отборе аминокислот в реакции аминоацилирования тРНК происходит каскадное усиление специфичности аминоацил-тРНК-синтетаз:
Отбор за счет различий в энергии взаимодействия боковых радикалов аминокислот с аминокислотами активного центра АРСаз, т.е. правильная аминокислота имеет наиболее высокое сродство к «карману» активного участка своей АРСазы;
Два последовательных дополнительных механизма коррекции: гидро-лиз «ошибочных» аминоациладенилатов и «ошибочных» аминоацил-тРНК.
3. Существуют также специальные механизмы контроля образующихся продуктов, например:
Фермент D-тирозилгидролаза (специфический гидролиз D-тирозил-тРНКTyr);
Селективные системы деградации аномальных белков.
«Сверхспецифичность» аминоацил-тРНК-синтетаз
Слайд 14
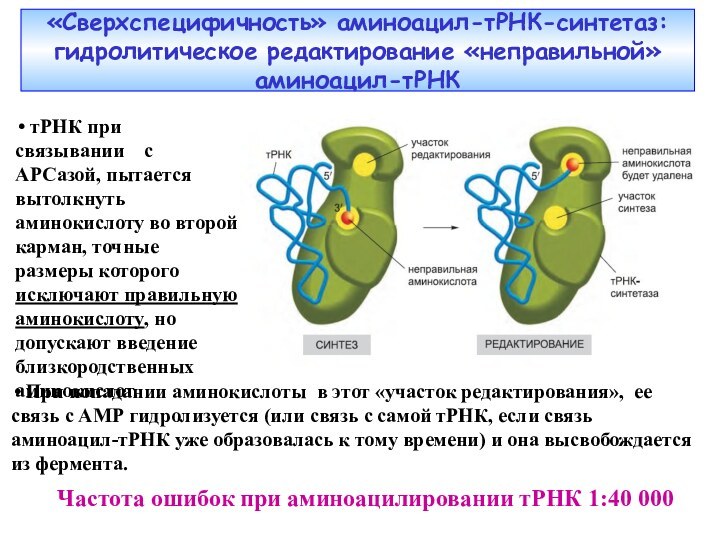
«Сверхспецифичность» аминоацил-тРНК-синтетаз: гидролитическое редактирование «неправильной» аминоацил-тРНК
Частота ошибок
при аминоацилировании тРНК 1:40 000
тРНК при связывании
с АРСазой, пытается вытолкнуть аминокислоту во второй карман, точные размеры которого исключают правильную аминокислоту, но допускают введение близкородственных аминокислот. При попадании аминокислоты в этот «участок редактирования», ее связь с АМР гидролизуется (или связь с самой тРНК, если связь аминоацил-тРНК уже образовалась к тому времени) и она высвобождается из фермента.
Слайд 15
Элементы, определяющие «индивидуальность» (identity) тРНК, или элементы распознавания:
черты, воспринимаемые своей АРСазой, как «притягательные», а остальными 19-ю
АРСазами, как «отталкивающие».Отбор «правильных» тРНК
Двойственные требования к структуре тРНК:
для универсальной адапторной функции необходимы сходные элементы структуры (L-форма);
для узнавания 20-ю специфическими аминоацил-тРНК-синтетазами и специфического аминоацилирования (акцепторные функции) необходимы уникальные элементы распознавания.
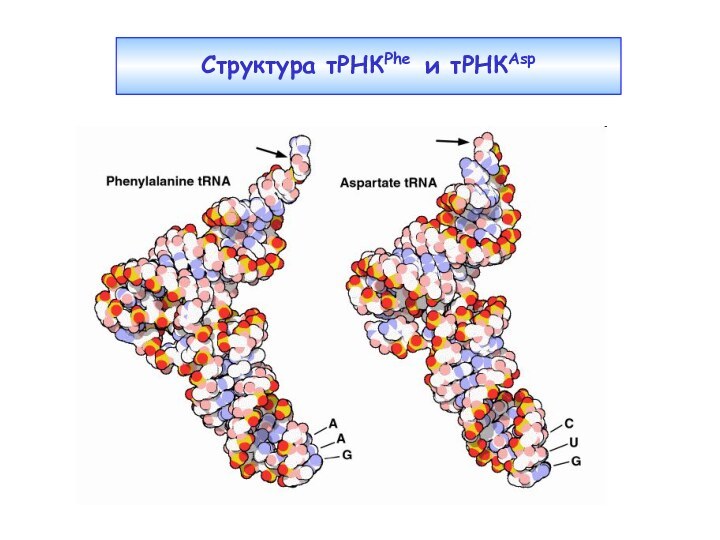
Слайд 17
Отдельные элементы распознавания в тРНК
антикодон (например, в
тРНКMet, тРНКTrp); но не в случае, если аминокислота имеет
6 кодонов;нуклеотид-«дискриминатор» в положении 73 (А – для гидрофобных АК, G – для полярных АК) – есть у всех тРНК;
первые три пары нуклеотидов акцепторного стебля (от одной до трех): 1-72, 2-71, 3-70;
в некоторых случаях неконсервативные нуклеотиды D- и T-петель.
Модифицированные нуклеотиды - антидетерминанты аминоацилирования, препятствующие взаимодействию тРНК с чужой аминоацил-тРНК-синтетазой.
Слайд 18
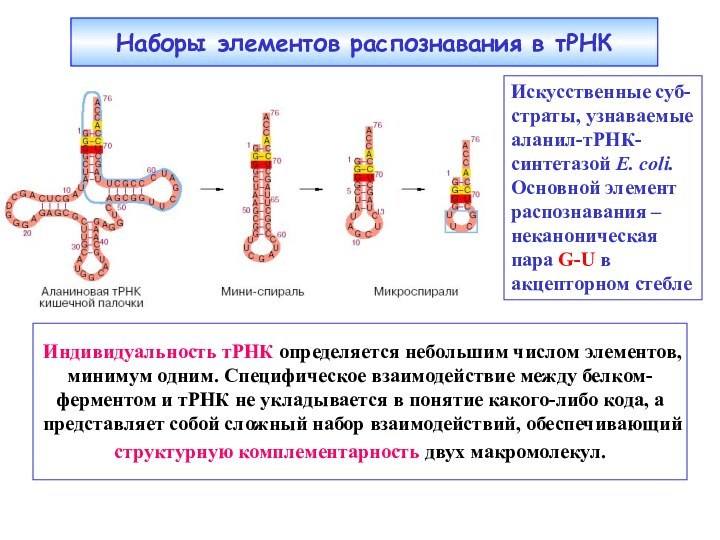
Наборы элементов распознавания в тРНК
Индивидуальность тРНК определяется небольшим
числом элементов, минимум одним. Специфическое взаимодействие между белком-ферментом и
тРНК не укладывается в понятие какого-либо кода, а представляет собой сложный набор взаимодействий, обеспечивающий структурную комплементарность двух макромолекул.Искусственные суб-
страты, узнаваемые
аланил-тРНК-
синтетазой E. coli.
Основной элемент распознавания – неканоническая пара G-U в акцепторном стебле
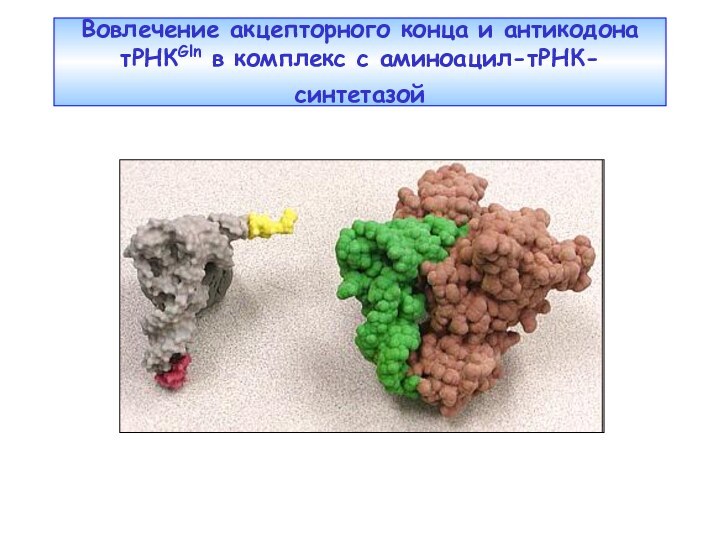
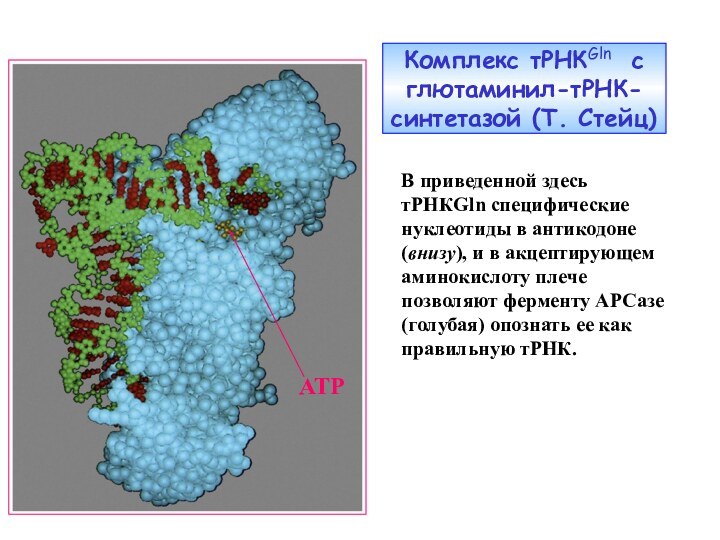
Слайд 20
Комплекс тРНКGln с глютаминил-тРНК-синтетазой (Т. Стейц)
АТР
В приведенной здесь
тРНКGln
специфические нуклеотиды в антикодоне (внизу), и в акцептирующем аминокислоту
плече позволяют ферменту АРСазе (голубая) опознать ее как правильную тРНК.Слайд 21 РИБОСОМА - крупный внутриклеточный макромолекулярный ансамбль, ответственный
за синтез полипептидной цепи из аминокислот; это рибонуклеопротеид, построенный
из двух субчастиц
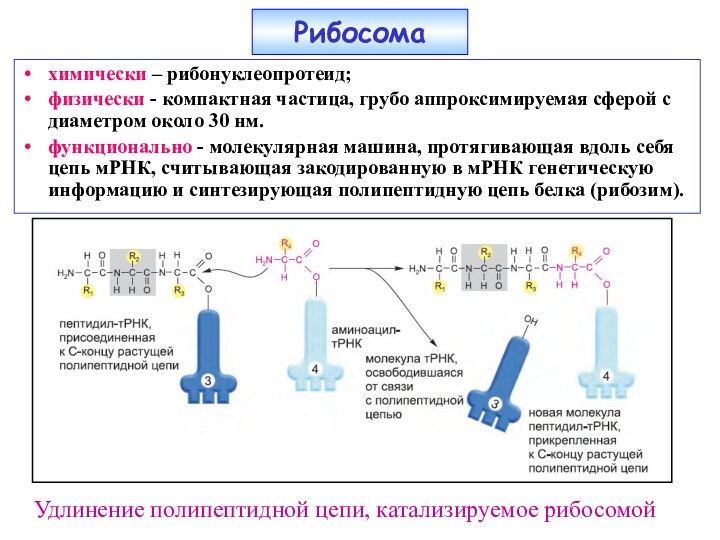
Слайд 22
химически – рибонуклеопротеид;
физически - компактная частица, грубо аппроксимируемая
сферой с диаметром около 30 нм.
функционально - молекулярная
машина, протягивающая вдоль себя цепь мРНК, считывающая закодированную в мРНК генетическую информацию и синтезирующая полипептидную цепь белка (рибозим).Рибосома
Удлинение полипептидной цепи, катализируемое рибосомой
Слайд 23
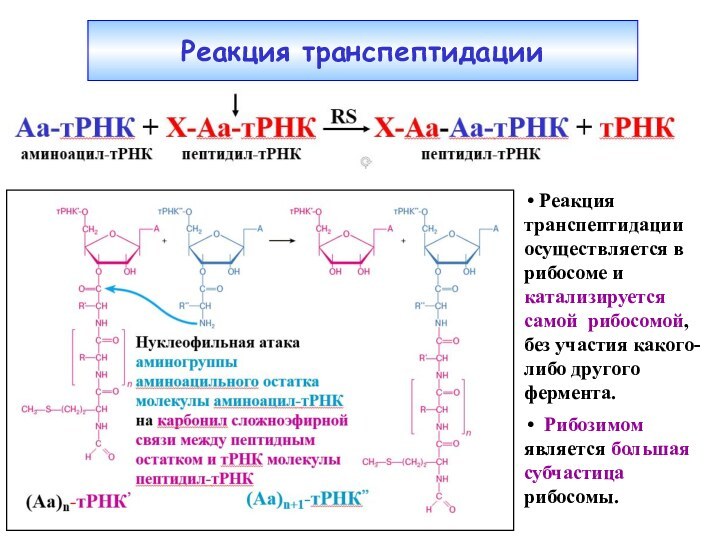
Реакция транспептидации
Реакция транспептидации осуществляется в рибосоме и
катализируется самой рибосомой, без участия какого-либо другого фермента.
Рибозимом является большая субчастица рибосомы.
Слайд 24
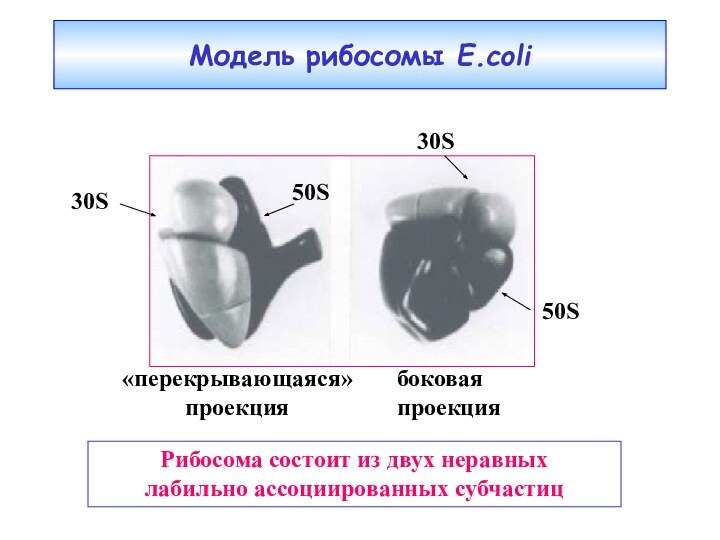
Модель рибосомы E.coli
«перекрывающаяся»
проекция
боковая
проекция
30S
50S
Рибосома состоит из двух неравных
лабильно ассоциированных субчастиц
30S
50S
Слайд 25
Каждая рибосомная
субчастица содержит
одну молекулу
компактно свернутой высокополимерной
рибосомной РНК,
которая служит
структурным ядром субчастицы.
Рибосомные субчастицы и
рибосомные РНК E. coli
Слайд 26
Сравнение прокариотической и эукариотической рибосом
S20=L26
L7=ацетил.S12
РНК : белок (%)
66
: 34
50 : 50Дополнительные нуклеотиды эу-рРНК образуют множественные вставки, формирующие доп. домены, и не затрагивают основной структуры обеих рРНК
Слайд 27
Рибосомные белки
Разделение индивидуальных белков
бактериальной (E. coli)
70S-рибосомы путём
дву-мерного электрофореза в полиакриламидном геле.
Каждый рибосомный белок имеет свою
«персональную" посадочнуюплощадку на рибосомной РНК.
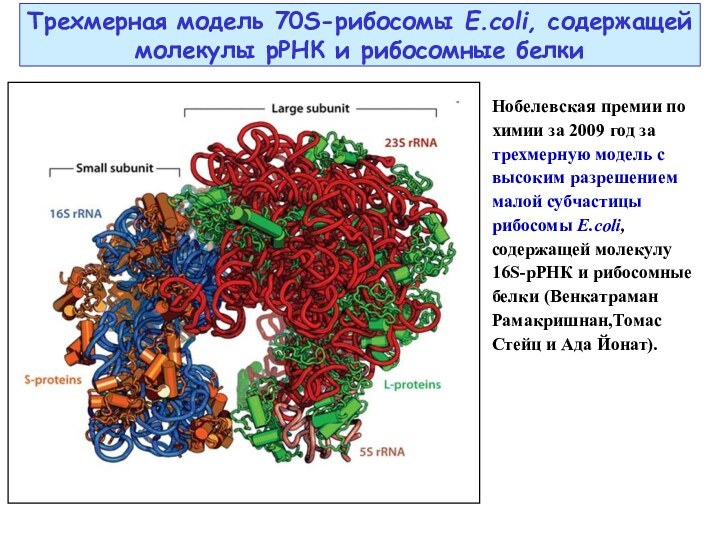
Слайд 28 Трехмерная модель 70S-рибосомы E.coli, содержащей молекулы рРНК и
рибосомные белки
Нобелевская премии по химии за 2009 год за
трехмерную модель с высоким разрешением малой субчастицы рибосомы E.coli, содержащей молекулу 16S-рРНК и рибосомные белки (Венкатраман Рамакришнан,Томас Стейц и Ада Йонат).
Слайд 30
Определяющая роль рРНК в рибосоме
Полость между
субчастицами – главный функциональный карман рибосомы.
рРНК
определяют:форму и морфологические особенности субчастиц;
ассоциацию субчастиц;
связывание рибосомных белков;
организацию функциональных центров рибосом;
собственно катализ.
Слайд 31
Участки связывания тРНК в рибосоме
Рибосома содержит
четыре участка связывания молекул РНК: один предназначен для мРНК,
а три (названные A-сайтом, P-сайтом и E-сайтом) — для молекул тРНК .Малая субчастица в составе полной транслирующей рибосомы имеет два кодон-зависимых тРНК-связывающих участка:
аминоацил-тРНК-связывающий участок (А-сайт) и пептидил-тРНК-связывающий участок (Р-сайт).
Большая субчастица в составе полной транслирующей рибосомы имеет кодон-независимый тРНК-связывающий участок, специфичный для деацилированной тРНК (Е-сайт, от exit).
Слайд 32
Три участка связывания тРНК в рибосоме
В процессе белкового
синтеза одновременно заняты только 2 участка
(Р и А
или Р и Е)..
Слайд 33
Положение мРНК в малой рибосомной субчастице
Ориентация малой субчастицы
та же, что и на предыдущем слайде (В).
Слайд 34
Разделение декодирующей и энзиматической функций между субчастицами
Рибосома выполняет
одновременно три функции:
Генетическую, или декодирующую – расшифровывает генетическую информацию
ДНК, поступающую в виде мРНК (принадлежит малой субчастице); механическую – передвигает цепь мРНК (потриплетно) и молекулы тРНК (функцию «молекулярной машины» выполняет малая субчастица);
энзиматическую – катализирует реакцию транспептидации (функция рибозима принадлежит большой субчастице).
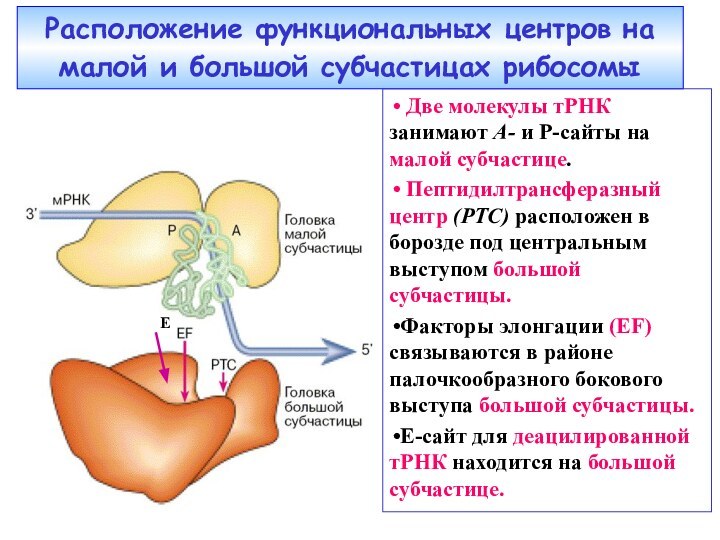
Слайд 35 Расположение функциональных центров на малой и большой субчастицах
рибосомы
Две молекулы тРНК занимают А- и Р-сайты
на малой субчастице.Пептидилтрансферазный центр (РТС) расположен в борозде под центральным выступом большой субчастицы.
Факторы элонгации (EF) связываются в районе палочкообразного бокового выступа большой субчастицы.
Е-сайт для деацилированной тРНК находится на большой субчастице.
Е
Слайд 36
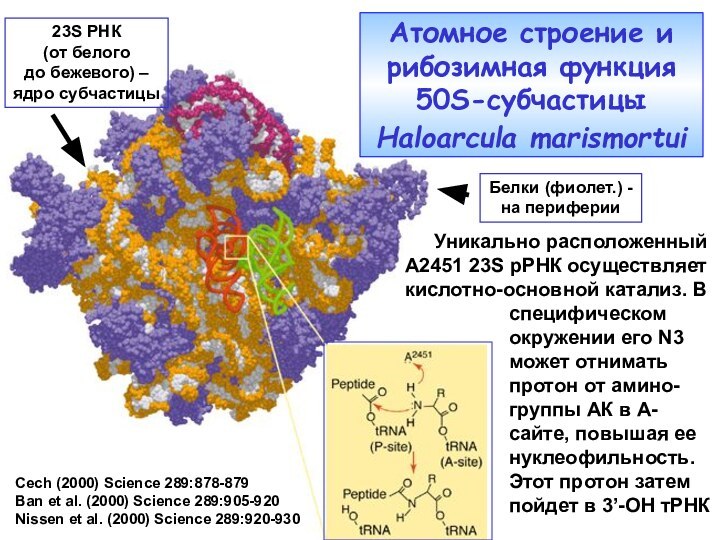
Cech (2000) Science 289:878-879
Ban et al. (2000) Science
289:905-920
Nissen et al. (2000) Science 289:920-930
Белки (фиолет.) -
на периферии
23S
РНК (от белого
до бежевого) –
ядро субчастицы
Уникально расположенный
А2451 23S рРНК осуществляет
кислотно-основной катализ. В
Атомное строение и рибозимная функция 50S-субчастицы Haloarcula marismortui
специфическом окружении его N3 может отнимать протон от амино-группы АК в А-сайте, повышая ее нуклеофильность. Этот протон затем пойдет в 3’-OH тРНК
Слайд 37
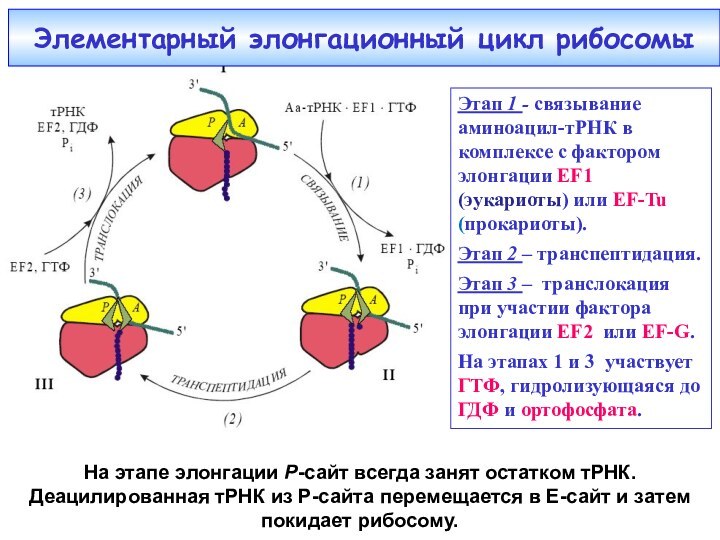
Этап 1 - связывание аминоацил-тРНК в комплексе с
фактором элонгации EF1 (эукариоты) или EF-Tu (прокариоты).
Этап 2 –
транспептидация.Этап 3 – транслокация при участии фактора элонгации EF2 или EF-G.
На этапах 1 и 3 участвует ГТФ, гидролизующаяся до ГДФ и ортофосфата.
Элементарный элонгационный цикл рибосомы
На этапе элонгации Р-сайт всегда занят остатком тРНК. Деацилированная тРНК из P-сайта перемещается в Е-сайт и затем покидает рибосому.
Слайд 38
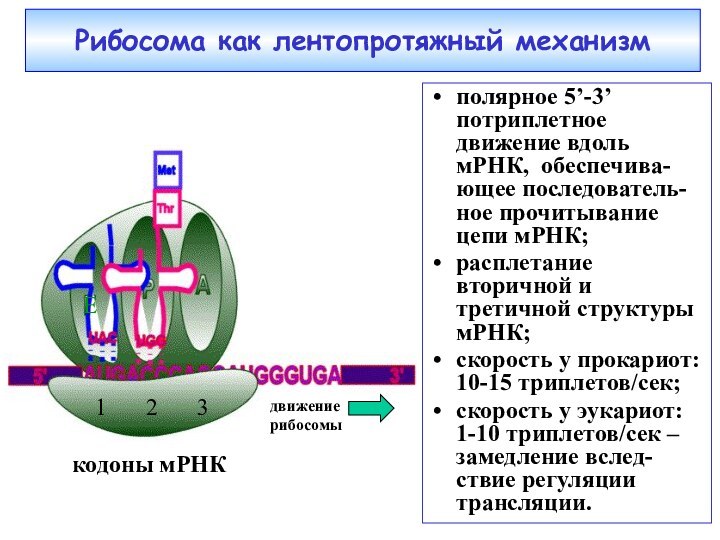
кодоны мРНК
1
3
2
движение рибосомы
Рибосома как лентопротяжный механизм
полярное 5’-3’ потриплетное
движение вдоль мРНК, обеспечива-ющее последователь-ное прочитывание цепи мРНК;
расплетание вторичной
и третичной структуры мРНК;скорость у прокариот: 10-15 триплетов/сек;
скорость у эукариот: 1-10 триплетов/сек – замедление вслед-ствие регуляции трансляции.
Е
Слайд 39
Конформационная подвижность рибосомы
Взаимная подвижность двух рибосомных субчастиц;
подвижность
“головки” малой рибосомной субчастицы относительно ее “тела”;
подвижность палочкообразного
бокового выступа большой субчастицы.Механическая подвижность рибосомы может обеспечивать преодоление энергетических барьеров:
при работе как “лентопротяжного механизма”;
при перенесении молекулы тРНК, связанной по нескольким точкам, из одного участка в другой в каждом элонгационном цикле.
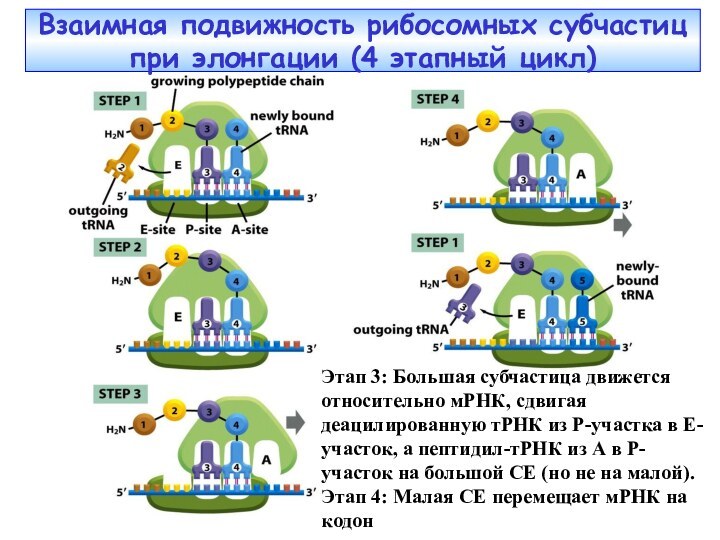
Слайд 40 Взаимная подвижность рибосомных субчастиц при элонгации (4 этапный
цикл)
Этап 3: Большая субчастица движется относительно мРНК, сдвигая деацилированную
тРНК из P-участка в Е-участок, а пептидил-тРНК из А в Р-участок на большой СЕ (но не на малой).Этап 4: Малая СЕ перемещает мРНК на кодон
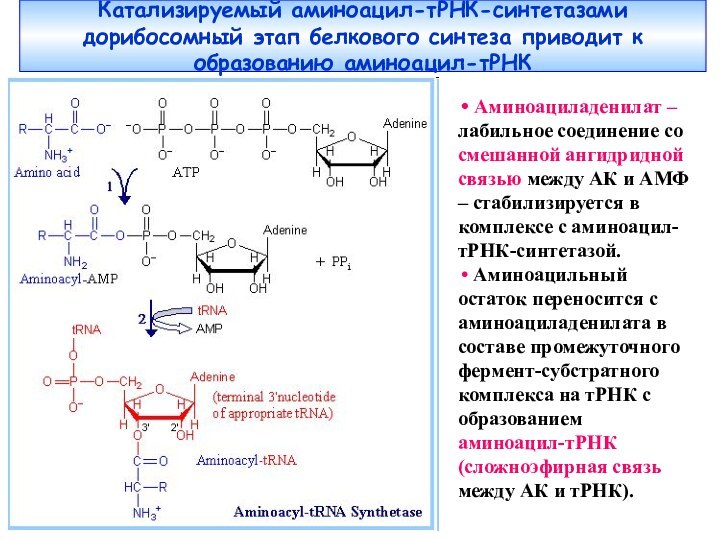
Слайд 42 Катализируемый аминоацил-тРНК-синтетазами дорибосомный этап белкового синтеза приводит к
образованию аминоацил-тРНК
Аминоациладенилат – лабильное соединение со смешанной ангидридной
связью между АК и АМФ – стабилизируется в комплексе с аминоацил-тРНК-синтетазой. Аминоацильный остаток переносится с аминоациладенилата в составе промежуточного фермент-субстратного комплекса на тРНК с образованием аминоацил-тРНК (сложноэфирная связь между АК и тРНК).
Слайд 45
Трехмерная модель с высоким разрешением малой субчастицы рибосомы
E.coli, содержащей молекулу 16S-рРНК и рибосомные белки (В. Рамакришнан)
рРНК - бирюзовый, зеленый и желтый;
Белки – красный и оранжевый
В. Рамакришнан (Кембридж),
Р. Стейц (Йель),
А. Йонат (Вайсмановский институт) - Нобелевская премия 2009 г