- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химиотерапия и антибиотики. Бактериофаги. (Занятие 9)
Содержание
- 2. Микробный антагонизм (от греч. antagonizomai — борюсь,
- 3. Бактериоцины — специфические белки, вырабатываемые некоторыми бактериями и
- 4. Бактериоциногенотипирование - метод использует различия в типах
- 5. Выявление антагонистического действия разных типов бактерийШтрихом
- 6. Хеморецептор — рецептор, чувствительный к воздействию
- 9. ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ АНТИБИОТИКОВ:для этиотропной терапии и профилактики
- 10. 1. Высокая избирательность антимикробного действия
- 11. Причины ошибок и неудач в антибиотикотерапии антибиотики
- 12. ОСЛОЖНЕНИЯ И ПОБОЧНЫЕ ДЕЙСТВИЯ АНТИБИОТИКОВ:На макроорганизм:- аллергические
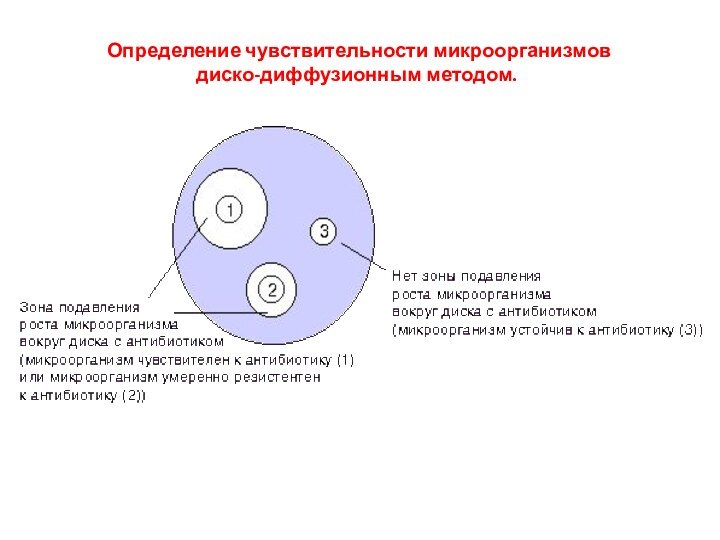
- 13. Определение чувствительности микроорганизмов диско-диффузионным методом.
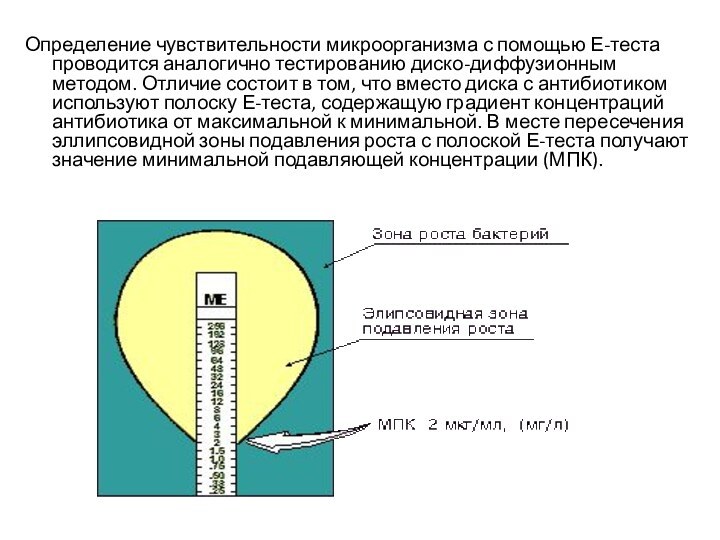
- 14. Определение чувствительности микроорганизма с помощью Е-теста проводится
- 15. Методы разведения основаны на использовании двойных последовательных разведений
- 16. ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ БАКТЕРИЙ К АНТИБИОТИКАМ.А. Метод стандартных
- 17. ЛЕКАРСТВЕННАЯ УСТОЙЧИВОСТЬ. Причины лекарственной
- 18. Механизмы приобретенной устойчивости антибиотикам:
- 19. Пути преодоления антибиотикорезистентности:систематическое получение новых антибиотиков;периодическая
- 20. Бета-лактамазы (β-лактамазы) — группа бактериальных ферментов, направленных на борьбу
- 21. Классификация и морфология бактериофагов.Бактериофаги – это вирусы
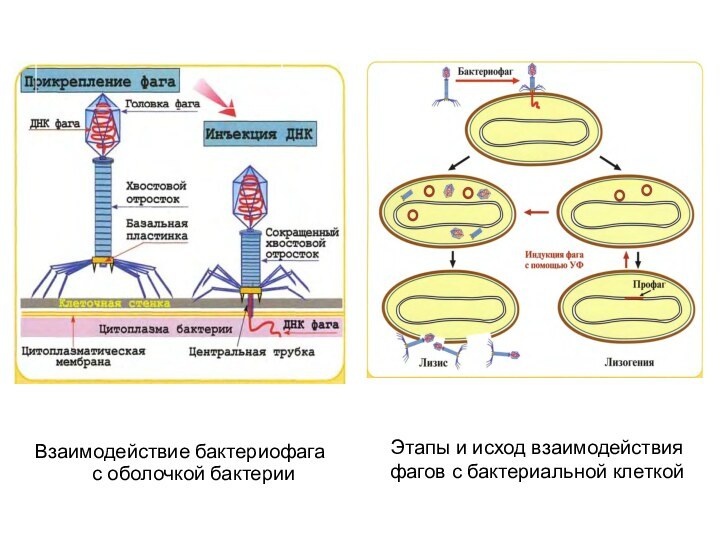
- 22. Этапы и исход взаимодействия фагов с бактериальной клеткойВзаимодействие бактериофага с оболочкой бактерии
- 23. Умеренные бактериофаги – это фаги, нуклеиновая кислота
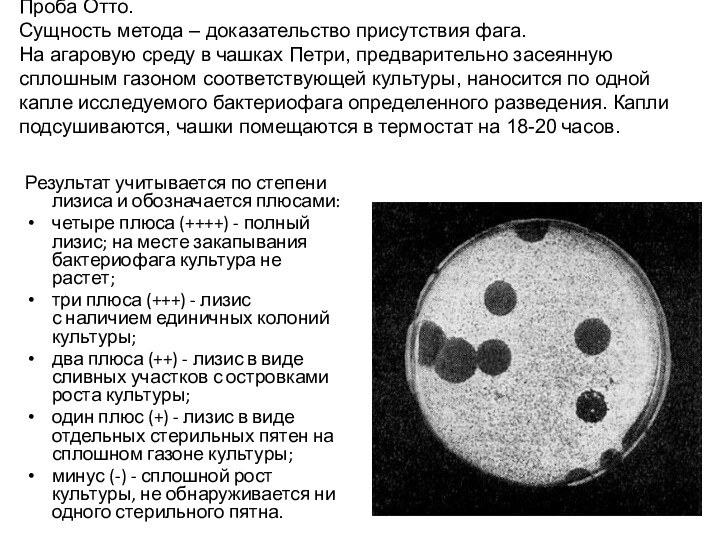
- 24. Проба Отто. Сущность метода – доказательство
- 25. Проба Фюрта:определение чувствительности микроорганизмов к известному или
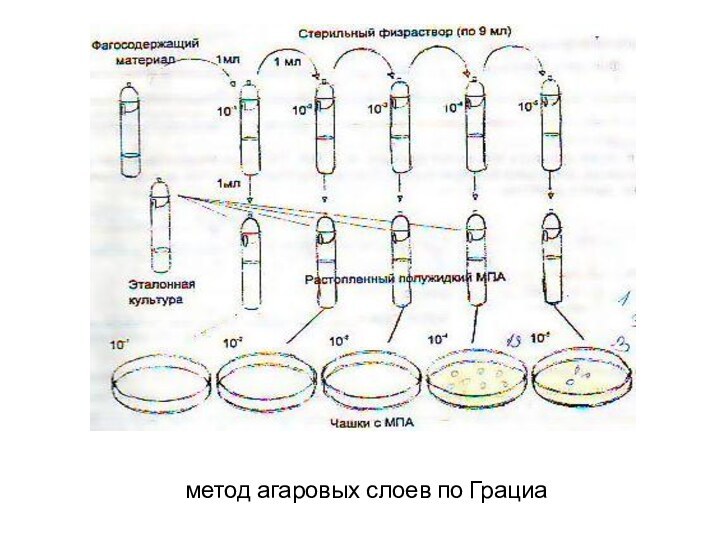
- 26. метод агаровых слоев по Грациа
- 27. Двухслойный метод Грациа – на питательный агар
- 28. Практическое применение бактериофагов:Фагодиагностика (фагоиндикация) – выделение бактериофагов
- 29. Скачать презентацию
- 30. Похожие презентации
























Слайд 2 Микробный антагонизм (от греч. antagonizomai — борюсь, соперничаю)
– угнетение одним видом микробов развития других.
разных видов микроорганизмов за кислород, питательные вещества и место существования. Бактерии, грибы, высшие растения производят вещества под названием антибиотики , которые пагубно действуют на другие микроорганизмыСлайд 3 Бактериоцины — специфические белки, вырабатываемые некоторыми бактериями и подавляющие
жизнедеятельность клеток других штаммов того же вида или родственных
видов бактерий.Бактериоцины обозначаются в соответствии с видовым названием, например «Escherichia coli» образует так называемые колицины, Pasteurella pestis — пестицины. Механизм действия бактериоцинов связан с повреждением цитоплазматических мембран белком.
Спектр активности бактериоцинов в отличие от антибиотиков узок и определяется наличием рецепторов у бактерий для их адсорбции.
Бактериоцинотипирование - метод внутривидовой дифференциации бактерий, базирующиеся на феномене бактериоциногении. Основан на различной чувствительности бактерий к набору типовых бактериоцинов.
Слайд 4 Бактериоциногенотипирование - метод использует различия в типах продуцируемых
бактериями бактериоцинов.
Этот метод типирования применяют реже, т.к. бактериоциногенными
является лишь часть популяции бактерий того или иного вида.
Слайд 5
Выявление антагонистического действия
разных типов бактерий
Штрихом по диаметру
чашки с МПА засевают культуру молочнокислых бактерий.
Перпендикулярно штрихами засевают
тест-культуры (E.coli, различные штаммы). После инкубации учитывают наличие и степень антагонистического действия по размеру зон задержки роста.Слайд 6 Хеморецептор — рецептор, чувствительный к воздействию химических
веществ. Представляет собой белковый комплекс, расположенный на наружной поверхности
клеточной мембраны, который, взаимодействуя с определенным веществом (химическим раздражителем), изменяет свои свойства, что вызывает каскад внутренних реакций микроорганизма.Антибиотик — вещество микробного, животного или растительного происхождения, способное подавлять рост определенных микроорганизмов или вызывать их гибель.
Химиотерапевтический индекс:
Для характеристики качества химиопрепаратов П. Эрлих ввел термин – химиотерапевтический индекс (ХТИ):
При ХТИ меньше единицы, препарат может быть использован для лечения соответствующей инфекции. Чем меньше индекс, тем больше разница между переносимой и лечебной дозой – тем препарат эффективней.
Слайд 9
ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ АНТИБИОТИКОВ:
для этиотропной терапии и профилактики (реже)
бактериальных, грибковых, протозойных инфекций и некоторых опухолей;
антибиотики входят в
состав ряда элективных и накопительных питательных сред;в научных исследованиях как специфические ингибиторы определенных путей метаболизма.
Применение антибиотиков в пищевой промышленности и сельском хозяйстве: используются при консервировании пищевых продуктов и в виде добавок в корм крупного рогатого скота, свиней, птиц;
Слайд 10
1. Высокая избирательность антимикробного действия и
нетоксичность для макроорганизма.
2. Отсутствие или медленное развитие резистентности возбудителей
к антибиотику в процессе его применения.
3. Хорошее всасывание, распределение, выведение из макроорганизма антибиотика в количествах, обеспечивающих терапевтические концентрации в критических органах и тканях, в первую очередь – в крови.
4. Удобная лекарственная форма для различных возрастных групп и локализации процесса, обеспечение максимального эффекта антибиотикотерапии.
Применение рациональной антибиотикотерапии
Слайд 11
Причины ошибок и неудач в антибиотикотерапии
антибиотики назначаются без
обоснованных показаний;
антибиотики назначаются без учета антибиотикорезистентности микробной флоры;
антибиотики назначаются
либо малыми, либо чрезмерно высокими дозами, короткими или слишком продолжительными курсами лечения;используется нерациональная комбинация антибиотиков при лечении патологического процесса;
не учитываются противопоказания к применению антибиотиков.
Слайд 12
ОСЛОЖНЕНИЯ И ПОБОЧНЫЕ ДЕЙСТВИЯ АНТИБИОТИКОВ:
На макроорганизм:
- аллергические реакции
(зуд, покраснение, сыпь), для их предупреждения проводят кожные и
сублингвальные пробы;- токсическое действие:
- прямое органотоксическое: стрептомицин обладает ото- и нефротоксическим действием, тетрациклин – гепатотоксическим действием;
- опосредованное: левомицетин подавляет синтез белка в клетках костного мозга;
- иммунодепрессивное действие: нарушение формирования иммунитета, снижение антителообразования и т.д.;
- тератогенное действие: на ткани эмбриона (тетрациклин – уродство плода и т.д.);
- феномен Герца-Геймера (реакция обострения) – интоксикация, вызванная эндотоксином, выделяющимся при массовой гибели грамотрицательных бактерий, особенно у детей с несовершенными механизмами детоксикации;
- дисбактериоз.
На микроорганизм:
- формирование антибиотикорезистентных штаммов микроорганизмов;
- формирование антибиотикозависимых бактерий.
Слайд 14
Определение чувствительности микроорганизма с помощью Е-теста проводится аналогично
тестированию диско-диффузионным методом. Отличие состоит в том, что вместо
диска с антибиотиком используют полоску Е-теста, содержащую градиент концентраций антибиотика от максимальной к минимальной. В месте пересечения эллипсовидной зоны подавления роста с полоской Е-теста получают значение минимальной подавляющей концентрации (МПК).Слайд 15 Методы разведения основаны на использовании двойных последовательных разведений концентраций
антибиотика от максимальной к минимальной (например от 128 мкг/мл, 64 мкг/мл,
и т.д. до 0,5 мкг/мл, 0,25 мкг/мл и 0,125 мкг/мл). При этом антибиотик в различных концентрациях вносят в жидкую питательную среду (бульон) или в агар. Затем бактериальную суспензию определенной плотности, соответствующую стандарту мутности 0,5 по MсFarland, помещают в бульон с антибиотиком или на поверхность агара в чашке. После инкубации в течение ночи при температуре 35о-37оС проводят учет полученных результатов. Наличие роста микроорганизма в бульоне (помутнение бульона) или на поверхности агара свидетельствует о том, что данная концентрация антибиотика недостаточна, чтобы подавить его жизнеспособность. По мере увеличения концентрации антибиотика рост микроорганизма ухудшается. Первую наименьшую концентрацию антибиотика (из серии последовательных разведений), где визуально не определяется бактериальный рост принято считать минимальной подавляющей концентрацией (МПК). Измеряется МПК в мг/л или мкг/мл.Минимальная подавляющая концентрация (МПК) - наименьшая концентрация антибиотика (мг/л или мкг/мл), которая in vitro полностью подавляет видимый рост бактерий
Слайд 16
ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ БАКТЕРИЙ К АНТИБИОТИКАМ.
А. Метод стандартных бумажных
дисков.
Величины зон задержки роста:
диаметр от 0 мм до 6
мм – устойчивые;диаметр от 7 до 15мм – слабочувствительные;
диаметр от 16 мм до 24 мм – чувствительные;
диаметр от 25 мм и более – высокочувствительные.
Метод дает только качественную характеристику, однако прост и доступен в исполнении.
Б. Метод серийных стандартных разведений – позволяет определять минимальную подавляющую (ингибирующую) концентрацию антибиотика.
В. Экспрессный рэдокс-метод – основан на улавливании изменения ОВП (окислительно-восстановительного потенциала) питательной среды микроорганизмами по изменению цвета индикатора, добавленного в питательную среду (подолжительность определения 3-5 часов).
Д. ПЦР – выявление у микроорганизма генов устойчивости.
Г. Е-тест – применяют бумажные полоски, пропитанные рядом убывающих концентраций определённого антибиотика (128, 64, 32, 16, 8... мкг/мл), после инкубирования вокруг полоски образуется эллипсовидная зона задержки роста.
ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ АНТИБИОТИКОВ В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ.
Для определения концентрации антибиотиков в моче, крови и других биологических жидкостях используют метод, основанный на способности антибиотиков диффундировать в агар, зараженный тест-микробом и подавлять рост последнего. Зона подавления роста тест-микроба зависит от концентрации антибиотика в изучаемом субстрате. Диаметры полученных зон сравнивают с величиной зон, образующихся при нанесении на агар известных количеств стандартного препарата (стандартами служат специально приготовленные очищенные образцы антибиотиков, активность которых установлена по международным стандартам).
Слайд 17
ЛЕКАРСТВЕННАЯ УСТОЙЧИВОСТЬ.
Причины лекарственной устойчивости:
массовое,
бесконтрольное применение антибиотиков;
неоправданное назначение антибиотиков;
назначение антибиотиков без определения чувствительности
к ним;миграция в микробных популяциях R-плазмид;
использование антибиотиков при производстве продуктов питания;
высокая адаптивность микробов к изменяющимся условиям среды обитания.
Виды антибиотикоустойчивости:
Первичная/естественная/видовая (характерна для всех представителей этого вида) – обусловлена отсутствием мишени для действия антибиотика. Например, у микоплазм к пенициллинам, вследствие отсутствия у них клеточной стенки (пептидогликана).
Приобретенная/штаммовая (характерна для отдельных представителей вида) — обусловлена изменением в процессе жизнедеятельности микроорганизма под действием факторов окружающей среды. Она реализуется за счет модификаций, мутаций и рекомбинаций (чаще всего при передаче r-генов с участием плазмид и транспозонов).
Слайд 18
Механизмы приобретенной устойчивости антибиотикам:
Генетические:
мутации в генетическом аппарате микробной клетки;
рекомбинации –
миграция генов лекарственной устойчивости (r-генов с плазмидами, транспозонами, бактериофагами).Биохимические:
инактивирование антибиотика ферментами микроорганизма, т.е. превращение активной формы антибиотика в неактивную – ацетилирование или фосфорилирование (аминогликозиды);
изменение мишени для антибиотика – нарушение синтеза компонентов клеточной стенки (синтез β-лактамаз пенициллинрезистентными штаммами S. aureus)
изменение проницаемости ЦПМ микроба для антибиотика (тетрациклины);
утрата проницаемости клеточной стенки для определенного антибиотика;
возникновение у микроорганизмов альтернативного пути образования жизненно важного метаболита, заменяющего основной путь, блокированный препаратом.
Слайд 19
Пути преодоления антибиотикорезистентности:
систематическое получение новых антибиотиков;
периодическая замена
широко применяемых антибиотиков новыми;
химическая модификация известных антибиотиков с защищенными
активными группами, устойчивыми к бактериальным ферментам;разработка ингибиторов, подавляющих активность бактериальных ферментов, а также препаратов, препятствующих адгезии бактерий на клетках макроорганизма;
использование препаратов, избирательно блокирующих репликацию R-плазмид;
мероприятия по ограничению распространения лекрственноустойчивых бактерий:
своевременная информация практических врачей о циркулирующих в данном регионе лекарственноустойчивых бактериях;
определение чувствительности выделенных бактерий к антибиотикам;
ограничение применения антибиотиков без достаточных показаний;
запрещение использования антибиотиков в качестве консервантов пищевых продуктов и кормовых добавок;
эпидемиологический надзор за заражением окружающей среды лекарственноустойчивыми бактериями;
выявление носителей лекарственноустойчивых бактерий;
соблюдение дозировок, интервалов введения;
одновременное назначение препаратов, различных по механизмам действия.
Слайд 20 Бета-лактамазы (β-лактамазы) — группа бактериальных ферментов, направленных на борьбу с
бета-лактамными антибиотиками (пенициллины, цефалоспорины и др.), наиболее широко используемым
классом веществ для антимикробной химиотерапии. Данные ферменты отвечают за образование более распространенной устойчивости бактерий к названным антибиотикам.Продуцентами бета-лактамаз, способных инактивировать бета-лактамные антибиотики, являются эшерихии, протеи, клебсиеллы, другие представители семейства Enterobacteriaceae, а также Pseudomonas aeruginosa, Acinetobacter spp., некоторые другие грамотрицательные палочки, т. е. возбудители таких тяжелых патологий, как сепсис, пневмония, перитонит, раневая инфекция, муковисцидоз.
Вторым путем развития резистентности является изменение структуры пенициллинсвязывающих белков, то есть тех белков, на которые нацелены бета-лактамные антибиотики.
Слайд 21
Классификация и морфология бактериофагов.
Бактериофаги – это вирусы бактерий.
Номенклатура бактериофагов основана на видовом наименовании
хозяина (стафилококковый, стрептококковый, сальмонеллезный, дизентерийный бактериофаги, коли-бактериофаг и т.п.).Классификация бактериофагов:
По типу нуклеиновой кислоты:
ДНК-содержащие;
РНК-содержащие.
По характеру взаимодействия с бактериями:
вирулентные;
умеренные (с полноценным/дефектным геномами).
По специфичности взаимодействия:
видовые (моновалентные) – лизируют бактерии одного вида;
поливалентные – лизируют бактерии разных видов;
типовые (Т-фаги) – лизируют бактерий разных типов/вариантов (делят бактерии в пределах вида на фаговары).
По морфологии:
однонитевые РНК/ДНК-содержащие с аналогом отростка;
двунитевые ДНК-содержащие: наиболее сложными по строению являются бактериофаги кишечной палочки — так называемые фаги Т, среди которых детально изучены фаги с четными номерами Т-2, Т-4, Т-6 (Т-четные фаги), которые подразделяются на фаги с длинным отростком и сокращающимся чехлом или без отростков. Т-нечетные фаги подразделяются на фаги с с коротким отростком или с длинным отростком, но несокращающимся чехлом.
Слайд 22
Этапы и исход взаимодействия фагов с бактериальной клеткой
Взаимодействие
бактериофага с оболочкой бактерии
Слайд 23 Умеренные бактериофаги – это фаги, нуклеиновая кислота которых
после проникновения в бактериальную клетку интегрируется в геном хозяина
и реплицируется синхронно с ним – интегративный тип взаимодействия.Лизогения – процесс встраивания умеренного бактериофага в геном клетки-хозяина в виде профага.
Лизогенная (фаговая) конверсия – это приобретение бактериями новых свойств в результате внедрения в их геном ДНК умеренного бактериофага (например, у дифтерийной палочки синтез токсина детерминируется умеренным бактериофагом).
Слайд 24 Проба Отто. Сущность метода – доказательство присутствия фага.
На агаровую среду в чашках Петри, предварительно засеянную сплошным газоном
соответствующей культуры, наносится по одной капле исследуемого бактериофага определенного разведения. Капли подсушиваются, чашки помещаются в термостат на 18-20 часов.Результат учитывается по степени лизиса и обозначается плюсами:
четыре плюса (++++) - полный лизис; на месте закапывания бактериофага культура не растет;
три плюса (+++) - лизис с наличием единичных колоний культуры;
два плюса (++) - лизис в виде сливных участков с островками роста культуры;
один плюс (+) - лизис в виде отдельных стерильных пятен на сплошном газоне культуры;
минус (-) - сплошной рост культуры, не обнаруживается ни одного стерильного пятна.
Слайд 25
Проба Фюрта:
определение чувствительности микроорганизмов к известному или исследуемому
бактериофагу путем одновременного посева различных микроорганизмов в разные участки
плотной питательной среды, содержащей бактериофаг, с последующей оценкой степени лизиса бактериальных культур.Метод Фишера (метод фаговых дорожек):
отсутствие роста чувствительной культуры в месте стекания капли с исследуемым фагосодержащим материалом
Титр бактериофага предельное разведение взвеси бактериофага, способное вызвать лизис культуры чувствительных бактерий. Данную величину выражают отрицательной степенью числа 10, где степень указывает разведение фага. Средний титр бактериофага составляет 10-7.
Индекс бактериофага:
число активных единиц бактериофага, содержащихся в 1 мл фаголизата.
Слайд 27 Двухслойный метод Грациа – на питательный агар наносят
расплавленный агар с исследуемым материалом и чувствительной культурой. После
инкубации о присутствии фага судят по наличию прозрачных пятен на фоне глубинного роста бактерий
Слайд 28
Практическое применение бактериофагов:
Фагодиагностика (фагоиндикация) – выделение бактериофагов из
организма больного и объектов внешней среды (косвенно свидетельствует о
наличии в материале соответствующих бактерий).Фаготерапия – применение бактериофагов с целью лечения инфекционных заболеваний (например, пиобактериофаг, брюшнотифозный и холерный бактериофаги).
Фагопрофилактика – применения бактериофагов с целью предупреждения заболеваний в эпидемическом очаге (например, дизентерийный, сальмонеллезный и стафилококковый бактериофаги).
Фагоидентификация:
– фагодифференцировка - установление вида (идентификация) бактерий по их чувствительности к известному фагу;
- фаготипирование – установление типа - внутривидовое типирование бактерий по их чувствительности к типовым бактериофагам (важно для эпидемиологического анализа заболевания – установление источника и путей распространения заболевания).
Научные исследования.
Генная инженерия – использование бактериофагов в качестве векторов.