- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Молекулярная биология. Белки нервной системы
Содержание
- 2. Критерии специфичности белков нервной ткани: а) наличием их
- 3. Идентификация нейроспецифических белков может быть осуществлена различными
- 4. Неферментные Ca2+ -связывающие белкиОчень многие белки ЦНС
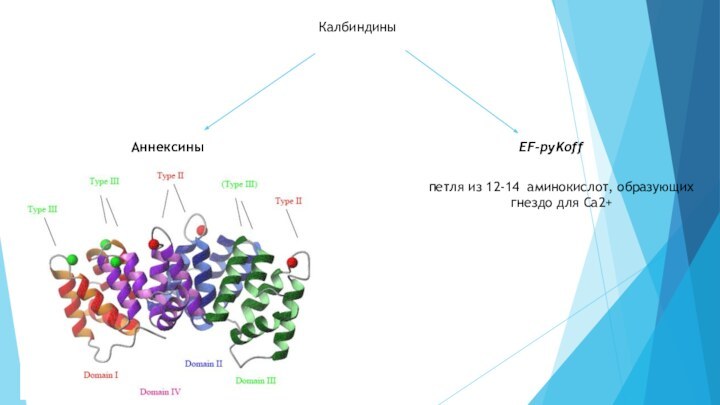
- 5. КалбиндиныАннексиныEF-pyKoffпетля из 12-14 аминокислот, образующих гнездо для Са2+
- 6. Известно около 10 видов данных белковСодержат 4
- 7. Белок S-100Характерно высокое содержание кислых аминокислот –
- 8. Основная область синтеза белков S100 – пирамидальные
- 9. На основании экспериментальных материалов и косвенных данных
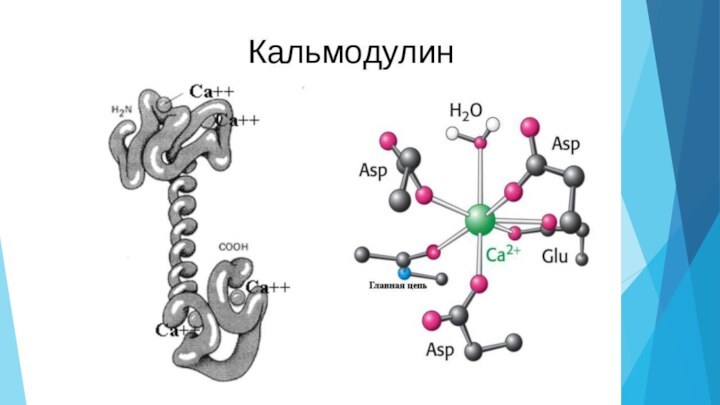
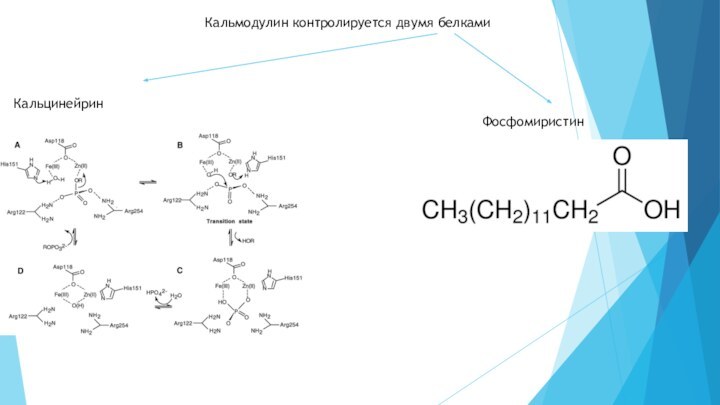
- 11. Кальмодулин контролируется двумя белкамиКальцинейринФосфомиристин
- 14. Неферментные белки, отвечающие за процессы адгезии и
- 15. Пептидная часть синтезируется на рибосомах независимо от
- 16. Гликопротеины делят на две основные группы по
- 18. Особый интерес представляют поверхностные гликопротеины, участвующие в
- 19. Сократительные и цитоскелетные белки нервной тканиМикротрубочки представляют
- 20. К актомиозинподобным белкам ЦНС относится нейростенин. Он
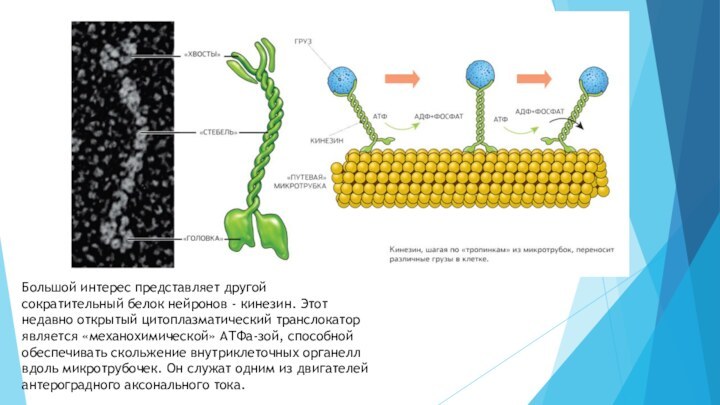
- 21. Большой интерес представляет другой сократительный белок нейронов
- 22. Регуляторные белкиОсобо необходимо остановиться на секретируемых белках,
- 24. К настоящему времени наиболее изучены три нейротрофина,
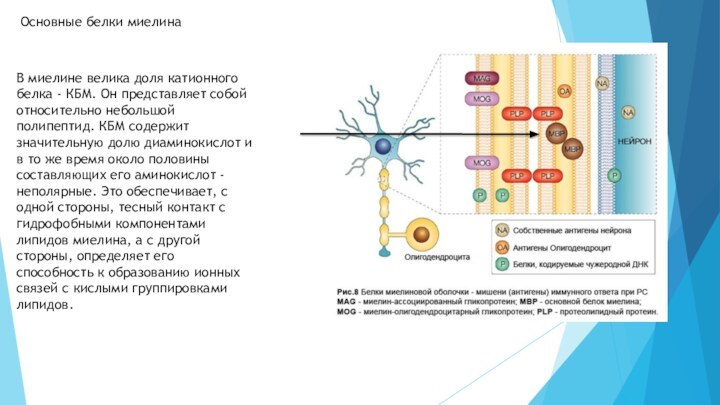
- 25. В миелине велика доля катионного белка -
- 26. Необычайно высокой гидрофобностью характеризуются так называемые протеолипидные
- 27. Довольна велика также доля так называемого белка
- 28. Миелинассоциированный гликопротеин, расположен на экстраделлюлярной поверхности мембран;
- 29. Основные белки глии1. Нейроспецифический а2-гликопротеин. В мозге
- 30. Скачать презентацию
- 31. Похожие презентации








Слайд 3
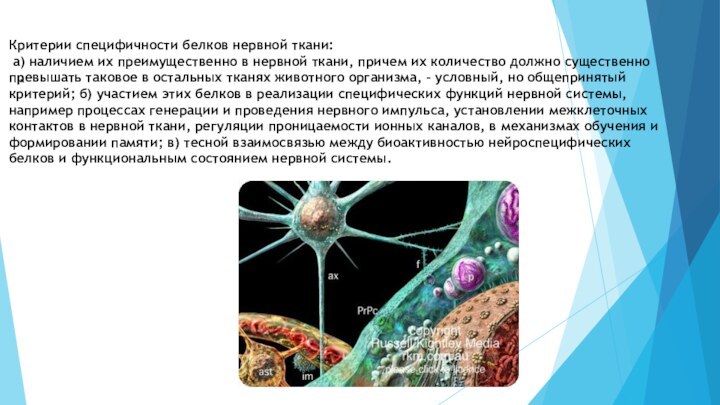
Идентификация нейроспецифических белков может быть осуществлена различными способами:
1)
сравнением белкового спектра мозга с белковыми спектрами других органов,
в том числе путем наложения электрофореграмм после двумерного электрофореза; при этом могут быть выявлены как новые белки, характерные только для нервной ткани, так и их изоэлектрические точки, молекулярные массы, субъединичный состав и даже примерное количество;2) с использованием иммунохимических методов, позволяющих определить нейроспецифические антигенные детерминанты, в том числе методом моноклональных антител и с помощью истощенных антисывороток; обработанные таким образом антисыворотки содержат антитела только к нейроспецифическим антигенным детерминантам;
3) с помощью направленного поиска нейроспецифических белков в различных участках и отделах мозга, в клеточных популяциях и в субклеточных структурах;
4) с помощью направленного поиска нейроспецифических изоферментов путем выявления ферментативной активности уже известных ферментов у вновь выделенных нейроспецифических белков;
5) с использованием методов генной инженерии, когда в качестве исходного материала применяется м-РНК мозга, с которой транскрибируется характерный нейроспецифический белок;
6) посредствам «дедуктивного» определения аминокислотных последовательностей белков нервной ткани - по нуклеотидным последовательностям генетической ДНК и м-РНК.
Слайд 4
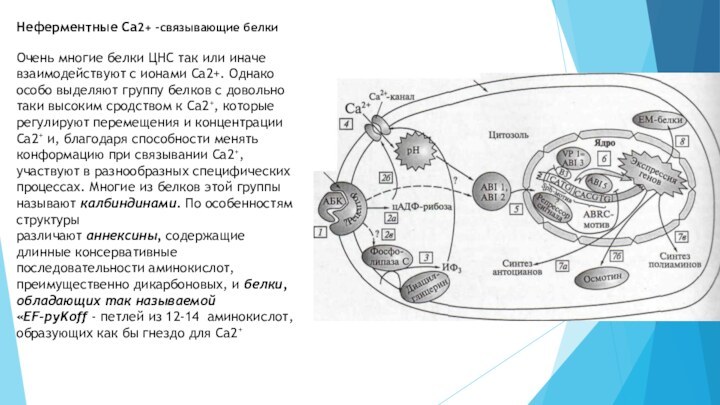
Неферментные Ca2+ -связывающие белки
Очень многие белки ЦНС так
или иначе взаимодействуют с ионами Са2+. Однако особо выделяют
группу белков с довольно таки высоким сродством к Са2+, которые регулируют перемещения и концентрации Са2+ и, благодаря способности менять конформацию при связывании Са2+, участвуют в разнообразных специфических процессах. Многие из белков этой группы называют калбиндинами. По особенностям структуры различают аннексины, содержащие длинные консервативные последовательности аминокислот, преимущественно дикарбоновых, и белки, обладающих так называемой «EF-pyKoff - петлей из 12-14 аминокислот, образующих как бы гнездо для Са2+
Слайд 6
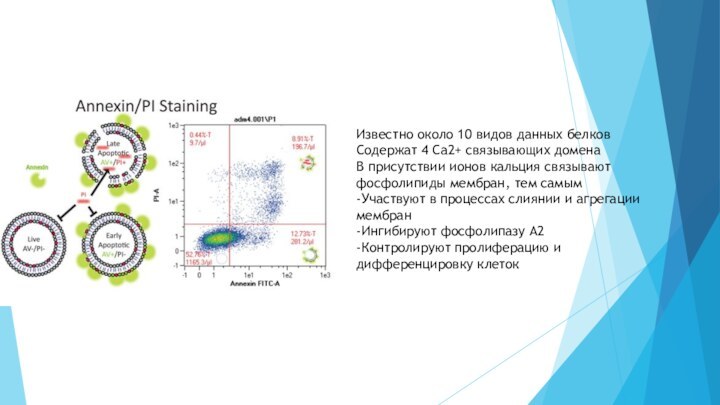
Известно около 10 видов данных белков
Содержат 4 Ca2+
связывающих домена
В присутствии ионов кальция связывают фосфолипиды мембран, тем
самым-Участвуют в процессах слиянии и агрегации мембран
-Ингибируют фосфолипазу А2
-Контролируют пролиферацию и дифференцировку клеток
Слайд 7
Белок S-100
Характерно высокое содержание кислых аминокислот – около
36% приходится на остатки глутаминовой и 22% - на
остатки аспарагиновой кислоты, т.е. более половины состава белка приходится на моноаминодикарбоновые аминокислоты. Из оставшихся 42% основная масса приходится на гидрофобные алифатические аминокислоты, придающие глобулам гидрофобный характер. 3-4% приходится на цистеин. Часть SH-групп цистеина свободна и способна к взаимодействию с ионами кальция. Такое взаимодействие ведет к изменению конформации молекул белка S-100.Глутаминовая кислота
Аспарагиновая кислота
Цистеин
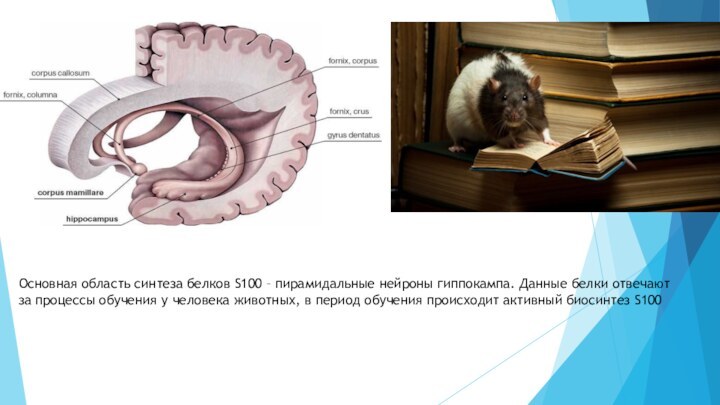
Слайд 8 Основная область синтеза белков S100 – пирамидальные нейроны
гиппокампа. Данные белки отвечают за процессы обучения у человека
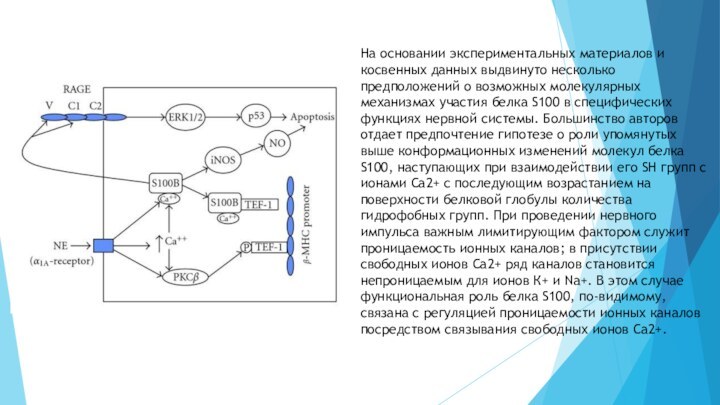
животных, в период обучения происходит активный биосинтез S100Слайд 9 На основании экспериментальных материалов и косвенных данных выдвинуто
несколько предположений о возможных молекулярных механизмах участия белка S100
в специфических функциях нервной системы. Большинство авторов отдает предпочтение гипотезе о роли упомянутых выше конформационных изменений молекул белка S100, наступающих при взаимодействии его SH групп с ионами Са2+ с последующим возрастанием на поверхности белковой глобулы количества гидрофобных групп. При проведении нервного импульса важным лимитирующим фактором служит проницаемость ионных каналов; в присутствии свободных ионов Са2+ ряд каналов становится непроницаемым для ионов К+ и Na+. В этом случае функциональная роль белка S100, по-видимому, связана с регуляцией проницаемости ионных каналов посредством связывания свободных ионов Са2+.Слайд 14 Неферментные белки, отвечающие за процессы адгезии и межклеточного
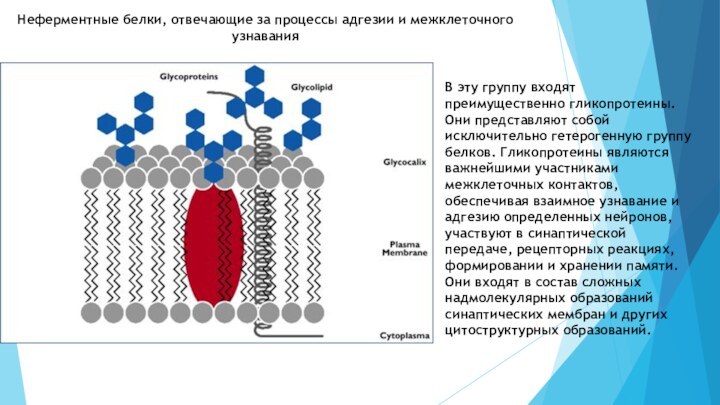
узнавания
В эту группу входят преимущественно гликопротеины. Они представляют собой
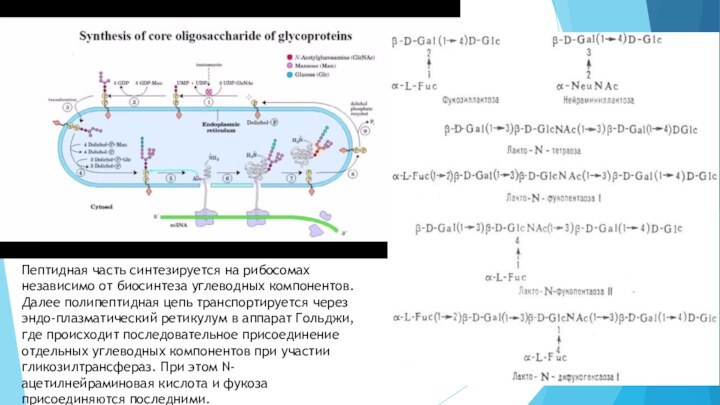
исключительно гетерогенную группу белков. Гликопротеины являются важнейшими участниками межклеточных контактов, обеспечивая взаимное узнавание и адгезию определенных нейронов, участвуют в синаптической передаче, рецепторных реакциях, формировании и хранении памяти. Они входят в состав сложных надмолекулярных образований синаптических мембран и других цитоструктурных образований.Слайд 15 Пептидная часть синтезируется на рибосомах независимо от биосинтеза
углеводных компонентов. Далее полипептидная цепь транспортируется через эндо-плазматический ретикулум
в аппарат Гольджи, где происходит последовательное присоединение отдельных углеводных компонентов при участии гликозилтрансфераз. При этом N-ацетилнейраминовая кислота и фукоза присоединяются последними.Слайд 16 Гликопротеины делят на две основные группы по количеству
белков и углеводов в составе их молекул.
Первая группа содержит
от 5 до 40% углеводов и их производных. Белковая часть сходна с альбуминами и глобулинами. Между пептидными и углеводными компонентами гликопротеинов существуют не только ковалентные, но и водородные, гидрофобные и вандерваальсовы связи.Вторая группа гликопротеинов содержит большое количество углеводов - от 40 до 85%; в состав представителей этой группы иногда входят липидные компоненты. В последнем случае образуются более сложные комплексы - гликолипопротеины. Например, в состав одного из гликолипопротеинов, выделенных из серого вещества головного мозга человека, входят 208 остатков галактозы, 26 - глюкозы, 36 - галактозамина, 150 - нейраминовой кислоты, 100 - лигноцерино-вой кислоты, 100 - сфингозина. Пептидная часть состоит из 61 а.о.: 13 - глутамата, 10 - глицина, 10 - пролина, 8 - серина, 6 - аланина; остальные аминокислоты содержатся в незначительных количествах. Как видно, пептидная часть молекулы довольно монотонна по составу, даже по сравнению с углеводным компонентом.
Слайд 18 Особый интерес представляют поверхностные гликопротеины, участвующие в клеточной
адгезии. Довольно хорошо исследованы 6 таких белков: D2, N-CAM,
К4, BSP-2, Ng-CAM и L-1. Первые четыре обеспечивают гомотопическую адгезию между нейронами. Характерной особенностью их является модификация структуры в ходе онтогенеза, которая затрагивает в основном углеводную часть молекулы. В эмбриональный период во время интенсивной миграции нейронов и постнатально в стадии активного синаптогенеза нейроспецифические белки клеточной адгезии представлены в значительной мере полисиалогликопротекнамн В мозге взрослых животных они модифицируются в олигосиало- или асиалогликопротеины, состоящие из 2-3 полипептидных цепей. Предполагается, что модуляция адгезии происходит именно за счет изменения числа остатков сиаловых кислот в полисиалогликопротеине.Гетеротипическая Са+-независимая адгезия между нейронами и глиальными клетками опосредована специфическим гликопротеином Ng-CAM, имеющим Мг = 135 кД. По сравнению с гликопротеином N-CAM, влияющим на межнейрональные контакты, белок Ng-CAM содержит меньшее количество сиаловых кислот. Он локализован исключительно на поверхности плазматической мембраны нейронов и в ходе онтогенеза появляется на более поздних стадиях, чем гликопротеин N-CAM.
Слайд 19
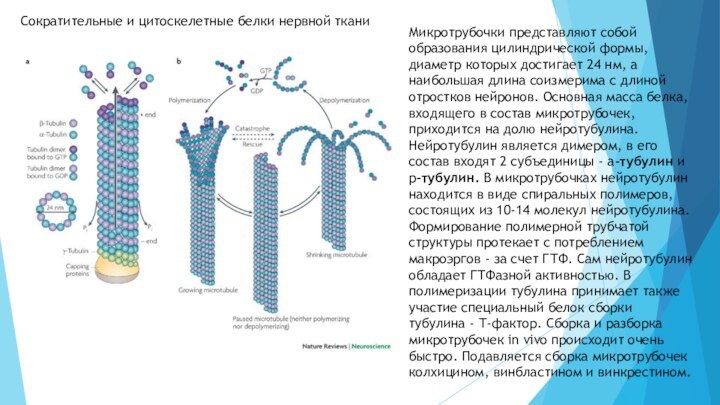
Сократительные и цитоскелетные белки нервной ткани
Микротрубочки представляют собой
образования цилиндрической формы, диаметр которых достигает 24 нм, а
наибольшая длина соизмерима с длиной отростков нейронов. Основная масса белка, входящего в состав микротрубочек, приходится на долю нейротубулина.Нейротубулин является димером, в его состав входят 2 субъединицы - а-тубулин и р-тубулин. В микротрубочках нейротубулин находится в виде спиральных полимеров, состоящих из 10-14 молекул нейротубулина. Формирование полимерной трубчатой структуры протекает с потреблением макроэргов - за счет ГТФ. Сам нейротубулин обладает ГТФазной активностью. В полимеризации тубулина принимает также участие специальный белок сборки тубулина - Т-фактор. Сборка и разборка микротрубочек in vivo происходит очень быстро. Подавляется сборка микротрубочек колхицином, винбластином и винкрестином.
Слайд 20 К актомиозинподобным белкам ЦНС относится нейростенин. Он состоит
из двух белков - нейрина и стенина. Взаимодействуя между
собой, они образуют комплекс - нейростенин. Он имеет много общего с актомиозином мышцы по структуре и по функциям, хотя и не идентичен ему.Нейростенин обладает АТФазной активностью и активируется ионами Са+ и Mg+. Количество нейростенина составляет около 1-1,5% от общего белка мозга; однако в синаптических образованиях его содержание достигает 8-10%. Нейрин локализован преимущественно в пресинаптических мембранах, а стенин - на наружной поверхности мембран везикул. С формированием нейростенина в присутствии АТФ и ионов Са2+ связывают предположительно контакт везикул с пресинаптическими мембранами. Полагают, что сократительные белки мозга, в том числе нейростенин, участвуют в раскрытии везикул и выходе нейромедиатора в цитоплазму и синаптическую щель. В «плавлении» мембраны везикул, происходящем при выбросе медиатора, важную роль играют также синапсины и другие Са-связывающие белки
Слайд 21 Большой интерес представляет другой сократительный белок нейронов -
кинезин. Этот недавно открытый цитоплазматический транслокатор является «механохимической» АТФа-зой,
способной обеспечивать скольжение внутриклеточных органелл вдоль микротрубочек. Он служат одним из двигателей антероградного аксонального тока.
Слайд 22
Регуляторные белки
Особо необходимо остановиться на секретируемых белках, выполняющих
функцию транспорта и защиты от разрушения пептидных регуляторов, вырабатываемых
ЦНС. Из них наиболее изучены нейрофизины, локализованные преимущественно в задней доле гипофиза и гипоталамуса. Они представляют собой гетерогенную группу низкомолекулярных кислых белков. Нейрофизины головного мозга человека и ряда животных достаточно хорошо исследованы. Выделены три фракции этих нейроспецифических белков - НФ1, НФ2, НФ3, а также четыре минорные фракции.Слайд 24 К настоящему времени наиболее изучены три нейротрофина, близких
друг другу по структуре: NGF, BDNF и NT3. Они
представляют собой относительно небольшие белки. В частности, минимальная по размеру активная форма NGF состоит из двух субъединиц. Различные нейротрофины имеют определенную специализацию:NGF - «опекает» нейроны периферических симпатических ганглиев, а также холинергические нейроны переднего мозга,
BDNF - часть моторных и сенсорных нейронов, a NT3 - нейроны гиппокампа. Трофическая функция и стимуляция роста аксонов нейротрофинами имеют особое значение в онтогенезе, при повреждениях ЦНС, а также в некоторых критических состояниях, например при эпилептических судорогах. В онтогенезе мозга достижение тем или иным аксоном клетки-мишени ведет к ретроградному сигналу, осуществляемому нейротрофином, который обеспечивает выживание соответствующего нейрона, Нейроны, аксоны которых не достигают мишени, погибают.
Слайд 25 В миелине велика доля катионного белка - КБМ.
Он представляет собой относительно небольшой полипептид. КБМ содержит значительную
долю диаминокислот и в то же время около половины составляющих его аминокислот - неполярные. Это обеспечивает, с одной стороны, тесный контакт с гидрофобными компонентами липидов миелина, а с другой стороны, определяет его способность к образованию ионных связей с кислыми группировками липидов.Основные белки миелина
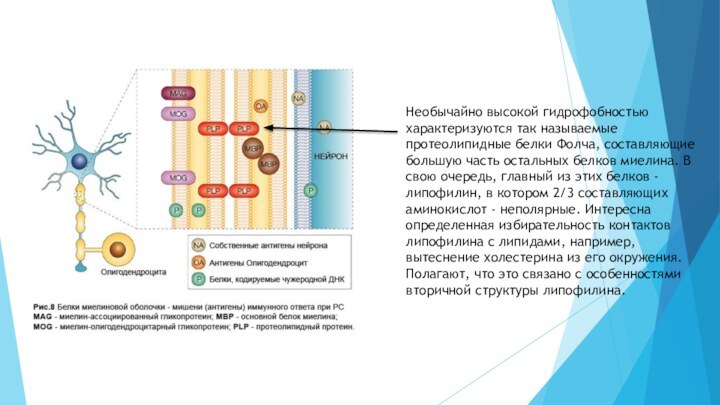
Слайд 26 Необычайно высокой гидрофобностью характеризуются так называемые протеолипидные белки
Фолча, составляющие большую часть остальных белков миелина. В свою
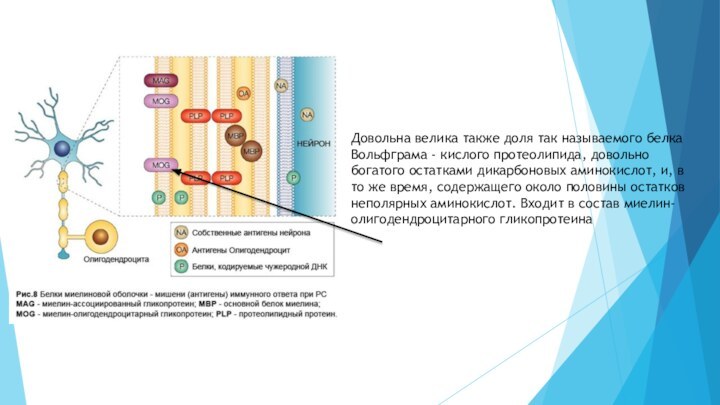
очередь, главный из этих белков - липофилин, в котором 2/3 составляющих аминокислот - неполярные. Интересна определенная избирательность контактов липофилина с липидами, например, вытеснение холестерина из его окружения. Полагают, что это связано с особенностями вторичной структуры липофилина.Слайд 27 Довольна велика также доля так называемого белка Вольфграма
- кислого протеолипида, довольно богатого остатками дикарбоновых аминокислот, и,
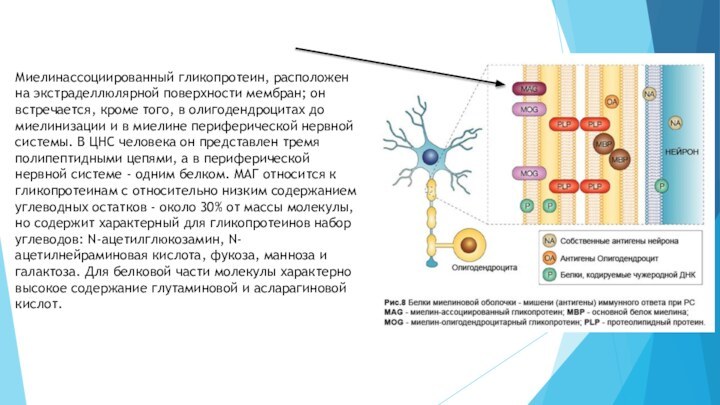
в то же время, содержащего около половины остатков неполярных аминокислот. Входит в состав миелин-олигодендроцитарного гликопротеинаСлайд 28 Миелинассоциированный гликопротеин, расположен на экстраделлюлярной поверхности мембран; он
встречается, кроме того, в олигодендроцитах до миелинизации и в
миелине периферической нервной системы. В ЦНС человека он представлен тремя полипептидными цепями, а в периферической нервной системе - одним белком. МАГ относится к гликопротеинам с относительно низким содержанием углеводных остатков - около 30% от массы молекулы, но содержит характерный для гликопротеинов набор углеводов: N-ацетилглюкозамин, N-ацетилнейраминовая кислота, фукоза, манноза и галактоза. Для белковой части молекулы характерно высокое содержание глутаминовой и асларагиновой кислот.
Слайд 29
Основные белки глии
1. Нейроспецифический а2-гликопротеин. В мозге человека
он появляется на 16-й неделе эмбрионального развития. Углеводные компоненты
его включают глюкозамин, маннозу, глюкозу, галактозу, галактозамин и N_ацетилнейраминовую кислоту. а2-гликопротеин локализован только в астроцитах, но отсутствует в нейронах, олигодендроцитах и в клетках эндотелия. Поэтому его можно рассматривать как один из специфических маркеров астроцитов.2. Глиальный фибриллярный кислый белок (GFA). Он специфичен только для ЦНС, а в ПНС он не обнаружен. Содержание его в белом веществе головного мозга превышает таковое в сером веществе. В онтогенезе максимальное содержание GFA наблюдается между 10м и 14м днями постнатального развития, т.е. совпадает по времени с периодом миелинизации и пиком дифференцировки астроцитов. Глиальная локализация этого белка также позволяет использовать его как «маркерный» белок для этих клеток.