Слайд 2
Живые системы включают в свой состав
все хими-ческие элементы, которые находятся в окружающей его среде.
Наибольшая доля приходится на элементы О, Н, С и N.
Одно из важнейших отличий состава живых системе от неживых - присутствие биомакромолекул: нуклеи-новых кислот, белков, полисахаридов, липидов и других биополимеров.
Биомолекулы сами по себе не являются «живыми». Они «оживают» только тогда, когда:
- Располагаются в пространстве клетки в строго
определенном порядке (компартментализация, как
проявление высокого уровня структурной органи-
зации);
Взаимодействуют строго определенным образом
(ферментативный катализ, как проявление высоко-
эффективной саморегуляции).
Слайд 3
Живые системы – открытые системы, способные
к саморегуляции, самоорганизации и самовоспроизве-дению. Они обладают, в частности,
свойством раздражимости: живые системы отвечают специфи-ческими реакциями на определенные внешние воздей-ствия.
Адекватный и своевременный ответ клетки, органа, организма на внешнее воздействие возможен только на основе интеграции метаболических процессов.
Интеграции проявляется через регуляцию активнос-ти ферментов.
На прошлой лекции были перечислены пять страте-гий регуляции метаболизма. Теперь каждая и них будет рассмотрена подробно.
Слайд 4
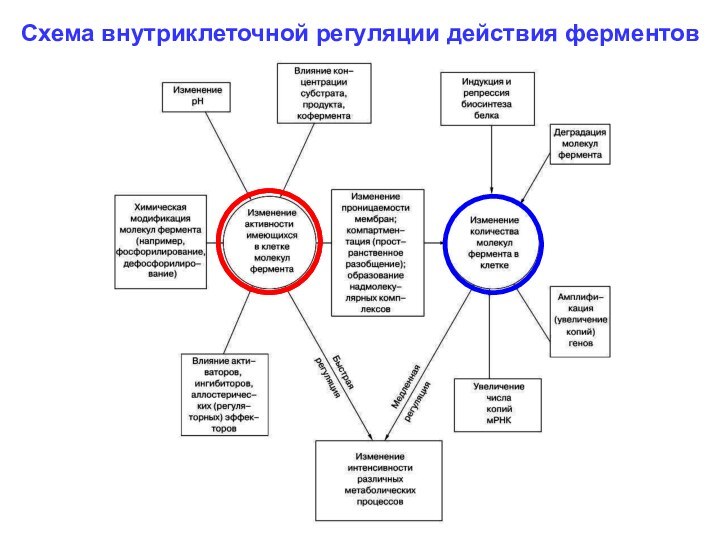
Схема внутриклеточной регуляции действия ферментов
Слайд 5
I стратегия: Быстрое изменение каталитической активности
ключевых (регуляторных) ферментов под влиянием аллостерических регуляторов.
Ключевые (регуляторные) ферменты – аллостеричес-кие ферменты. Демонстрируют особую кинетику, отли-чающуюся от классической. Эта особенность обуслов-лена субъединичностью строения молекул данных ферментов и наличием нескольких каталитических центров. На этой основе реализуется кооперативность взаимодействия каталитических центров: согласован-ное изменение сродства субстрата к центру. Конечный эффект всегда больше, чем просто сумма активностей каждого центра.
Аллостерические регуляторы, действуя в очень ма-лых концентрациях, с высоким сродством взаимодей-ствуют с регуляторными центрами. Каждый регулятор имеет собственный центр для связывания. Итог – кратное изменение активности фермента при неизмен-ной концентрации субстрата.
Слайд 6
В ферментативном катализе принципиально важен
этап
образования комплекса фермент-субстрат (ES):
E + S ?? ES ? E + P
При действии аллостерических регуляторов, почти
во всех известных случаях, регуляторный эффект
обусловлен изменением скорости образования ком-
плекса ES.
Увеличение скорости образования ЕS в присутствии
аллостерического регулятора обусловлено увеличе-
нием сродства активного центра E к S.
Сравнительно небольшие сдвиги сродства активного
центра фермента к субстрату приводят к значительным
изменениям скорости реакции (интенсивности катализа).
Слайд 7
Vmax1
VmaxK
Vmax2
Km1
KmK
Km2
Влияние аллостерических регуляторов на Vmax
In vivo [S] почти
всегда ниже, чем это необ-
ходимо для насыщения фермента. Незна-
чительное
увеличение сродства фермента к
S способно значительно приблизить скорость
катализа к его потенциальной Vmax.
Слайд 8
II стратегия: А. Ковалентная модификация фермен-тов
путём фосфорилирования – дефосфорилирова-ния. Эта модификация обратима.
Действует
параллельно с аллостерической регуляцией и реали-зуется также сравнительно быстро. Это одна из самых распро-странённых форм обратимой посттрансляционной модификации белков.
Фосфорилирование молекулы фермента идёт с
участием протеинкиназ. Протеинкиназы (ПК) - подкласс
ферментов киназ (фосфотрансфераз, КФ 2.-.-.- ).
ПК модифицируют белки (не только ферменты) путем
фосфорилирования остатков аминокислот, имеющих
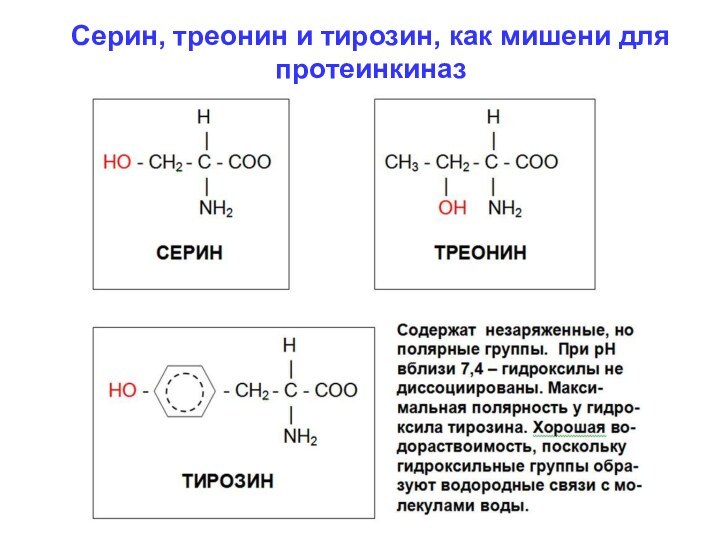
гидроксильные группы - серин, треонин и тирозин.
ПК отщепляют фосфатную группу от АТФ и кова-лентно присоединяют её к остатку соответствующей аминокислоты:
О-
|
- Р = О фосфорильная группа
|
O-
Слайд 9
Серин, треонин и тирозин, как мишени для
протеинкиназ
Слайд 10
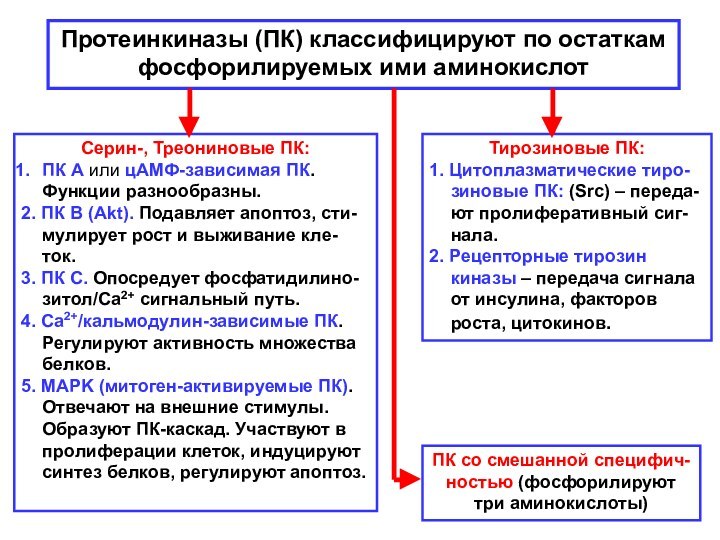
Протеинкиназы (ПК) классифицируют по остаткам
фосфорилируемых ими аминокислот
Тирозиновые ПК:
1. Цитоплазматические тиро-зиновые ПК: (Src) – переда-ют пролиферативный
сиг-нала.
2. Рецепторные тирозин киназы – передача сигнала от инсулина, факторов роста, цитокинов.
Серин-, Треониновые ПК:
ПК А или цАМФ-зависимая ПК. Функции разнообразны.
2. ПК В (Akt). Подавляет апоптоз, сти-мулирует рост и выживание кле-ток.
3. ПК С. Опосредует фосфатидилино-зитол/Са2+ сигнальный путь.
4. Ca2+/кальмодулин-зависимые ПК. Регулируют активность множества белков.
5. МАРK (митоген-активируемые ПК). Отвечают на внешние стимулы. Образуют ПК-каскад. Участвуют в пролиферации клеток, индуцируют синтез белков, регулируют апоптоз.
ПК со смешанной специфич-ностью (фосфорилируют
три аминокислоты)
Слайд 11
Дефосфорилирование молекулы фермента или другого белка
происходит с участием протеинфосфа-таз.
Протеинфосфатазы, PP (protein phosphatase)
Тирозин-специфичные
РР:
Участвуют в регуляции МАРК-сигнального пути, в контроле пролиферации, дифференци-ровке клеток и клеточного цик-ла.
Серин-, треонин-специфичная
РР:
Регулируют пролиферацию, дифференцировку клеток, эм-бриональное развитие и апо-птоз.
РР с двойной специфичностью:
Примером могут служить РР, де-
фосфорилирующие активные МАРК
Слайд 12
II стратегия: Б. Нековалентная модификация фермен-тов.
Реализуется путем ограниченного (лимитирован-ного) протеолиза. Как правило, носит каскадный
харак-тер и необратима.
Ферменты, катализирующие многие важные превра-щения биомолекул, изначально синтезируются в неак-тивной форме (проферменты или зимогены).
Активация профермента (зимогена) происходит с участием различных протеаз.
Примеры:
- активация химотриписна
- активация каскада ферментов свертывающей систе-
мы крови
- активация каскада каспаз для релизации апоптоза.
Слайд 13
Каскадный механизм, приводящий к свертыванию крови
Последовательность из 5
ферментов,
в которой каждый фермент активирует
следующий путем отщепления
небольшого
фрагмента пептидной цепи
(ограниченный / лимитированный протеолиз).
Природа процесса – каталитическая, что
позволяет каждому фактору запускать
реакцию, присутствуя изначально в очень
малых количествах.
Контакт с неприродной поверхностью
Для полноценно протекающего
процесса важны оба механизма.
(тоже протеолитический фермент)
Мономеры образующегося фибрина
спонтанно образуют фибриллы
Слайд 14
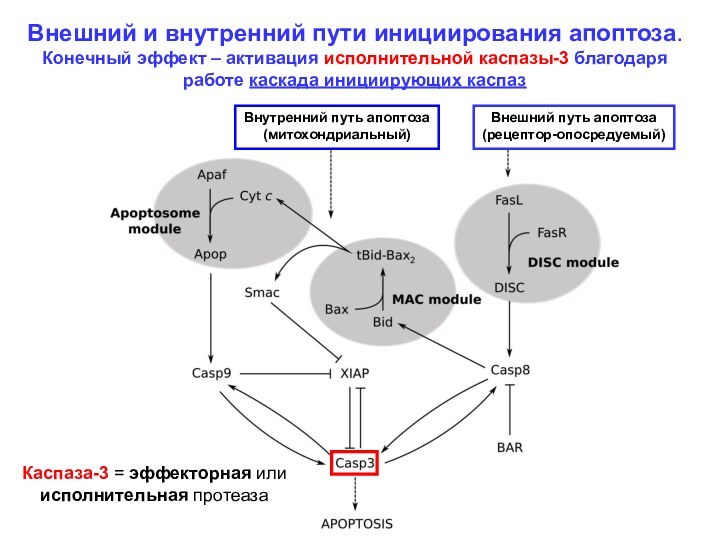
Внешний и внутренний пути инициирования апоптоза.
Конечный эффект –
активация исполнительной каспазы-3 благодаря
работе каскада инициирующих каспаз
Внешний путь
апоптоза
(рецептор-опосредуемый)
Внутренний путь апоптоза
(митохондриальный)
Каспаза-3 = эффекторная или
исполнительная протеаза
Слайд 15
Каспазы (англ. caspase + cysteine-dependent aspar-tate specific
protease) — семейство внутриклеточных цистеиновых протеаз, расщепляющих пептидные связи
белков, следующих после аспартата.
Каспазы всегда вовлечены в процесс сигнальной трансдукции (не только в апоптозе). Не известны факты участия каспаз в неспецифическом расщепле-нии белков.
В зависимости от функциональной принадлежно-сти, неактивные формы каспаз (зимогены) могут образовывать как мономер, так и димеры. В процес-се «созревания» происходит аутокаталитическое расщепление каталитического домена на большую (α) и малую (β) субъединицы, которые в активированной протеазе тесно взаимосвязаны. В каждой молекуле содержится 2 каталитических центра.
Слайд 16
Общая схема «созревания» / активации каспаз
Зимоген каспазы
α
β
α
β
Catalytical dyad
= каталитическая пара
Активная каспаза –
- тетрамер
Слайд 17
Очевидно, что I и II стратегии
регуляции
обеспечивают не только быстрый, но и очень точный механизм
контроля метаболизма.
Слайд 18
III стратегия: Изменение количества фермента –
уси-ление его биосинтеза, либо разрушение уже имеющих-ся молекул фермента.
Это путь медленного изменения активности метаболических путей. Реализуется спустя часы, поскольку идет синтез белка de novo.
Изменение количества фермента – более грубый ме-ханизм регуляции метаболизма (по равнению с изме-нением каталитических свойств ферментов).
А. Ферменты конститутивные — ферменты, постоян-но синтезируются в клетках организма независимо от условий существования или наличия соответствую-щих субстратов.
Слайд 19
Б. Ферменты индуцируемые – скорость их синтеза
изменяется в зависимости от условий существования
организма.
Регуляция синтеза происходит на генетическом
уровне под действием индукторов (соответствующие
субстраты или метаболиты).
Ген «выключен», пока с
соответствующим участком ДНК связан белок-репрессор.
Белки-репрессоры – типичные аллостерические белки. Вещества-индукторы синтеза данного фермен-та, с высоким сродством связываются со своими регуляторными участками на белке-репрессоре, молекула репрессора диссоциирует и экспрессия гена начинается.
Слайд 20
Синтез индуцируемых ферментов - одно из проявле-ний биохимической адаптации метаболизма клетки к
изменившимся условиям существования.
Итог: либо увеличивается количество уже имеюще-гося фермента, что обеспечивает более быстрое
протекание определённой реакции, либо вырабатыва-ются новые ферменты, ранее отсутствовавшие в
клетке или ткани.
Синтез ферментативного белка de novo регулиру-ется на:
- этапе транскрипции
- этапе трансляции
- этапе деградации мРНК
Слайд 21
IV стратегия: Компартментализация ферментов и
метаболических
путей. Пространственное разделение метаболических путей позволяет согласованно и одновременно
протекать анаболическим и катаболи-ческим реакциям в пределах одной клетки.
1. Ферменты, встроенные в мембраны.
2. «Растворимые» ферменты (в том числе те, которые
образуют полиферментные комплексы).
Компартментализация позволяет регулировать активность фермента с помощью:
- доступности субстрата(ов);
- доступности кофактора(ов);
- удаления продуктов и направление их в другие ком-
партменты клетки, где они требуются;
- реализации механизма обратной (+/-) связи.
Слайд 22
Основные компартменты клетки:
Плазматическая мембрана
Ядро
Цитоскелет
Митохондрии: внутренняя мембрана и матрикс
ЭПР
(микросомы): мембрана и внутреннее про-
странство цистерн ЭПР
Комплекс (аппарат) Гольджи
Лизосомы
Пероксисомы
Везикулы накопления
Цитоплазма
Слайд 23
Существуют ферменты (киназы), которые при
переходе из неактивной
в активную форму изменяют своё местонахождение (компартмен-тализацию)
1.
Raf (Rapidly accelerated fibrosarcomа) – серин-трео-ниновая ПК. В неактивной конформации ПК находится в цитоплазме. Факторы роста (посредством рецепто-ров, обладающих тирозинкиназной активностью) активируют мембранный белок Ras. Ras взаимодей-ствует c N-концевым доменом неактивного Raf и этим рекрутирует Raf из цитоплазмы в мембрану, где завер-шается процесс активации Raf.
Raf – первая ПК в каскаде сигнального пути МАРК – основной сигнальный путь стимулирующий пролиферацию клеток.
Слайд 24
2. Протеинкиназа С (ПКС) – серин-треониновая
ПК. В неактивной конформации ПК находится в цитоплазме. Многочисленные
лиганды рецепторов, сопряженных с G-белком активируют мембранный гетеротримерный G-белок. Активируется связанная с мембраной ФЛаза С, специфичная к ФИФ2. 1-й продукт ИФ3 (гидрофиль-ный) стимулирует Са2+-каналы ЭПР, что повышает внутриклеточную [Ca2+]. Неактивная ПКС, связавшись с Ca2+, перемещается в внутренний слой плазматичес-кой мембраны и связывается с ним за счет «-» заряда головок ФС. В мембране ПКС встречается со 2-м про-дуктом ФЛазы С – с ДАГ (гидрофобен). Происходит активация ПКС.
В различных типах клеток присутствуют различные изоформы ПКС, каждая из которых имеет свою молекулу-мишень: клеточное деление, секреция, экзо-цитоз, транспорт ионов, сокращении гладких мышц и пр.
Слайд 25
V стратегия: Гормональная (эндокринная) регуляция.
Под действием гормонов (первичных мессендже-ров) внутри клетки синтезируются
вторичные мессен-джеры, которые изменяют активность различных внутриклеточных ферментов и путей обмена.
Эндокринная система координирует (согласовывает) различные типы обмена, протекающего в различных органах, в зависимости от режимов питания или от внешних воздействий на организм.
1. Анаболические гормоны (СТГ, инсулин, андро- и эстрогены). Обеспечивают рост и аккумулирование. Интегральный показатель: «+» азотистый баланс.
2. Катаболические гормоны (катехоламины, глюкокор-тикоиды, глюкагон). Стимулируют реакции расщепле-ния.
Слайд 26
Каждый тип клетки содержит специфическую комби-
нацию
различных рецепторов, что даёт ей возмож-
ность по разному отвечать
на действие нескольких
гормонов.
Каждая из комбинаций рецепторов определяет характер ответа клетки: рост, деление или дифферен-цировку.
Благодаря использованию разными типами клеток различных рецепторов, позволяет им тонко регулиро-вать своё функциональное состояние. При этом вполне достаточно сравнительно небольшого комп-лекта гормонов.
Слайд 27
Мультиферментные комплексы
(как пример нековалентной модификации ферментов)
При
работе мультиферментного комплекса: продукт первого фермента в составе комплекса
тут же стано-вится субстратом следующего фермента этого же ком-плекса.
Благодаря такой структурной организации:
скорость превращения молекул чрезвычайно высока,
поскольку нет ограничений, связанных с диффузией
молекулы субстрата к активному центру фермента;
реализуется высокоэффективная регуляция процес-
са.
Слайд 28
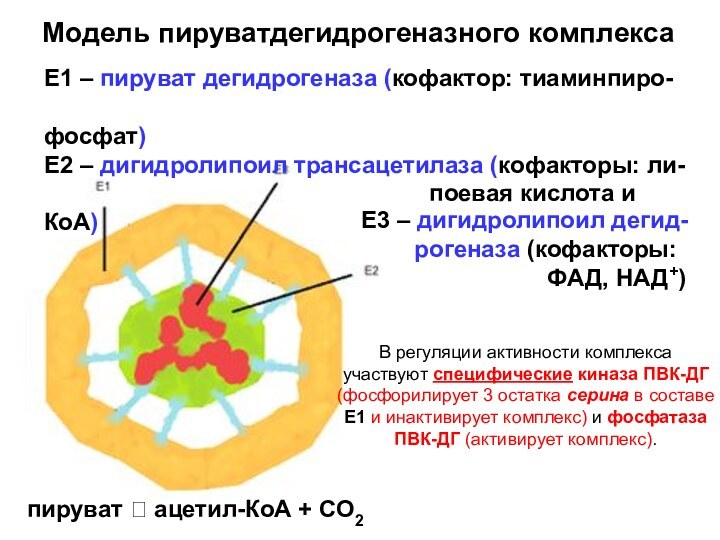
Модель пируватдегидрогеназного комплекса
Е1 – пируват дегидрогеназа (кофактор: тиаминпиро-
фосфат)
Е2 – дигидролипоил трансацетилаза (кофакторы: ли-
поевая кислота и КоА)
Е3 – дигидролипоил дегид-
рогеназа (кофакторы:
ФАД, НАД+)
пируват ? ацетил-КоА + СО2
В регуляции активности комплекса
участвуют специфические киназа ПВК-ДГ
(фосфорилирует 3 остатка серина в составе
Е1 и инактивирует комплекс) и фосфатаза
ПВК-ДГ (активирует комплекс).
Слайд 29
Изоферменты (изоэнзимы)
Изоферменты – молекулярные формы
(изотипы) одного фермента.
Изоферменты отличаются по их
первичной струк-туре, что детерминировано генетически.
Изоферменты – проявление полиморфизма генов (различные локусы) и наличия нескольких аллелей у гена.
Они катализируют одну и ту же реакцию, но отлича-ются по физико-химическим свойствам, э/ф – под-вижности, сродству к S (Km), чувствительности к ингибиторам, рН-оптимуму и т.д.
Как правило, каждый из изоферментов локализован в определенной ткани.
Первым ферментом, для которого были выявлены изотипы – лактатдегидрогеназа (ЛДГ).
Слайд 30
ЛДГ существует в виде 5 изоферментов.
Все они являются вариантами комбинации в различных соотношениях двух
типов субъединиц: Н-тип и М-тип. Таким образом, пять изоферментов ЛДГ, составлены из следующих типов: H4, H3M1, H2M2, H1M3 и M4
Схема комбинации Н- и М- субъединиц в изоферментах ЛДГ.
M4 = ЛДГ-5 (миокард).
Слайд 31
В зависимости от степени подвижности при
электро-форезе в крахмальном геле, изоферменты ЛДГ нумеруют:
ЛДГ-1, обладающий наибольшей подвижностью, со-держится преимущественно в миокарде;
ЛДГ-5, обладающий наименьшей подвижностью, пре-имущественно локализован в гепатоцитах;
ЛДГ-4 преимущественно локализован в скелетных мышцах и отчасти в гепатоцитах. Это причина того, что при болезни Боткина, в сыворотке крови больного одновременно повышается активность и содержание ЛДГ-5 и ЛДГ-4;
ЛДГ-3 преимущественно содержится в легких;
ЛДГ-2 преимущественно локализован в эритроцитах и почках.
Слайд 32
Биологический смысл существования изоферментов:
В разных тканях
существует разная концентрация субстрата для одного и того же
биохимического превращения;
Разные ткани в разной степени нуждаются в глюко-зе: для ткани ЦНС глюкоза основное «метаболическое топливо».
Гексокиназа клеток головного мозга имеет Км = 0,05 mМ; ее изофермент в печени (глюкокиназа) имеет
Км = 10 mМ (различаются в 200 раз).
Прикладное значение определения активности изо-ферментов - клиническая лабораторная диагностика (тканевая локализация патологического процесса).
Слайд 33
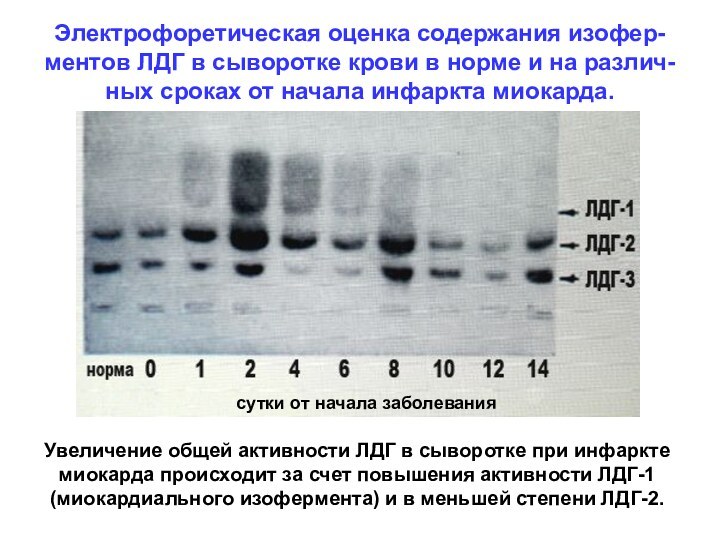
Электрофоретическая оценка содержания изофер-ментов ЛДГ в сыворотке крови
в норме и на различ-ных сроках от начала инфаркта
миокарда.
Увеличение общей активности ЛДГ в сыворотке при инфаркте миокарда происходит за счет повышения активности ЛДГ-1 (миокардиального изофермента) и в меньшей степени ЛДГ-2.
сутки от начала заболевания





![Основные стратегии регуляции метаболических путей Vmax1VmaxKVmax2Km1KmKKm2Влияние аллостерических регуляторов на VmaxIn vivo [S] почти всегда ниже, чем это](/img/tmb/15/1424041/0ae8e15b91773ed21eeb0e585c071c01-720x.jpg)