- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Скорость химической реакции (11 класс)
Содержание
- 2. Цель урокаСформировать у учащихся основные представления о скорости химической реакции
- 3. Задачи урокаОбразовательные: 1) на основе повторения
- 4. Ход урокаОрганизационный этап
- 5. Организационный моментВзаимное приветствие учащихся и учителя; фиксация
- 6. Подготовка к основному этапу усвоения
- 7. Теоретическое исследованиеФормула скорости химической реакцииСкорость химической реакции
- 8. Для гомогенной реакции: Для гетерогенной реакции: Формула скорости для
- 9. Выполнение исследования Задание I группеВ две пробирки
- 10. Задание II группе В две пробирки налейте
- 11. Задание III группеВ две пробирки налейте соляной
- 12. Задание IV группеВ две пробирки налейте соляной
- 13. Задание V группе В две пробирки налейте
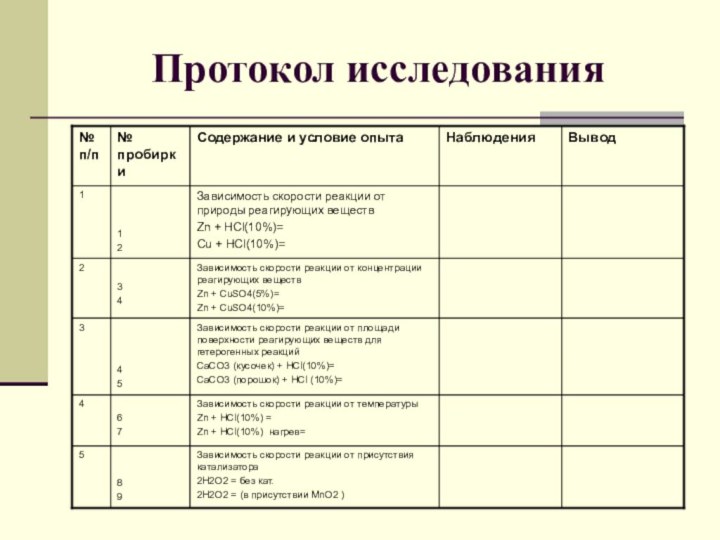
- 14. Протокол исследования
- 15. Выводы по исследованиюСкорость химической реакции зависит от:
- 16. Закон действующих масс Скорость химической реакции
- 17. Правило Вант-ГоффаПри повышении температуры на каждые 100
- 18. Закрепление знаний1) Решите задачи:1) Определите, как изменится
- 19. Самопроверкаа) подставить данные задачи в формулу:скорость реакции
- 20. Закрепление знаний2) Самостоятельная работа учащихся:Задание 1. Составьте
- 21. СамопроверкаРешение. Подставим соответствующие данные в кинетическое уравнение,
- 22. Домашнее заданиеПараграф 15 учебника Составить обобщающую таблицу. Приложение № 8. Выполнить тесты. Приложение № 9.
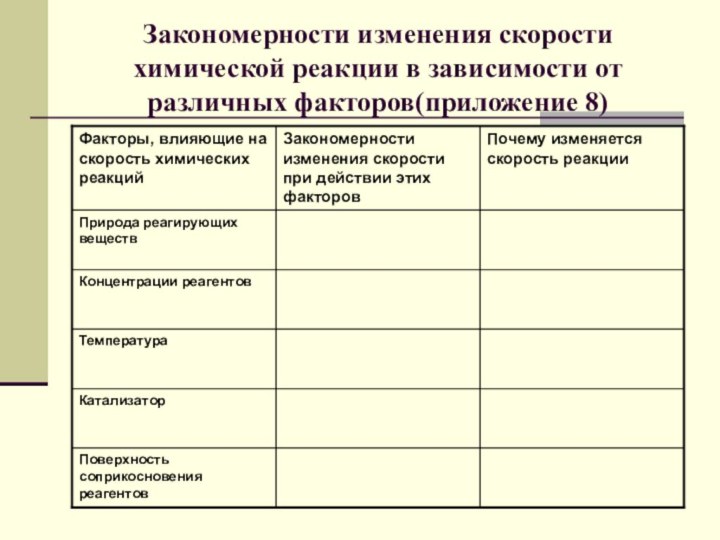
- 23. Закономерности изменения скорости химической реакции в зависимости от различных факторов(приложение 8)
- 24. Тесты (приложение 9)Вариант 1. Скорость химических
- 25. Скачать презентацию
- 26. Похожие презентации
Цель урокаСформировать у учащихся основные представления о скорости химической реакции






















Слайд 3
Задачи урока
Образовательные:
1) на основе повторения ранее
изученного материала и в ходе знакомства с новым материалом
углубить знания о химических реакциях: скорости химической реакции;2) выяснить зависимость скорости химической реакции от условий протекания;
3) создать условия для развития навыков самостоятельной исследовательской работы, умения делать выводы, обобщать результаты эксперимента.
Развивающие: способствовать развитию
1) навыков проведения эксперимента;
2) познавательных процессов учащихся: внимания, наблюдательности, способности правильно формулировать свои мысли в процессе анализа результатов эксперимента;
3) коммуникативных умений: устной монологической речи и диалога (при обсуждении результатов эксперимента в группе).
Воспитательные: способствовать развитию
1) познавательного отношения к предмету (через эксперимент)
2) коммуникативности (работа в группах);
3) экологическое воспитание.
Слайд 4
Ход урока
Организационный этап
Подготовка к основному этапу усвоения
учебного материала, актуализация опорных
знаний
Теоретическое исследование
Самоконтроль и самооценка возможностей предстоящей деятельности по изучению данной темы
Основной этап. Выполнение исследования
Закрепление знаний
Подведение итогов
Предъявление и обсуждение домашнего задания
Слайд 5
Организационный момент
Взаимное приветствие учащихся и учителя; фиксация отсутствующих;
проверка готовности учащихся к уроку: проверка наличия дневников, тетрадей,
учебников, карандашей, линеек; организация внимания.Слайд 6 Подготовка к основному этапу усвоения
учебного материала, актуализация опорных знаний
а) что такое скорость химической реакции и можно ли ей управлять?
б) зачем нужны знания о скорости химических реакций?
в) какими примерами можно подтвердить то, что химические реакции протекают с различными скоростями?
г) как определяют скорость механического движения, какова единица измерения этой скорости? (формулу записывают на доске)
д) как определяют скорость химической реакции?
е) какие факторы влияют на скорость химической реакции
Слайд 7
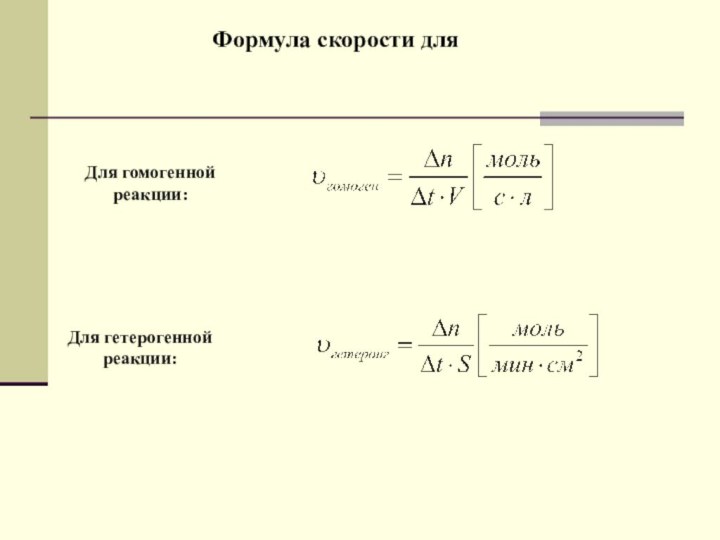
Теоретическое исследование
Формула скорости химической реакции
Скорость химической реакции –
величина, показывающая
изменение молярной концентрации вещества в единицу времени.
Слайд 9
Выполнение исследования Задание I группе
В две пробирки налейте
соляной кислоты. В одну опустите гранулу цинка, а в
другую – медную проволоку.*Сравните скорость взаимодействия различных металлов с соляной кислотой.
* В чем, по-вашему, причина различной скорости реакций кислоты с заданными металлами?
Слайд 10
Задание II группе
В две пробирки налейте растворы сульфата
меди (II) различной концентрации, определив большую или меньшую концентрацию
по насыщенности цвета раствора. В каждую пробирку поместите гранулу цинка.*В какой из пробирок выделение меди на цинке началось быстрее?
*Как это можно объяснить с точки зрения атомно-молекулярного учения?
Слайд 11
Задание III группе
В две пробирки налейте соляной кислоты.
Одновременно в одну пробирку поместите кусочек, а в другую
– порошок карбоната кальция.*В какой из пробирок реакция пройдет быстрее?
* Как это можно объяснить с точки зрения атомно-молекулярного учения?
Слайд 12
Задание IV группе
В две пробирки налейте соляной кислоты
и поместите в них по грануле цинка. Одну из
пробирок осторожно нагрейте.*В какой из пробирок выделение газа протекает более бурно?
* Как это можно объяснить с точки зрения атомно-молекулярного учения?
Слайд 13
Задание V группе
В две пробирки налейте перекись водорода.
В одну из пробирок осторожно присыпьте несколько кристалликов оксида
марганца (IV).*В какой из пробирок наблюдается бурное выделение газа? Какой это газ?
*Какую роль в этой реакции выполняет оксид марганца (IV)?
Слайд 15
Выводы по исследованию
Скорость химической реакции зависит от:
Природы
реагирующих веществ
Концентрации реагирующих веществ
От площади соприкосновения реагирующих веществ (в
гетерогенных реакциях)От температуры
От присутствия катализатора
Слайд 16
Закон действующих масс
Скорость химической реакции прямо пропорциональна
произведению концентраций реагирующих веществ, взятых в степенях, равных их
коэффициентам в уравнении реакции.mА + nВ = С
Слайд 17
Правило Вант-Гоффа
При повышении температуры на каждые 100 скорость
химической реакции увеличивается в 2-4 раза. Эту величину называют
температурным коэффициентом реакции, обозначается γ –гамма. Для каждой реакции числом от 2 до 4.
Слайд 18
Закрепление знаний
1) Решите задачи:
1) Определите, как изменится скорость
некоторой реакции: а) при повышении температуры от 10 до
500С; б) при понижении температуры от 100 – 00 С. Температурный коэффициент реакции равен 3. Решение (приложение № 7)2) Химическая реакция протекает в растворе, согласно уравнению: А+В = С. Исходные концентрации: вещества А – 0,80 моль/л, вещества В – 1,00 моль/л. Через 20 минут концентрация вещества А снизилась до 0, 74 моль/л. Определите: а) среднюю скорость реакции за этот промежуток времени;
б) концентрацию вещества в через 20 мин.
Решение (см. приложение № 7).
Слайд 19
Самопроверка
а) подставить данные задачи в формулу:
скорость реакции увеличится
в 81 раз.
б)
Скорость реакции уменьшится в 3 раза.
Слайд 20
Закрепление знаний
2) Самостоятельная работа учащихся:
Задание 1. Составьте кинетические
уравнения для следующих реакций:
А) H2 + I2 =
2HI; Б) 2 Fe + 3CI2 = 2 FeCI3.
Задание 2. Как изменится скорость реакции, имеющей кинетическое уравнение
v= kC А 2 С В, если
А) концентрацию вещества А увеличить в 3 раза;
Б) концентрацию обоих веществ увеличить в 2 раза. Решение (см. приложение № 7).
Слайд 21
Самопроверка
Решение. Подставим соответствующие данные в кинетическое уравнение, сравним
скорости реакций.
а)
скорость реакции
увеличится в 9 раз.б)
скорость реакции увеличится в 8 раз.
Слайд 22
Домашнее задание
Параграф 15 учебника
Составить обобщающую таблицу. Приложение
№ 8.
Выполнить тесты. Приложение № 9.
Слайд 23 Закономерности изменения скорости химической реакции в зависимости от
различных факторов(приложение 8)
Слайд 24
Тесты (приложение 9)
Вариант 1. Скорость химических реакций.
Часть А. Тестовые задания с выбором ответа и на
соотнесение1. (2 балла). Фактор, не влияющий на скорость химической реакции:
A. Давление. Б. Катализатор. B. Концентрации реагирующих веществ. Г. Форма сосуда, в котором протекает реакция.
2. (2 балла). С увеличением концентрации азота в 2 раза скорость прямой химической реакции, уравнение которой N2 + О2 ↔ 2NO:
A. Не изменится. Б. Увеличится в 2 раза. B. Увеличится в 4 раза Г. Уменьшится в 4 раза.
3. (2 балла). С увеличением давления в 5 раз скорость прямой химической реакции, уравнение которой 2NO + О2 ↔ 2NO2, увеличится:
А. В 5 раз. В. В 75 раз. Б. В 25 раз. Г. В 125 раз.
4. (2 балла). При повышении температуры на 10 °С (температурный коэффициент γ = 2) скорость химической реакции увеличится:
А. В 2 раза В. В 8 раз. Б. В 4 раза. Г. В 16 раз.
5. (2 балла). Максимальная скорость химической реакции при взаимодействии веществ, формулы которых:
A. Zn(гран.) и НС1. В. РЬ и НС1. Б. Zn(пыль) и НС1. Г. Fe и НС1.
6. (2 балла). Скорость химической реакции, уравнение которой
Mg + 2HCl = MgCl2 + H2↑, при уменьшении концентрации кислоты за каждые 10 с на 0,04 моль/л равна:
А. 0,00004 моль/л•с). В. 0,004 моль/(л•с). Б. 0,0004 моль/л•с). Г. 0,04 моль/л•с).
7. (8 баллов). Установите соответствие.
Уравнение реакции: 1. С + О2= СО2. 2. С + СО2 = 2СО.
Формула для определения скорости реакции:
A. v = k·C(О2). B. v = k.C(O2)·C(С). Б. v = k·C(С).С(СО2). Г. v = k·C(CО2).
Часть Б. Задания со свободным ответом
8. (6 баллов). Запишите схему химической реакции, скорость которой можно рассчитать по формуле v = k • СА • СВ.
9. (4 балла). Почему, если смешать твердый нитрат свинца (II) и иодид калия, признаки реакции можно наблюдать через несколько часов, а если слить растворы этих солей, признаки реакции появятся сразу. Напишите уравнение реакции в молекулярном и ионном видах.
10. (6 баллов). Составьте термохимическое уравнение реакции разложения карбоната кальция, если для разложения 25 г карбоната кальция потребовалось 44,5 кДж теплоты




























