узнаем о строении вещества?
Каково строение атома?
Как можно узнать
о строении атома?
Имеет ли ядро атома
внутреннюю структуру?
Что такое электрон?
Входят ли электроны
в состав ядра?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть





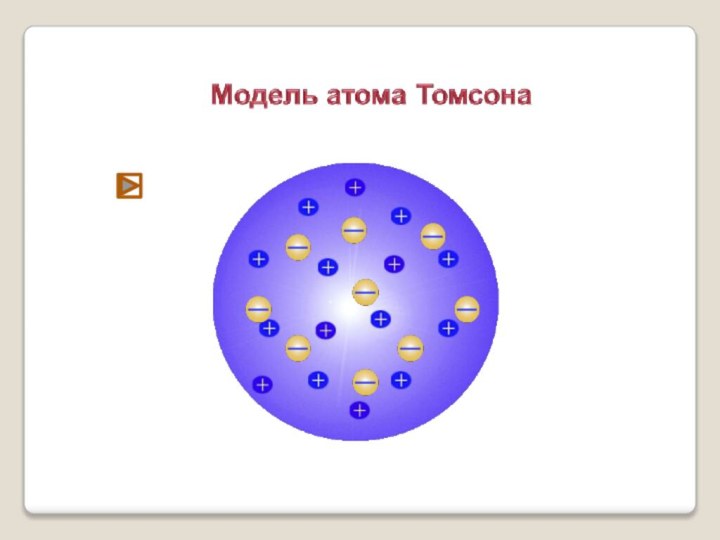











Позиция Аристотеля:
« Делимость вещества бесконечна».
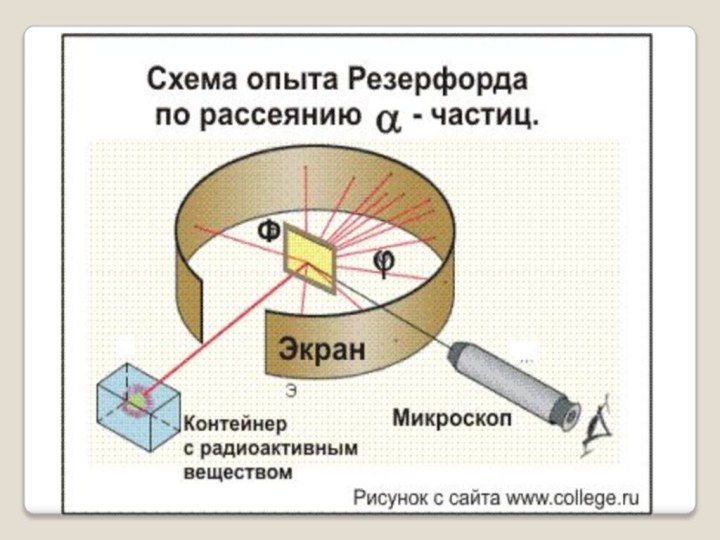
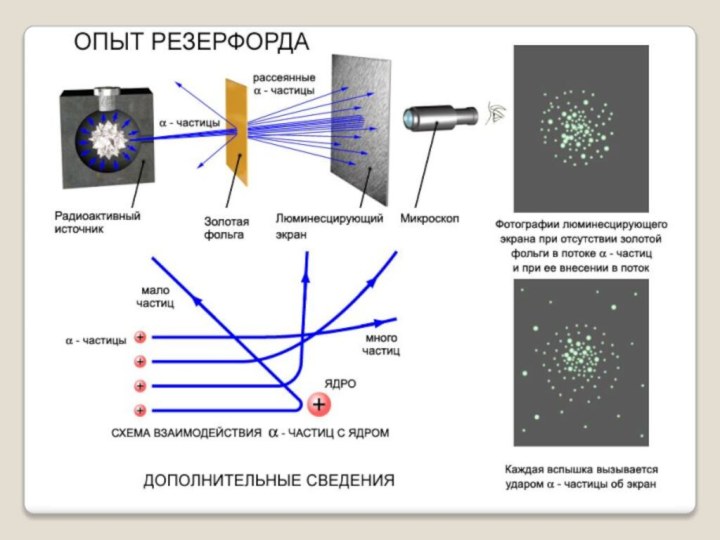
В 1909г. Эрнест Резерфорд совместно со своими сотрудниками Г. Гейгером и Э. Марсденом провёл ряд опытов по исследованию состава и строения атомов.
Резерфорд Эрнест (1871–1937) – английский физик, основоположник ядерной физики. Его исследования посвящены атомной и ядерной физике, радиоактивности.
Своими фундаментальными открытиями в этих областях заложил основы современного учения о радиоактивности и теории строения атома.
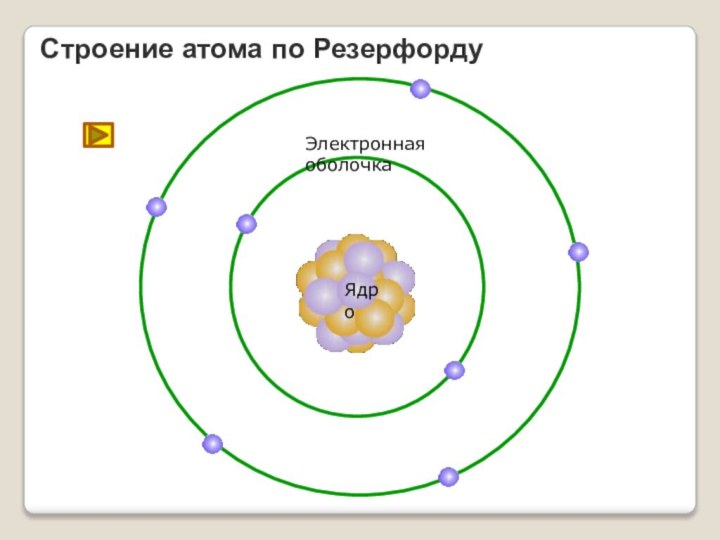
Электроны, по Резерфорду, движутся вокруг ядра.
Оказалось, что радиус ядра R(1014 ÷ 1015)м и зависит от числа нуклонов в ядре.
К явлениям атомных масштабов законы классической физики неприменимы.