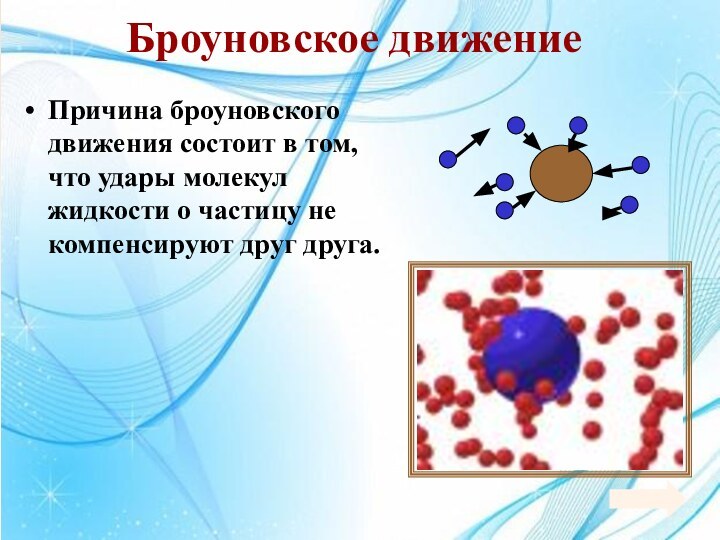
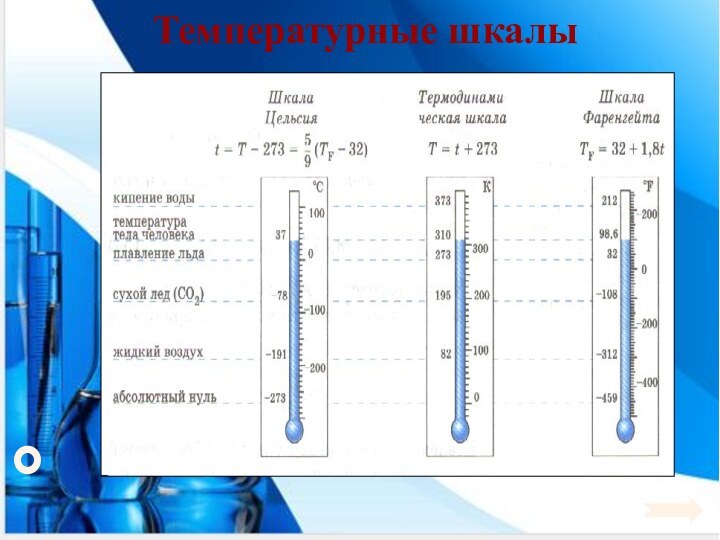
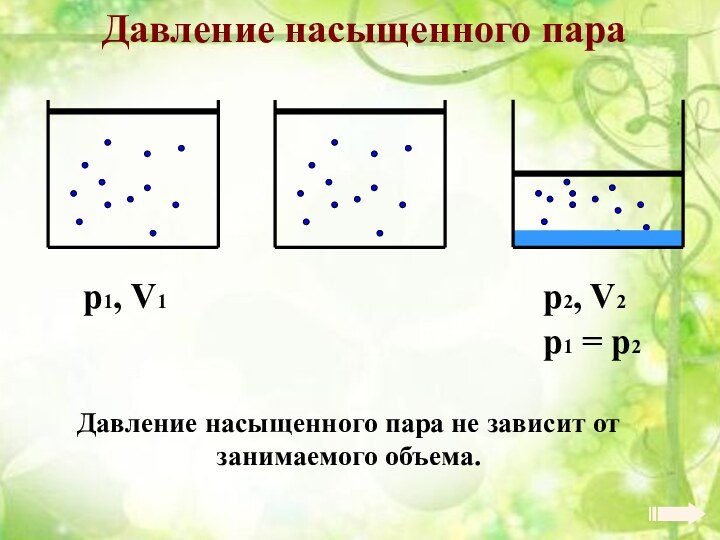
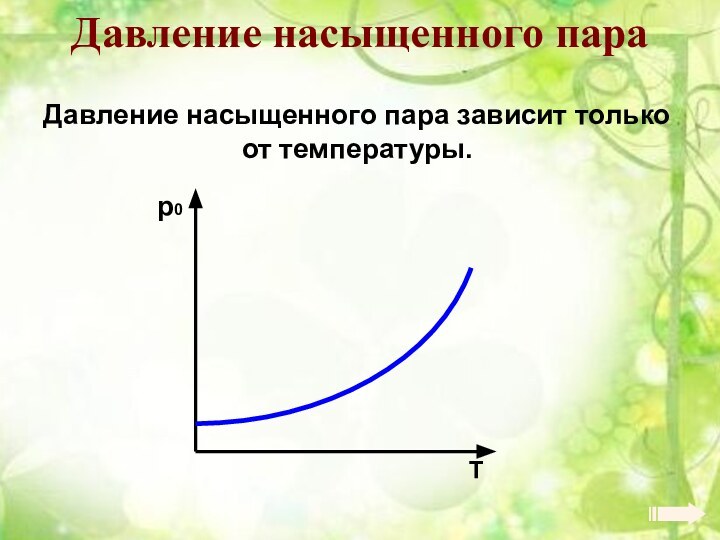
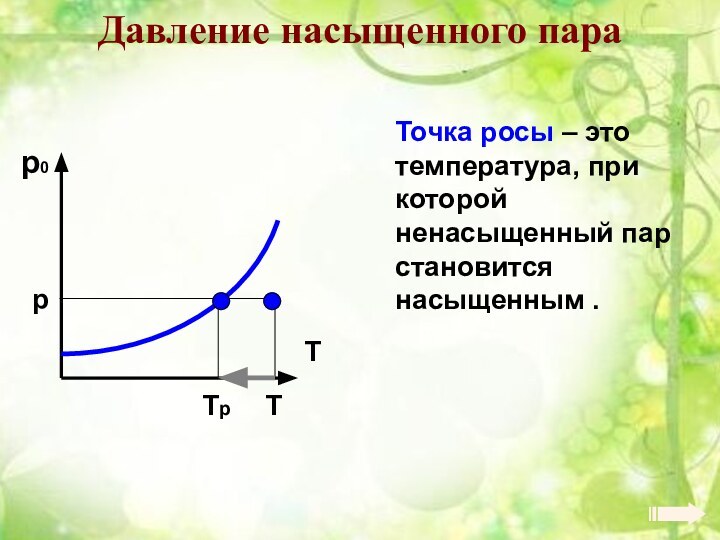
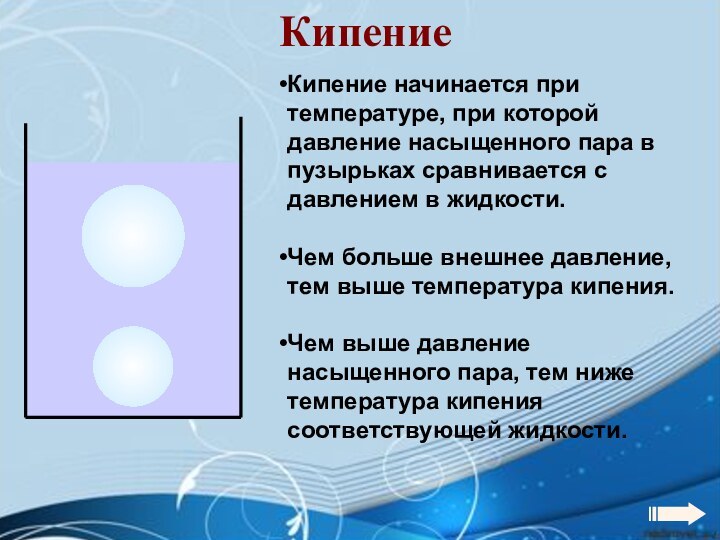
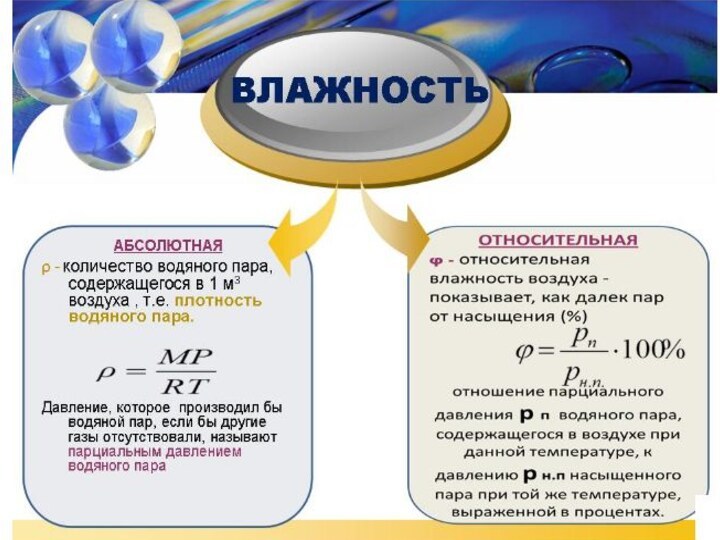
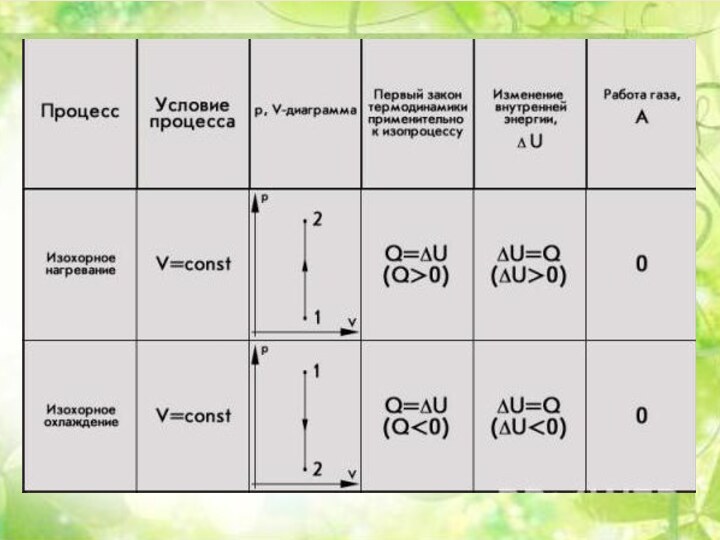
Энергия теплового движения молекул2. Температура. Энергия теплового движения молекул.
3.
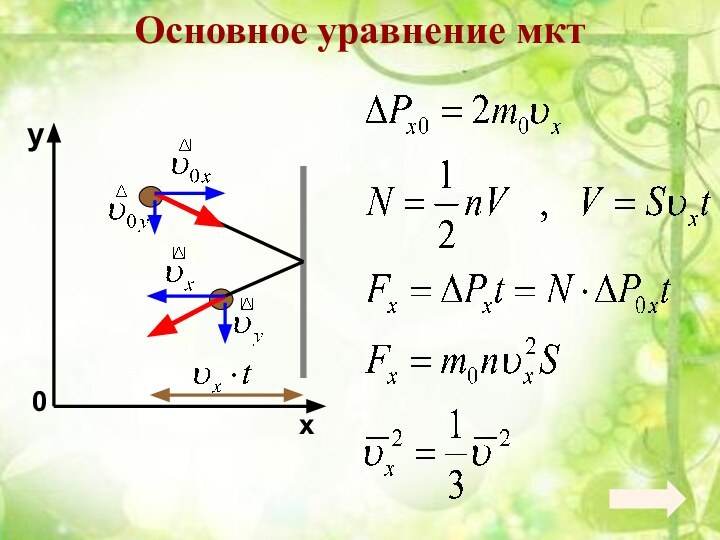
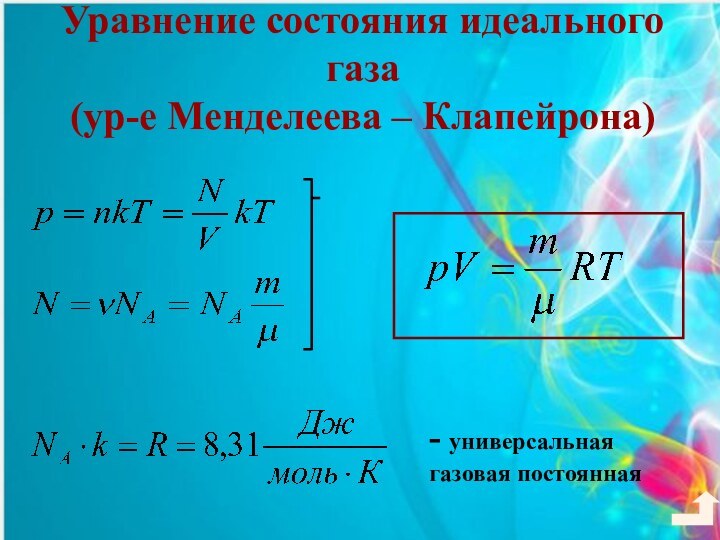
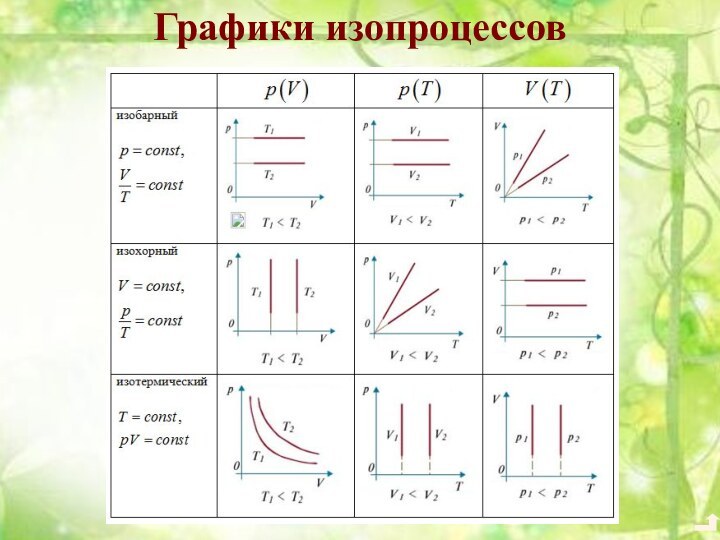
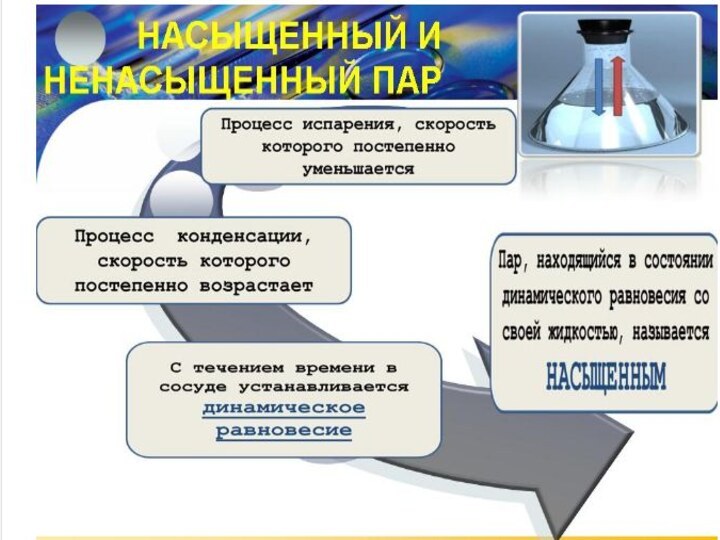
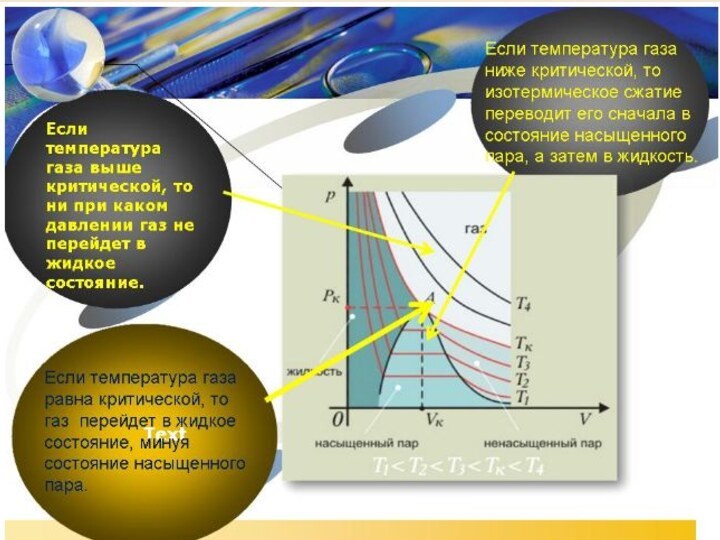
3. Уравнение состояния идеального газа. Газовые законы.4. Взаимные превращения жидкостей и газов.
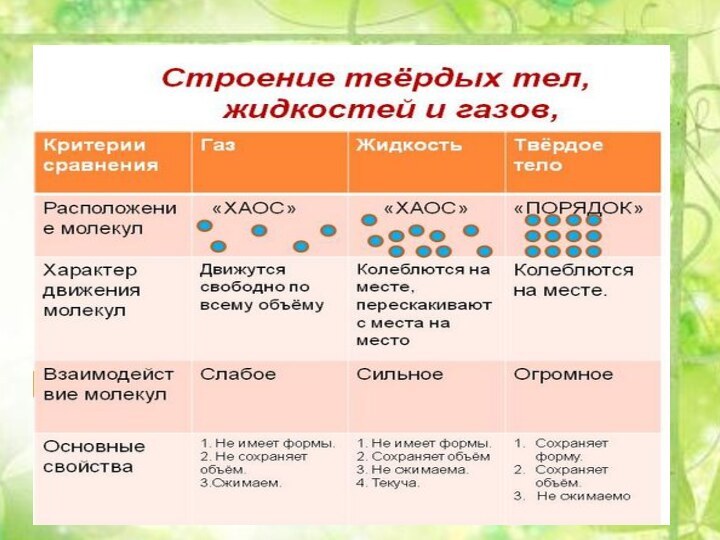
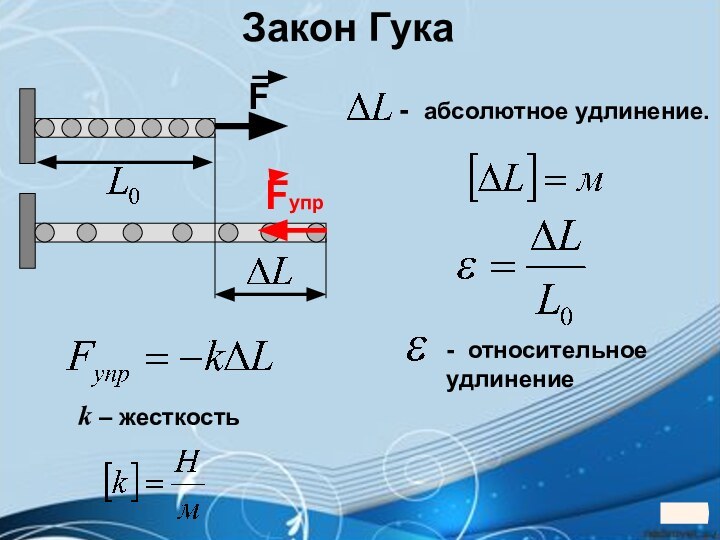
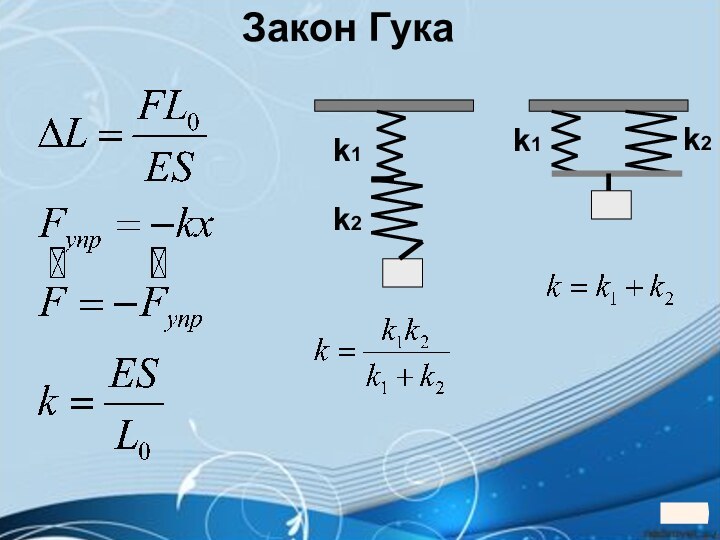
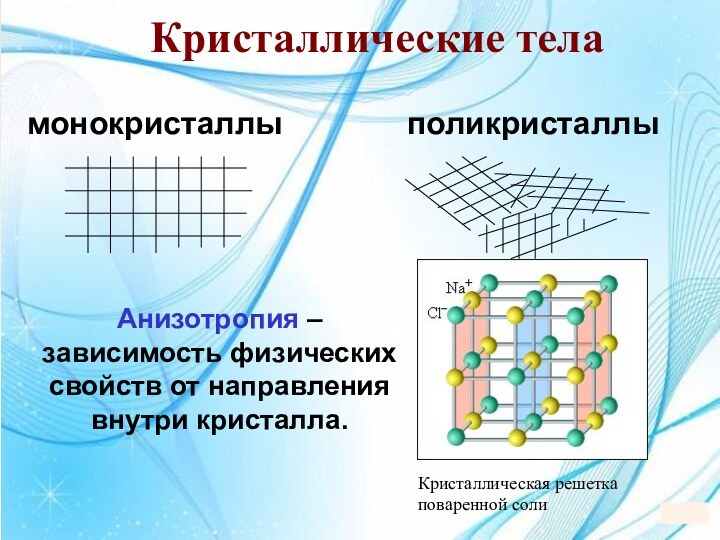
5. 5. Твердые тела5. Твердые тела.
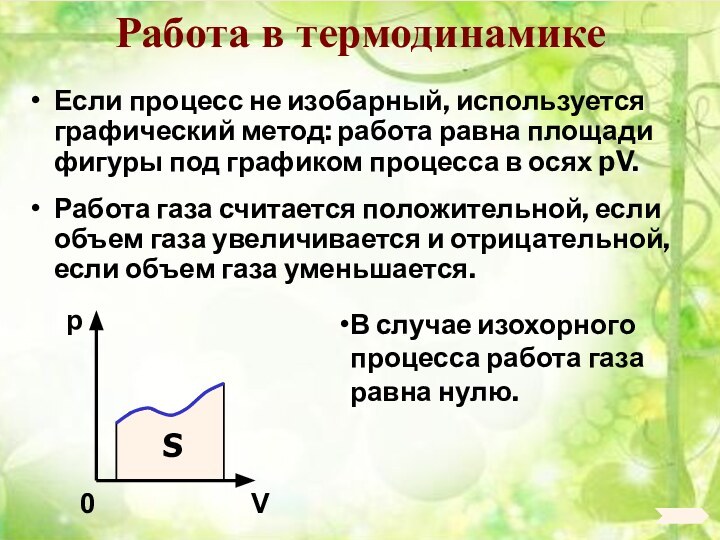
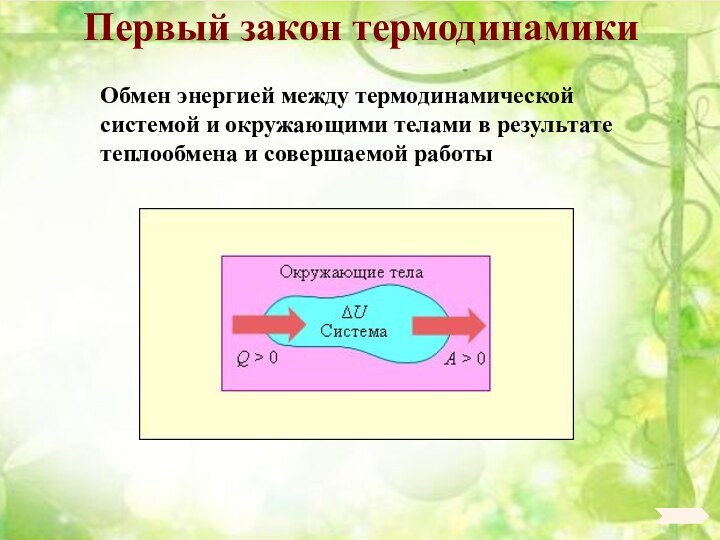
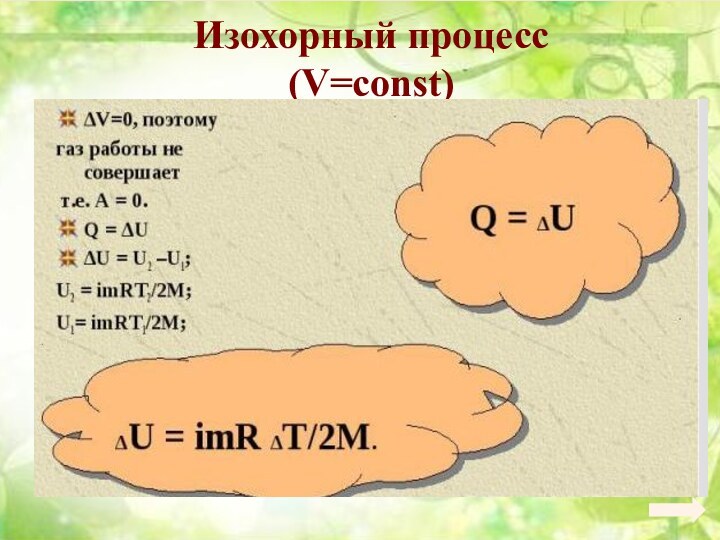
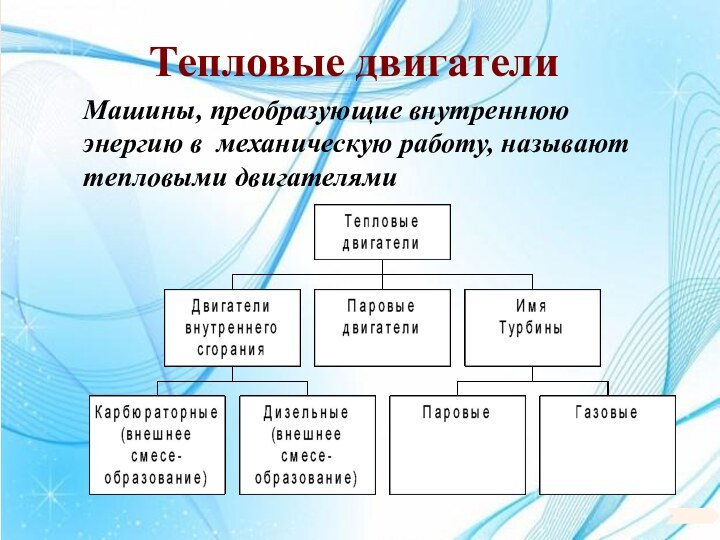
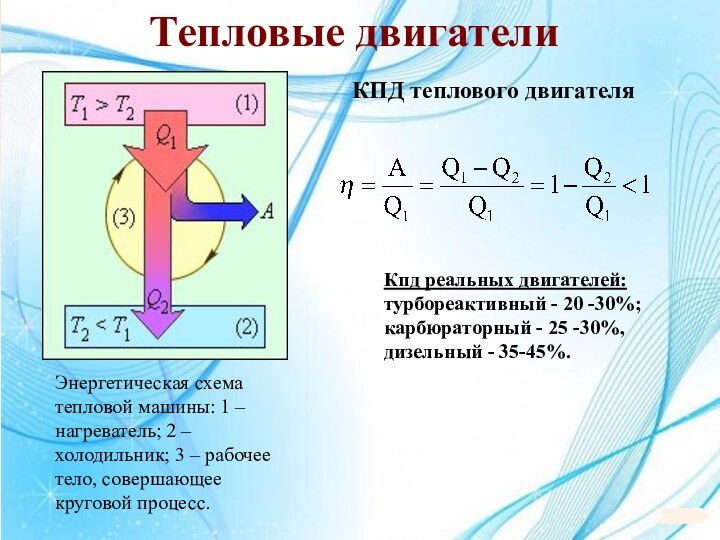
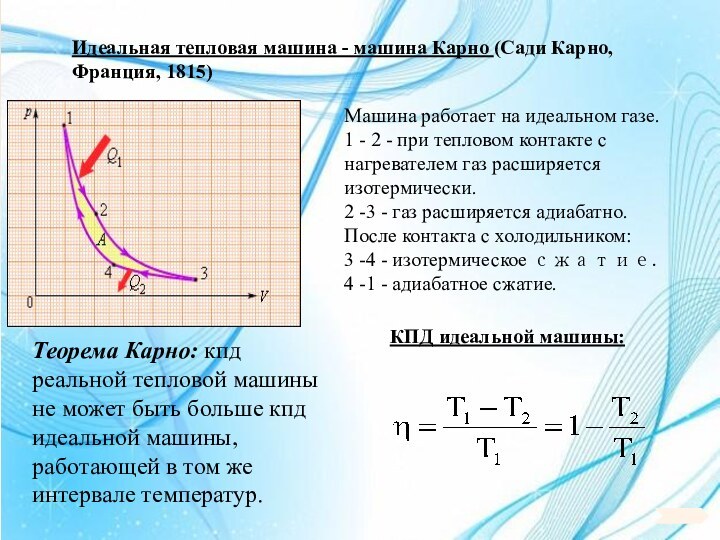
6. 6. Основы термодинамики.