- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по физике на тему Реальные газы. Уравнение Ван-дер-Ваальса
Содержание
- 2. Ян Дидерик Ван-дер-ВаальсНидерландский физик, лауреат Нобелевской премии по физике в 1910 г.
- 3. Реальный газ — газ, который не описывается
- 4. Метастабильное состояние (от греч. μετα «через» и
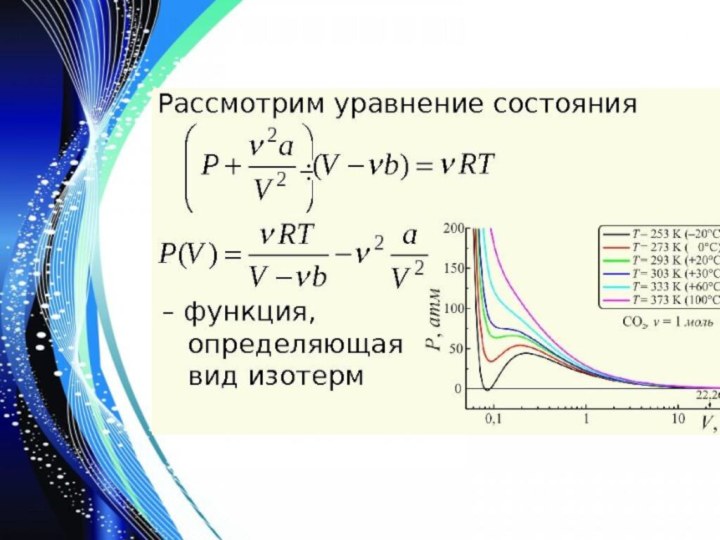
- 5. Уравнение состояния газа Ван-дер-Ваальса — уравнение, связывающее основные термодинамические.
- 6. Для одного моля газа уравнение Ван-дер-Ваальса имеет вид:
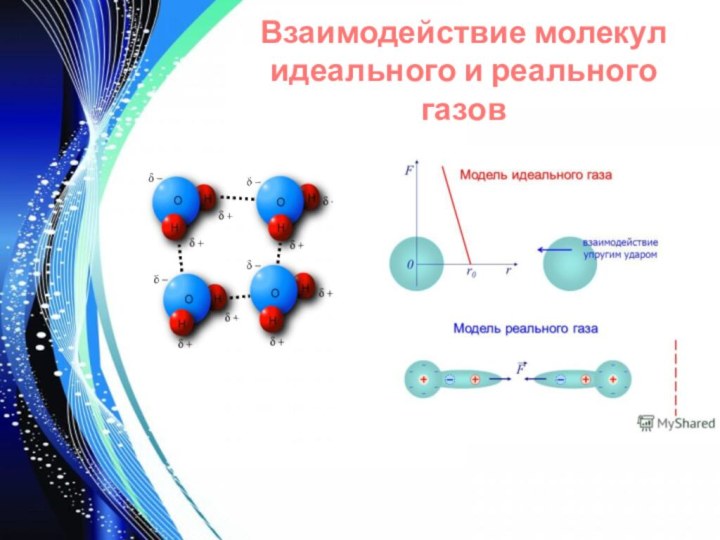
- 8. Взаимодействие молекул идеального и реального газов
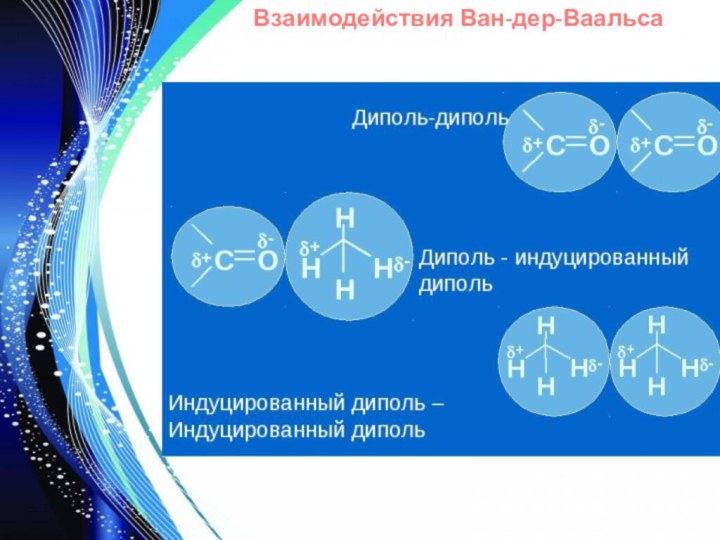
- 9. Взаимодействия Ван-дер-Ваальса
- 11. Скачать презентацию
- 12. Похожие презентации
Ян Дидерик Ван-дер-ВаальсНидерландский физик, лауреат Нобелевской премии по физике в 1910 г.







Слайд 2
Ян Дидерик Ван-дер-Ваальс
Нидерландский физик, лауреат Нобелевской премии по
физике в 1910 г.
Слайд 3 Реальный газ — газ, который не описывается уравнением
состояния идеального газа Клапейрона — Менделеева.
Реальный газ
Изотермы реального газа
(схематично)Синие — изотермы при температуре ниже критической. Зелёные участки на них — метастабильные состояния.
Участок левее точки F — нормальная жидкость.
Точка F — точка кипения.
Прямая FG — равновесие жидкой и газообразной фазы.
Участок FA — перегретая жидкость.
Участок F′A — растянутая жидкость (p<0).
Участок AC — аналитическое продолжение изотермы, физически невозможен.
Участок CG — переохлаждённый пар.
Точка G — точка росы.
Участок правее точки G — нормальный газ.
Площади фигуры FAB и GCB равны.
Красная — критическая изотерма.
K — критическая точка.
Голубые — сверхкритические изотермы
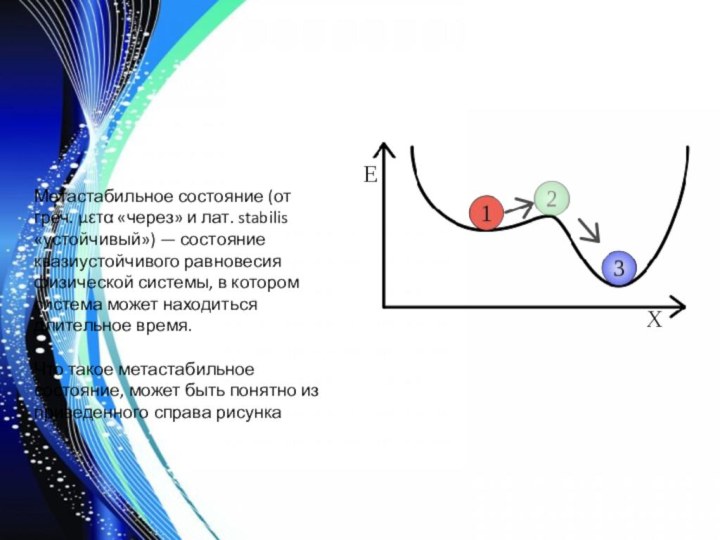
Слайд 4 Метастабильное состояние (от греч. μετα «через» и лат.
stabilis «устойчивый») — состояние квазиустойчивого равновесия физической системы, в
котором система может находиться длительное время.Что такое метастабильное состояние, может быть понятно из приведенного справа рисунка





























